小檗堿調(diào)節(jié)ERK/NF-κB信號(hào)通路改善高糖誘導(dǎo)的系膜細(xì)胞異常增殖
胡亞琴,汪佳佳,吳 昊,劉 青,唐麗琴,2,魏 偉
糖尿病腎病(diabetic nephropathy, DN)被認(rèn)為是造成終末期腎臟功能衰竭的主要原因之一。DN的主要病理變化是腎小球系膜細(xì)胞(mesangial cells, MCs)異常增殖,腎小球系膜基質(zhì)擴(kuò)張和基底膜增厚,MCs的異常增殖是導(dǎo)致腎小球系膜基質(zhì)增加和細(xì)胞外基質(zhì)(extracellularmatrix, ECM)沉積增加的重要原因,而Ⅳ型膠原蛋白(collagen Ⅳ, Col-Ⅳ)和纖維連接蛋白(fibronectin, FN)是ECM的主要成分。研究表明,細(xì)胞外信號(hào)調(diào)節(jié)激酶(extracellular signal-regulated kinase, ERK)在調(diào)節(jié)細(xì)胞的增殖、分化過程中具有重要作用。促分裂原激活激酶1(mitogenstress activated kinase 1, MSK1)是ERK的下游激酶,可誘導(dǎo)核轉(zhuǎn)錄因子kappa B(nuclear factor kappa B, NF-κB)的激活。小檗堿(berberine, BBR)具有抗氧化活性、調(diào)節(jié)血脂和減輕炎癥等多種藥理作用。課題組前期研究表明,BBR可能在抑制腎小球MCs的增殖和分泌中起重要作用。該研究通過探討B(tài)BR能否調(diào)節(jié)ERK/NF-κB信號(hào)通路改善高糖誘導(dǎo)的MCs的異常增殖,進(jìn)一步研究BBR對(duì)DN的藥理作用機(jī)制。
1 材料與方法
1.1 材料
1.1.1
細(xì)胞小鼠MCs株(147589)購自中科院上海細(xì)胞庫。
1.1.2
藥物BBR(BW 50137)購自北京北納創(chuàng)聯(lián)生物技術(shù)研究所,純度為98.37%(液相色譜法)。配置方法:稱量BBR粉末20.182 5 g,加入5 ml生理鹽水,并通過加熱和超聲處理使其完全溶解,得到終濃度為1.2×10μmol/L的BBR母液,采用0.22 μm無菌濾器除去細(xì)菌后-20 ℃存放。使用前水浴加熱,使其溶解后,稀釋數(shù)倍至所需濃度即可。
1.1.3
試劑CCK-8試劑盒購自日本同仁化學(xué)研究所;DMEM培養(yǎng)液購自美國(guó)Hyclone公司;胎牛血清購自以色列Biological Industries公司;青霉素-鏈霉素溶液、胰酶、一抗稀釋液、二抗稀釋液,DAPI 染液及防熒光淬滅劑購自上海碧云天生物技術(shù)研究所;6孔細(xì)胞培養(yǎng)板購自無錫NEST公司;鼠源FN購自武漢Proteintech公司;兔源Col-Ⅳ購自英國(guó)Abcam公司;兔源ERK、p-ERK購自美國(guó)affinity公司;IκB、p-IκB、p65、p-p65購自美國(guó)Cell Signaling Technology公司。
1.1.4 儀器
電泳儀購自北京六一儀器廠;SW-CJ-1F 超凈工作臺(tái)購自蘇州蘇凈集團(tuán)安泰公司;BioTek Elx×808 酶標(biāo)儀購自美國(guó)BioTek 公司;激光共聚焦顯微鏡購自德國(guó)萊卡公司;Image Xpress Micro 4 型高內(nèi)涵細(xì)胞成像系統(tǒng)購自美國(guó)Molecular Devcies 公司;ImageQuant LAS 4000熒光及化學(xué)發(fā)光成像系統(tǒng)購自美國(guó)GE Healthcare Life Sciences公司。1.2 細(xì)胞培養(yǎng)
從液氮中取出凍存細(xì)胞,在37 ℃水浴中解凍并離心,使用含有10% FBS和1%雙抗的DMEM低糖完全培養(yǎng)基培養(yǎng)細(xì)胞,在5% CO和37 ℃的培養(yǎng)箱培養(yǎng)細(xì)胞。1.3 細(xì)胞活力
CCK-8法檢測(cè)處于指數(shù)生長(zhǎng)期的MCs,將100 μl/孔的MCs單細(xì)胞懸液(約10個(gè)細(xì)胞)鋪于96孔培養(yǎng)板中,每組另設(shè)立5個(gè)平行對(duì)照組;待細(xì)胞完全貼壁后,分為對(duì)照(Control, 11.1 mmol/L葡萄糖)組,高糖(high gloss, HG)模型(HG,30 mmol/L葡萄糖)組和BBR給藥組(30、60、90 μmol/L)。給藥24 h后,每孔加入10 μl CCK8溶液后,避光孵育,每隔30 min使用酶標(biāo)儀測(cè)定每組在450 nm處的吸光度。取各組實(shí)驗(yàn)的平均值,重復(fù)3次實(shí)驗(yàn)。1.4 高內(nèi)涵細(xì)胞成像法檢測(cè)細(xì)胞增殖
將100 μl/孔的MCs單細(xì)胞懸液(約10個(gè)細(xì)胞)鋪于96孔培養(yǎng)板中,每組另設(shè)立5個(gè)平行對(duì)照組;待細(xì)胞貼壁完全后,分為Control組、 HG組和BBR給藥組(30、60、90 μmol/L)。給藥24 h后,使用PBS將細(xì)胞清洗2遍后,多聚甲醛固定30 min, 每孔加入20 μl的DAPI溶液染色5 min,棄DAPI染色液,加入PBS后,使用高內(nèi)涵細(xì)胞成像系統(tǒng)可以完整拍攝整孔細(xì)胞,每孔拍攝25張圖片。細(xì)胞數(shù)統(tǒng)計(jì):測(cè)量圖片中細(xì)胞核直徑的最大與最小值,設(shè)定細(xì)胞核直徑的識(shí)別范圍;測(cè)量細(xì)胞核熒光強(qiáng)度的最大與最小值,減去背景熒光強(qiáng)度,設(shè)定熒光強(qiáng)度的識(shí)別范圍,通過此兩個(gè)標(biāo)準(zhǔn)統(tǒng)計(jì)細(xì)胞總數(shù),選擇模塊以分析細(xì)胞總數(shù)并將結(jié)果導(dǎo)出至 Excel表格。1.5 激光共聚焦法檢測(cè)FN和Col-Ⅳ的表達(dá)
用胰酶消化細(xì)胞后,對(duì)細(xì)胞進(jìn)行計(jì)數(shù),將500 μl/孔的MCs單細(xì)胞懸液(約10個(gè)細(xì)胞)鋪于含有蓋玻片的24孔板內(nèi),待細(xì)胞貼壁,分為Control組、HG組和BBR給藥組,細(xì)胞培養(yǎng)24 h后,棄去培養(yǎng)基,使用PBS清洗3遍,每次5 min,棄去PBS;4%多聚甲醛室溫下固定細(xì)胞30 min后, PBS清洗細(xì)胞3遍,每次5 min,棄去PBS;5% BSA室溫下封閉30 min后, PBS清洗細(xì)胞3遍,每次5 min,棄去PBS;一抗(1 ∶100) 4 ℃過夜;回收一抗后, PBS清洗細(xì)胞3遍,每次5 min,棄去PBS;加入熒光二抗200 μl,室溫下避光孵育1 h后, PBS清洗3遍,每次10 min,棄去PBS;加入DAPI染液200 μl染核10 min后, PBS清洗細(xì)胞3遍,每次10 min,棄去PBS;將蓋玻片放置平面上,待其干后,將防熒光淬滅劑滴在載玻片上進(jìn)行封片,蓋玻片四周涂上指甲油用來密封。使用激光共聚焦顯微鏡對(duì)細(xì)胞觀察拍照。1.6 Western blot檢測(cè)相關(guān)蛋白表達(dá)
取對(duì)數(shù)生長(zhǎng)期細(xì)胞,將 2 ml/孔的MCs單細(xì)胞懸液(約10個(gè)細(xì)胞)接種于6孔板中,處理同“1.3”項(xiàng),培養(yǎng)24 h后,使用PBS清洗2遍,棄去PBS,現(xiàn)配RIPA加PMSF后,使之充分裂解后,收集上清液,使用BCA測(cè)定蛋白濃度。將蛋白上樣緩沖液加入到蛋白樣品中,100 ℃水浴10 min,然后完成上樣,跑膠、轉(zhuǎn)膜、封閉等步驟,用目的蛋白抗體4 ℃孵育過夜,使用TPBS洗膜3次后,用適宜濃度的二抗工作液37 ℃孵育2 h,顯影后使用灰度圖分析得出結(jié)果。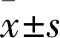
2 結(jié)果
2.1 BBR對(duì)MCs增殖活力的影響
CCK-8結(jié)果顯示(圖1),與Control組相比,HG能增加MCs增殖活力(P
<0.01);與HG組相比,BBR給藥組(30、60、90 μmol/L)均能降低MCs增殖活力。
圖1 BBR對(duì)HG誘導(dǎo)的系膜細(xì)胞活力的影響
2.2 BBR對(duì)MCs增殖能力的影響
高內(nèi)涵結(jié)果顯示(圖2),與Control組相比,HG能增加MCs數(shù)量(P
<0.01);與HG組比較,BBR給藥組(30、60、90 μmol/L)均能抑制MCs的異常增殖。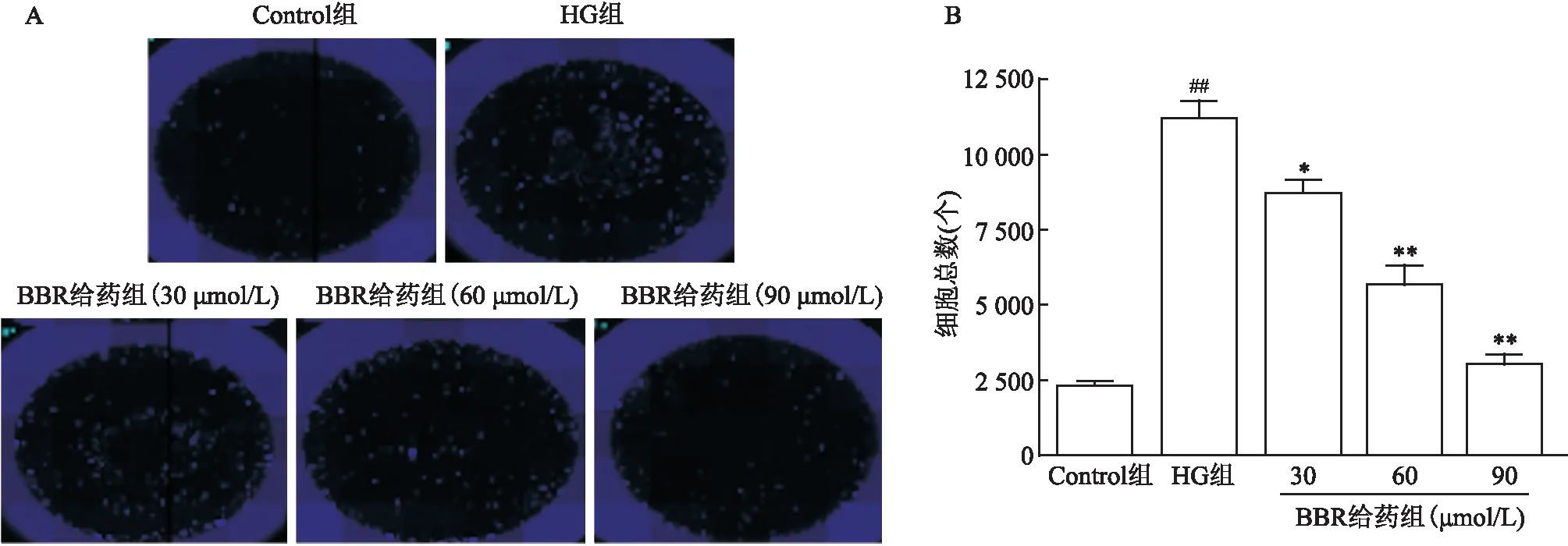
圖2 BBR對(duì)HG誘導(dǎo)的系膜細(xì)胞增殖的影響 與Control組比較:##P<0.01;與HG組比較:*P<0.05,**P<0.01
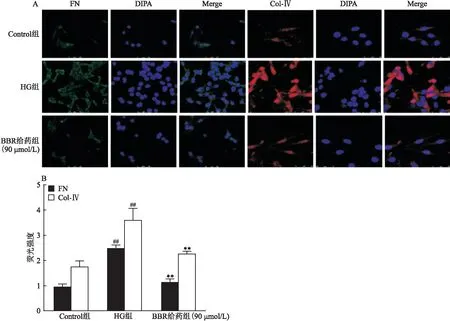
圖3 BBR對(duì)FN和Col-Ⅳ的表達(dá)水平影響的 ×400
2.3 BBR對(duì)FN和Col-Ⅳ表達(dá)的影響
激光共聚焦結(jié)果顯示(圖3),與Control組相比,HG組的FN和Col-Ⅳ的表達(dá)升高;與HG組比較,BBR給藥組(90 μmol/L)的FN和Col-Ⅳ的表達(dá)降低。2.4 BBR對(duì)MCs上ERK/NF-κB蛋白表達(dá)水
平的影響
ERK/NF-κB信號(hào)通路是參與細(xì)胞異常增殖的重要調(diào)節(jié)因子。Western blot結(jié)果顯示(圖4),與Control組相比,HG組中MCs上p-ERK、p-MSK1、p-IκB和p-p65蛋白表達(dá)水平升高(P
<0.01),BBR給藥組(30、60、90 μmol/L)能夠有效降低MCs上p-ERK、p-MSK1、p-IκB和p-p65蛋白表達(dá)水平。
圖4 BBR對(duì)ERK/NF-κB信號(hào)通路相關(guān)蛋白的的影響
3 討論
DN被認(rèn)為是糖尿病的主要微血管并發(fā)癥之一,也是造成終末期腎臟功能衰竭的主要原因。研究表明,DN主要是由于非酶促造成糖化、氧化應(yīng)激、腎血流動(dòng)力學(xué)變化、血脂異常、高血壓、蛋白激酶激活、血管活性物質(zhì)等因素造成的。腎小球系膜區(qū)由MCs和其自身分泌的細(xì)胞外基質(zhì)共同組成,對(duì)維持腎小球毛細(xì)血管網(wǎng)發(fā)揮了重要的支撐作用。此外,MCs具有一定的收縮功能,可通過調(diào)節(jié)細(xì)胞的收縮與舒張來參與腎小球的血流供應(yīng),具有維持系膜基質(zhì)穩(wěn)態(tài)和濾過作用。因此,MCs在維持腎小球正常功能中發(fā)揮了重要作用。在DN的病理發(fā)展過程中,MCs的異常增殖在早期腎肥大和晚期腎小球硬化中起了關(guān)鍵作用。研究顯示,多種刺激對(duì)MCs的增殖反應(yīng)都與DN的發(fā)生及發(fā)展有關(guān),其中高糖是MCs異常增殖的最有效刺激。高糖刺激MCs后,將會(huì)導(dǎo)致MCs的異常增殖和ECM,從而導(dǎo)致腎小球基底膜增厚以及腎小球系膜區(qū)基質(zhì)沉積,最終導(dǎo)致腎小球硬化。在本次實(shí)驗(yàn)中,用30 mmol/L葡萄糖成功刺激MCs 24 h后,檢測(cè)顯示與Control組比較,HG組MCs個(gè)數(shù)增多,細(xì)胞增殖活力增強(qiáng),MCs發(fā)生異常增殖,MCs上的FN和Col-Ⅳ的表達(dá)水平升高。
研究表明絲裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)作為真核細(xì)胞胞質(zhì)內(nèi)的信號(hào)轉(zhuǎn)導(dǎo)終末通路,與DN的發(fā)病機(jī)制密切相關(guān),而ERK是最具代表性的MAPK之一。在DN模型中發(fā)現(xiàn),阻斷ERK通路后導(dǎo)致MCs增殖減少,這表明了ERK在保護(hù)MCs中的重要作用。此外,在人類腎小球病變中,ERK通路的激活參與了細(xì)胞增殖、組織學(xué)病變和腎功能不全。在高糖刺激后,將導(dǎo)致ERK的一連串的磷酸化,使ERK1和ERK2的2種同工型的Thr-Glu-Try基序雙重磷酸化。ERK的磷酸化形式是一種活性激酶,可以使包括NF-κB在內(nèi)的許多轉(zhuǎn)錄因子磷酸化。在細(xì)胞中,NF-κB轉(zhuǎn)錄因子由于抑制蛋白(包括IκBα、IκBβ、IκBε和IκB)保留在胞質(zhì)中。刺激后,IKKs在32和36個(gè)絲氨酸殘基處都將IκBα抑制蛋白磷酸化,從而發(fā)生泛素化和蛋白酶體降解,隨后導(dǎo)致NF-κB從細(xì)胞質(zhì)到核的核易位,入核的NF-κB與基因啟動(dòng)子的調(diào)節(jié)區(qū)結(jié)合,并參與炎癥基因的表達(dá)。
BBR目前已廣泛應(yīng)用于治療胃腸炎和分泌性腹瀉等疾病。研究表明,BBR具有如抗氧化應(yīng)激、抗炎、抗微生物和抗癌等廣泛的藥理活性,在DN進(jìn)展中發(fā)揮了重要的腎臟保護(hù)作用。本研究通過在體外使用HG刺激MCs,同時(shí)使用不同濃度的BBR治療,來觀察BBR抑制MCs異常增殖的藥理機(jī)制,通過檢測(cè)MCs的細(xì)胞增殖活力、增殖能力、MCs上相關(guān)蛋白的表達(dá)水平,可知BBR在高糖環(huán)境下可以抑制MCs的異常增殖,減少ECM,并且可以有效調(diào)節(jié)高糖環(huán)境下MCs上ERK/NF-κB信號(hào)通路的表達(dá),從而抑制MCs的異常增殖。
綜上所述,本研究提示HG能促進(jìn)MCs的異常增殖與ECM沉積,而BBR能明顯逆轉(zhuǎn)此過程,其機(jī)制可能與調(diào)節(jié)MCs上ERK/NF-κB信號(hào)通路的活化有關(guān)。

