不同的培養條件對腦膠質瘤U251細胞增殖及凋亡的影響
方金梅,王 凡,孔令玲,趙于飛,方 晶,吳愛林,劉 云
腦膠質瘤是成人中最常見的中樞神經系統腫瘤之一,其惡性程度高、預后差。膠質母細胞瘤是WHO Ⅳ級惡性腦膠質瘤。其臨床特點表現為侵襲性生長,通常手術無法完全切除,而殘存的腫瘤對放化療不敏感、復發率高、預后差,且中位生存期僅為15個月。腦膠質瘤的發生及發展是由多因素參與并受多步驟調控的復雜過程。研究表明,受體絡氨酸激酶在大多數腦膠質瘤中過表達,其介導的信號轉導通路的異常激活是腦膠質瘤的重要分子生物學特征之一。其中,絲裂原活化蛋白激酶MAPK信號通路在調節腦膠質瘤細胞的增殖、分化及抗凋亡中起到關鍵的作用。此外,ERK1/2作為MAPK信號通路重要的下游分子,在腦膠質瘤患者的腫瘤組織中高表達;體外研究顯示ERK1/2在腦膠質瘤細胞株以及膠質瘤原代腫瘤細胞中持續表達,而抑制ERK1/2信號影響腦膠質瘤細胞的增殖、遷移和分化。Wang et al發現,細胞的培養條件影響人膠質母細胞瘤細胞株U251細胞中MAPK/ERK1/2信號通路的激活。母代細胞的生長狀態(如處在細胞生長曲線的指數期或平臺期)以及其傳代細胞的種植密度均對蛋白激酶ERK1/2的磷酸化產生影響;然而,對U251細胞功能的影響及相關分子機制尚未闡明。基于此,該研究將設定4種培養方式來探究不同的細胞培養條件對U251生長狀況的影響及相關機制。
1 材料與方法
1.1 細胞培養
人膠質瘤U251細胞用含10%胎牛血清及100 U/ml青-鏈霉素的RPMI 1640培養液培養,并在37 ℃、5% CO飽和濕度的培養箱中培養。細胞采用胰酶消化,每3~4 d進行傳代培養。實驗所用的U251細胞傳代次數均在12次之內。1.2 細胞增殖實驗
培養U251細胞至指數期及平臺期,取相應的細胞重新種植于高密度(8×10/cm)及低密度(2.4×10/cm)[相對于正常細胞培養密度(4×10/cm)]。現設定以下4種培養方式:① EH,母代處于指數期的U251細胞以高密度種植;② EL,母代處于指數期的U251細胞以低密度種植;③ PH,母代處于平臺期的U251細胞以高密度種植;④ PL,母代處于平臺期的U251細胞以低密度種植。在各組細胞中采用胰酶消化、臺盼藍染色后,進行細胞計數;每次實驗重復3次后,繪制生長曲線。1.3 Western blot檢測
用蛋白裂解液RIPA提取不同培養狀態及時間點(6、24、48 h)的U251細胞蛋白,并利用Bradford法測定總蛋白濃度。采用Western blot檢測各組蛋白表達量變化,包括p-ERK1/2,cleaved-caspase3、cleaved-caspase8、P27、cyclinD1、p-PLK、p-FPAK。每組用15~20 μg蛋白加入同體積的2×蛋白上樣緩沖液,于95 ℃ 煮沸5 min,用12% SDS-PAGE將蛋白分離,后將蛋白轉移至硝酸纖維膜,5% BSA室溫封閉1 h,隨后在一抗中孵育、4 ℃過夜。第2天室溫孵育二抗1 h。最終使用ECL 顯色液于暗室曝光顯影。1.4 半胱天冬酶-3活性實驗
采用比色活性測定試劑盒檢測半胱天冬酶(caspase)-3的活性,操作如下:細胞在冰上用冰裂解液(50 mmol/L HEPES、100 mmol/L NaCl、0.1% CHAPS、100 μmol/L EDTA、1 mmol/L DTT)裂解,20 μl的細胞提取物加入70 μl的緩沖液中,并另外加入10 μl熒光底物Ac-DEVD-AFC(用緩沖液稀釋至50 μg/ml)。每個樣本重復3次。在室溫黑暗中孵育1 h后,使用激發光為405 nm 且發射光為 505 nm 的熒光讀取器可檢測熒光。同時,采用Bradford方法檢測每個樣品的蛋白濃度,最終吸收強度除以蛋白濃度得到caspase3活性定量值,用相對熒光單位RFU來表達。1.5 流式細胞
流式細胞用來檢測不同條件下U251細胞的細胞周期分布及Ki67的表達。胰酶消化后,收集1×10U251細胞并移至15 ml離心管中,用PBS洗3遍后再重懸到500 μl冰PBS中,重懸液緩慢滴到500 μl冰2% PFA中,在冰上孵育5 min。隨后細胞重懸至500 μl破膜液0.25% Triton X-100并孵育5 min,最后重懸至100 μl PBS并移至1.5 ml Eppendorf管中。隨后,5 μl Ki67抗體(Alexa Fluor? 647)加入重懸液中,混勻并于室溫黑暗中孵育1 h。之后清洗并將細胞重懸至500 μl PBS中,加入2 μg/ml PI及50 μg/ml RNA酶,在室溫黑暗中孵育30 min。樣品準備完畢后在上機實驗,數據使用Flowjo version 10分析。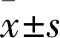
2 結果
2.1 細胞培養方式影響U215的生長曲線
在EH、EL、PH和PL組中,利用細胞計數法繪制生長曲線。結果顯示無論EL或PL狀態下,U251細胞均快速增殖;在PH狀態下,細胞仍繼續快速生長;而在EH情況下,細胞增長緩慢(圖1A)。在EH中這種細胞緩慢增殖的情況,不隨細胞培養基的更新而改變(圖1B);并且,在EH組中伴有明顯的細胞脫壁;統計顯示,脫壁的細胞數占到總細胞數的2%~7%,而其余3組未有明顯的脫壁細胞(圖1C)。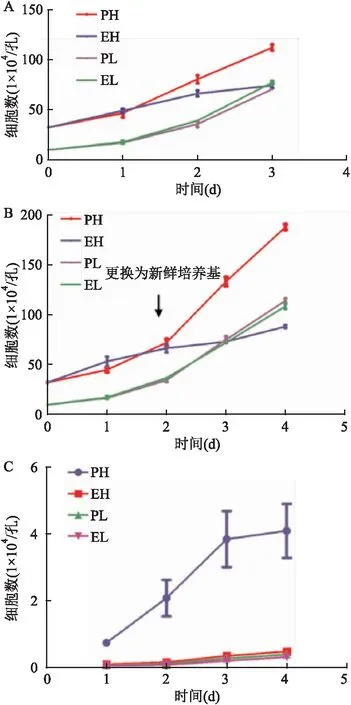
圖1 不同培養條件下U251細胞的增殖
2.2 EH培養方式導致U251細胞凋亡
利用Western blot的方法檢測EH組細胞中凋亡蛋白的表達情況。結果顯示EH組的細胞在48 h時cleaved-caspase3和cleaved-caspase8的表達明顯升高(圖2A)。caspase3活性實驗進一步驗證了上述實驗結果(圖2B),即在48 h時,與PH組相比,EH組的caspase3活性明顯增高(t
=6.724,P
=0.002 5)。因此這些結果提示母代處于指數期的U251細胞在重新種植于高密度后發生了凋亡。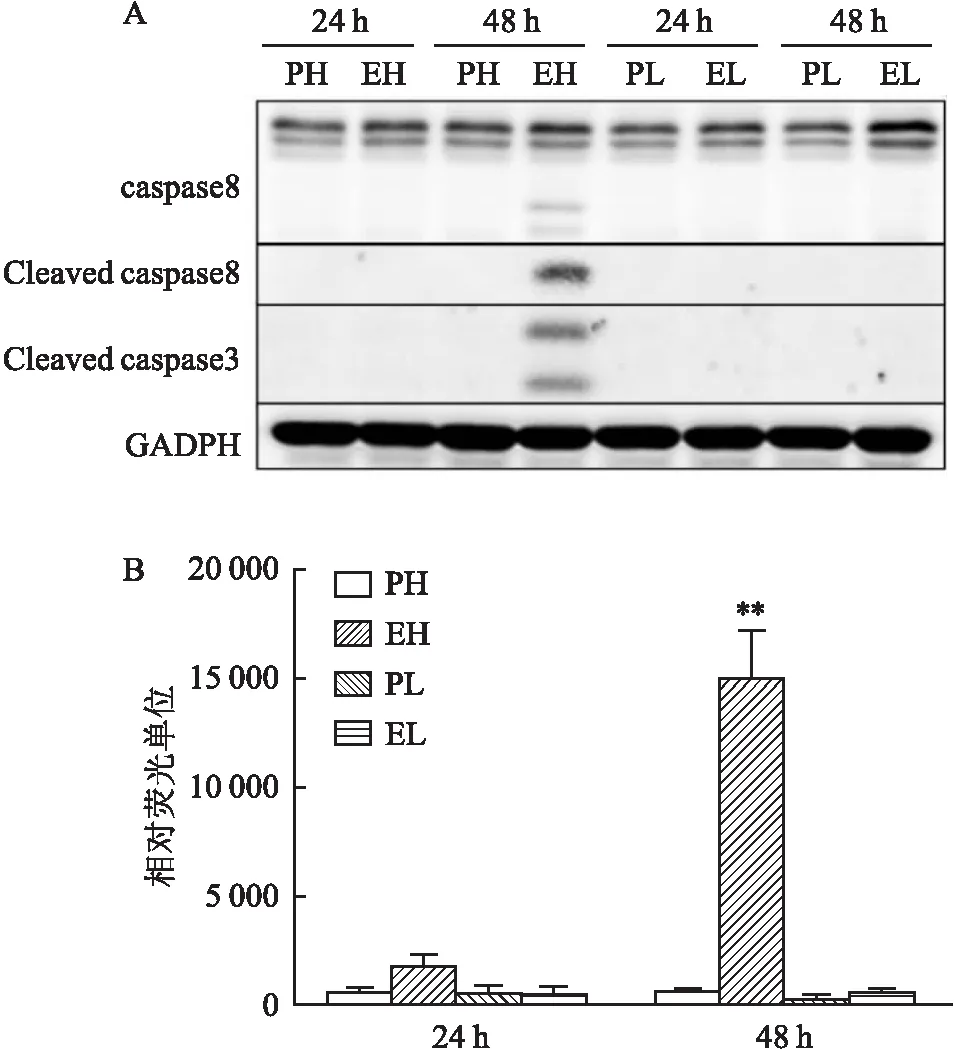
圖2 不同培養條件下在U251細胞中的caspase-3活性檢測
2.3 EH組中凋亡的細胞發生G2阻滯及細胞周期蛋白下調
為進一步探究不同的培養條件對U251細胞生長影響的相關機制,對不同組的細胞進行流式細胞檢測,同時對Ki67進行染色,以檢測不同周期中細胞的增殖情況。結果顯示在處理后的第1天,4組細胞的細胞周期分布無明顯差異:50%~60%的細胞在G1期,15%~20%的細胞在S期,20%~30%的細胞在G2期,并且所有細胞中均表達Ki67。然而,在處理后的第3天時,PH組中,70%的細胞處于G1期,15%處于S期,伴有部分Ki67表達。在EH組G1期的細胞降至約40%,而G2期約35%并伴有Ki67表達,提示G2期阻滯。盡管各組都有sub-G1期的細胞并呈現部分Ki67表達,但這部分細胞在EH組的占比高于其他組。另外,當細胞重新種植于低密度時,PL組和EL組細胞在第3天只有輕度G1期增高,并且所有細胞都為Ki67高表達(圖3A)。Western blot結果(圖3B)顯示EH組細胞在24 h后出現明顯的p-ERK1/2表達下調(t
=38.04,P
<0.000 1);EH組細胞的cyclinD1表達較PH組低,并且在24 h及48 h可見明顯的下降(t
=6.219,P
=0.000 8;t
=4.344,P
=0.004 9),這與生長曲線中第2天生長緩慢的結果一致。磷酸化PLK1是細胞進入有絲分裂期重要的蛋白,EH組細胞在48 h可見明顯p-PLK1明顯降低(t
=5.368,P
=0.001 7),這也驗證了細胞聚集在G2期。另外,與PH組相比,24 h EH組中p27的表達明顯上調(t
=4.483,P
=0.001 5),而以上蛋白的表達在PL與EL組之間無明顯差異(圖3C)。2.4 FAK信號通路對EH組細胞凋亡的影響
利用Western blot檢測不同的培養條件下FAK的表達情況。結果顯示(圖4A及4B)在EH組中,在6 h時,FAK-Y397磷酸化較PH組明顯下調(t
=3.981,P
=0.007 3),而Y925的磷酸化只在24 h明顯減少(t
=3.523,P
=0.012 5),而FAK-Y397和Y925的磷酸化表達情況在PL與EL組無明顯區別。因此,本課題組猜測FAK的表達降低可能與細胞脫壁有關,并進一步驗證增加FAK的表達是否可以阻止細胞凋亡。把U251細胞分別種植在包被0.83 mg/ml的膠原蛋白I或者10 ng/ml的纖維連接蛋白fibronectin的培養皿中,并在培養基中加入100 ng/ml IGF-1和10 ng/ml TGF-β。Western blot結果顯示上述處理方式并沒有增加p-ERK1/2的表達,且EH組仍發生細胞凋亡(圖4C)。這個結果說明FAK信號通路的下調并不是p-ERK1/2減少的原因,而且這種條件下引起的失巢凋亡并不依賴于FAK。2.5 細胞周期蛋白依賴性激酶抑制劑p27對EH組細胞凋亡的影響
在PH與EH組細胞中,除了ERK以外,細胞周期蛋白依賴性激酶抑制劑p27的表達也有差異,提示細胞周期調控可能參與凋亡過程。將指數期的母代細胞饑餓24 h后,利用Western blot檢測顯示p27的表達增高(圖5A)。為驗證p27對細胞凋亡的影響,將指數期的母代細胞在0.5%小牛血清的培養基中培養12 h,以升高基線p27的表達,然后再重新種植于高密度,并定義為0 h,繼續在該培養基中繼續培養12 h。之后,將培養基更換為含10%小牛血清的完全培養基,并收集相應時間點的細胞蛋白。Western blot顯示ERK1/2持續激活并且無明顯cleaved-caspase3及cleaved-caspase8的表達,提示無凋亡發生(圖5B)。另外,生長曲線顯示細胞快速生長,并無明顯細胞脫壁(圖5C)。這些結果證實上調p27的表達可以阻滯EH細胞發生凋亡,提示功能性表達p27在維持U251細胞增殖及抗凋亡的重要作用。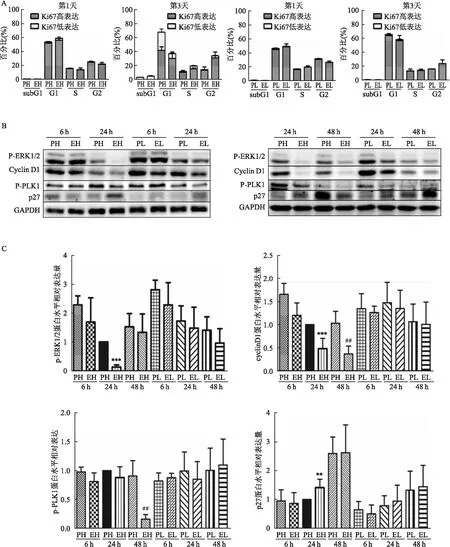
圖3 不同培養條件U251細胞的細胞周期的影響
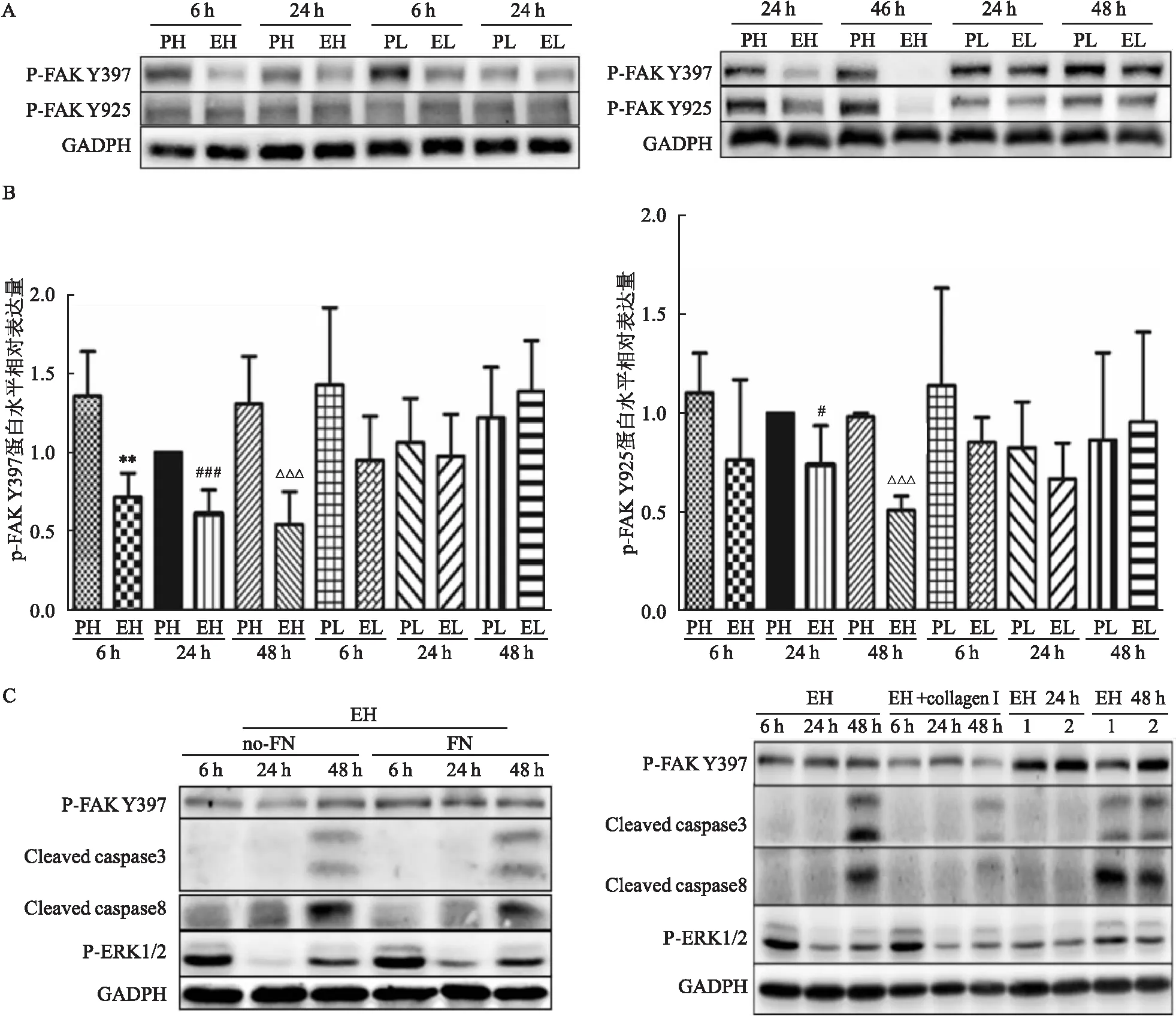
圖4 增加FAK的表達對細胞凋亡的影響
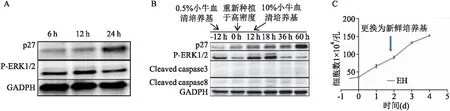
圖5 上調p27的表達對細胞凋亡的影響
3 討論
母代細胞的生長狀態及細胞密度對U251細胞中MAPK/ER1/2信號通路的激活有顯著影響。本研究顯示,當平臺期或指數期細胞種植于低密度時(PL和EL),U251細胞快速增殖,與母代細胞狀態無明顯關系,2組細胞生長無差異;將平臺期U251細胞種植于高密度時(PH),增殖明顯,這與升高的p-ERK1/2結果一致;將指數生長的U251細胞種植于高密度時(EH),增殖緩慢,這與ERK1/2磷酸化受抑制相關。EH組細胞同時伴隨明顯的細胞脫落,通過檢測凋亡相關蛋白caspase的激活提示細胞發生凋亡。
腦膠質瘤細胞與細胞外基質的相互作用以及黏附分子表達的改變,使侵襲性腦膠質瘤細胞不易發生凋亡。本研究顯示在EH培養條件下,U251細胞脫壁并發生凋亡,而Western blot顯示磷酸化FAK的表達下降。細胞脫壁的凋亡也稱失巢,通常可被激活的粘合素信號通路所抑制。已有研究證實FAK和TGF-β能夠通過激活粘合素與細胞外基質的相關作用來介導這種細胞外基質依賴的凋亡。此外,Wang et al推測細胞密度對MAPK信號通路的影響可能依賴于FAK信號通路。在本研究中,盡管磷酸化的FAK在EH組細胞中表達下降,通過添加生長因子或細胞外基質等增加FAK的表達未能抑制EH細胞凋亡,也沒有升高EH細胞p-ERK的表達。這些結果提示FAK的表達下降并不是引起EH細胞凋亡的原因,而是伴隨細胞脫壁產生的結果。
PH與EH組細胞中p27的表達也有差異,提示細胞周期調控蛋白可能參與凋亡過程。p27是細胞周期蛋白依賴性激酶抑制劑,調控細胞進入G1期,維持細胞周期正常的運轉。p27缺失見于多種腫瘤包括腦膠質瘤,導致腫瘤細胞不受調控的增殖。在人成纖維細胞中,p27缺失導致細胞發生凋亡,而功能性表達p27可阻止細胞凋亡。因此,在本研究中引起EH細胞凋亡的原因可能與指數生長的U251細胞低表達p27導致細胞周期進程失控有關。在饑餓處理增加p27表達后,細胞凋亡現象消失,進一步說明了功能性表達p27對維持細胞存活的重要性。Masuda et al也發現p27的保護功能,增加p27表達可阻止小細胞肺癌細胞凋亡,并維持細胞在不利的培養環境中存活。在 T98G 腦膠質瘤細胞中,當生長因子缺乏的情況下,S期激酶相關蛋白2的激活受到抑制,而協同下調p27表達可以誘發細胞凋亡。所以功能性表達p27在維持腦膠質瘤細胞的增殖及抗凋亡中有重要影響。
本研究的結果對腦膠質瘤的基礎及臨床研究具有潛在的意義。首先,體外培養過程中如何避免不必要的外界刺激并合理培養細胞是值得關注的問題。其次,腦膠質瘤細胞的生長是在一定的調控下進行,如在U251細胞中,細胞周期蛋白依賴性激酶抑制劑仍具有一定監控功能,從而保證細胞周期進程,并且聯合激活的ERK信號維持腦膠質瘤的增殖及生存。最后,在一定程度上解釋腦膠質瘤治療后早期復發的原因。來自于平臺期的細胞重新種植在高密度或低密度時都呈現快速增長的趨勢,從轉化醫學的角度,腦膠質瘤減瘤后殘留的腫瘤細胞可看作來自于平臺期的細胞解除了接觸抑制,促進MAPK/ERK信號通路的激活,進而引起細胞快速增殖、存活,導致對放化療抵抗及腫瘤復發。然而,本研究結果仍需其他腦膠質瘤細胞株特別是病人來源的原代腦膠質瘤細胞中加以驗證,從而為繼續研究腦膠質瘤的生長調控以及治療抵抗提供一定的理論基礎。

