miR-205促進hASCs細胞系向軟骨細胞方向分化的作用及機制研究
李春亮,秦 鳳,韓雪來,齊普良,孫凱華,趙子春,唐保明,李澤清,李釗偉,王 凱
外傷或疾病引起的關節軟骨缺損或損傷是臨床常見病,關節軟骨損傷后自我修復能力十分有限。人脂肪干細胞(human adipose-derived stem cells,hASCs)具有向脂肪、軟骨等多向分化潛能及分布廣泛、易取材等優勢,已成為軟骨組織工程理想的種子細胞。核心結合因子α-1(core-binding factor α-1,Cbfα-1)是hASCs向軟骨細胞分化、肥大成熟過程中重要的特異性轉錄調控因子,尋找Cbfα-1相對應的基因啟動元件進而調控該基因表達,對hASCs細胞的分化至關重要。研究證實,微小RNA(microRNA,miRNA)可通過靶向調控Cbfα-1介導多能干細胞成骨或軟骨分化,其中miR-205在調節多能干細胞成骨分化過程中起重要作用,且可抑制Cbfα-1蛋白表達。目前,關于miR-205對hASCs軟骨細胞分化的調控作用研究較少。為獲得可穩定向軟骨細胞方向分化的hASCs細胞,該研究采用慢病毒轉染法將miR-205轉染入hASCs細胞,觀察過表達miR-205對hASCs細胞增殖、軟骨細胞方向分化的影響及調控機制。
1 材料與方法
1.1 材料
1.1.1
細胞hASCs購自澳賽爾斯生物技術(上海)有限公司。
1.1.2
主要試劑和儀器 含miR-205序列的重組慢病毒載體(Lenti-miR-205)、陰性對照Lenti-control慢病毒載體(由上海基凱基因化學技術有限公司測序及慢病毒包裝),病毒滴度為1×10CFU/ml;Lenti-miR-205、Lenti-control慢病毒液(深圳市默賽爾生物醫學科技發展有限公司);兔抗人Cbfα-1、轉化生長因子β1(transforming growth factor-β1,TGF-β1)、信號傳導蛋白3(signal transduction protein 3,Smad3)、II型膠原(type Ⅱ collagen,ColⅡ)多抗、辣根過氧化物酶(HRP)標記的山羊抗兔IgG(美國R&D Systems公司);BCA蛋白定量試劑盒(北京普利萊基因技術有限公司);EL×800酶標儀(美國BioTek公司);7900實時熒光定量PCR儀(美國ABI公司);E-Gel Imager凝膠成像儀(美國Invitrogen公司)。1.2 方法
1.2.1
細胞培養及鑒定體外快速復蘇hASCs細胞系,調整細胞密度接種至6孔板內,置于5% CO、飽和濕度、37 ℃條件下培養,匯合至80%左右按照1 ∶3比例傳代,倒置顯微鏡下觀察細胞形態。收集第3代細胞,PBS重懸細胞,加入CD29、Sca-1、CD34、CD45各1 μl,室溫避光孵育30 min,PBS洗滌后重懸,于流式細胞儀上檢測細胞表面標志物表達。
1.2.2
細胞轉染及分組 采用慢病毒轉染法將Lenti-miR-205、Lenti-control慢病毒液分別轉染至hASCs細胞(感染復數MOI為20),分別命名為miR-205過表達組、miR-NC組、對照組(未處理細胞),每組設置5個復孔。miR-205序列5′-CATGACCGTGACGCTGTCGCA-3′,另選miR-205無關通用序列即Lenti-control為對照,倒置熒光顯微鏡下觀察確認轉染效率>70%,進行后續實驗。1.2.3
轉染后各組miR-205基因表達檢測 收集轉染48 h各組細胞,采用SYBR PCR試劑盒擴增,進行RT-qPCR,設置反應條件為:95 ℃預變性2 min;95 ℃、20 s,57 ℃、40 s,72 ℃、60 s,40個循環后再延伸5 min(72 ℃),以U6為內參對照組,計算miR-205相對表達量(2)。引物序列:miR-205:F:5′-GCGTACTAGCGTATGATG-3′,R:5′-ATAGGGATGCTCCGTTGC-3′;U6:F:5′-CTGACTGTTGCAGTGATG-3′,R:5′-TATTGGATGGCGACTGTA-3′。1.2.4
雙熒光素酶實驗驗證miR205與Cbfα-1的靶向關系 由廣州銳博生物公司合成和鑒定包含miRNA可能結合位點的Cbfα-1 mRNA的3′UTR質粒,對數生長期hASCs細胞,培養至80%融合度時,按照Lipofectamine2000說明書,將Cbfα-1 mRNA 3′UTR野生型與突變型熒光素酶報告質粒與內參海腎熒光素酶質粒pRLTK共轉染至hASCs細胞(對照組),并分別轉染至miR-NC組細胞、miR-205過表達組細胞,孵育48 h后采用熒光素酶試劑盒檢測熒光素酶強度,計算相對熒光素酶活性值=螢火蟲熒光素酶活性/海腎熒光素酶活性。1.2.5
轉染后hASCs細胞增殖情況檢測 轉染后,分別取第3代hASCs細胞,以1.5×10/ml接種至96孔板,于培養第1、3、7 天時分別加入新下制備MTT溶液20 μl,37 ℃繼續孵育4 h后,棄去培養基,加入DMSO 150 μl,充分振蕩,于490 nm波長處測定吸光度(A)值。1.2.6
轉染后誘導分化 平面培養法直接將第3代hASCs細胞接種至放有多聚賴氨酸處理的無菌蓋玻片的6孔板,微團培養法將細胞先接種至離心管,離心棄去上清液(2次),將細胞團塊重新接種至放有多聚賴氨酸處理的無菌蓋玻片的6孔板。培養24 h后,更換成軟骨誘導培養基(DMEM高糖培養基、5%胎牛血清、10 μg/L TGFβ1、50 nmol/L抗壞血酸、0.1 μmol/L地塞米松、6.25 mg/L胰島素、6.25 mg/L轉鐵蛋白),繼續培養,誘導分化2周,倒置相差顯微鏡觀察細胞分化情況。1.2.7
分化鑒定 誘導分化2周后,收集平面培養法誘導的細胞爬片,加入4%多聚甲醛固定10 min,蒸餾水洗滌。① 甲苯胺藍染色:加入甲苯胺藍染色15 min,蒸餾水再次洗滌,晾干后中性樹脂封片,顯微鏡下觀察甲苯胺藍染色情況。② Ⅱ型膠原免疫細胞化學染色:加入封閉液室溫封閉10 min,加入兔抗人Ⅱ型膠原多抗,4 ℃孵育過夜,PBS洗滌后加入生物素標記山羊抗兔IgG,顯色后,蘇木精復染,鹽酸酒精分化,流動自來水沖洗10 min后,脫水、封片,于顯微鏡下觀察,棕黃色染色為陽性。③ 收集微團培養法誘導的細胞爬片,固定方法同甲苯胺藍染色,PBS洗滌3次后,用0.5% Triton X-100進行透化處理8 min,PBS再次洗滌后,加入10%山羊血清濕盒孵育30 min,PBS洗滌3次,加入II型膠原一抗(1 ∶100)4 ℃孵育過夜,PBS洗滌3次,二抗(1 ∶500)室溫避光孵育1 h,PBS洗滌3次,加入熒光抗淬滅劑封片,于熒光顯微鏡下觀察。1.2.8
分化后Cbfα-1、Smad3、TGF-β1、ColⅡ mRNA表達檢測 用RT-qPCR法檢測誘導分化2周后細胞中Cbfα-1、Smad3、TGF-β1、ColⅡ mRNA表達情況,檢測方法同1.4描述;以β-actin為內參對照組,計算目的基因表達強度(2)。引物序列:Cbfα-1:F:5′-AGATGTGATTCTACGGCCT-3′,R:5′-CTGCATGTCGAACTACCAC-3′;Smad3:F:5′-GTGATGCCATGATGCTGAT-3′,R:5′-CTGAATGCTGATGCTACTG-3′;TGF-β1:F:5′-TCGAATGCTGCTCTATGA-3′,R:5′-GTGCCTGCTGATTGATGC-3′;ColⅡ:F:5′-ATGCTGATGTCGATGCA-3′,R:5′-CGCATGCTGTGATTGAG-3′;β-actin:F:5′-CTCGTGACTGAAGGATGC-3′,R:5′-TGATGTGAATGCCTGGTG-3′。1.2.9
分化后Cbfα-1、Smad3、TGF-β1、ColⅡ蛋白表達檢測 收集誘導分化2周各組細胞,離心后取沉淀,加入500 μl細胞裂解液,冰上裂解25 min,再次離心取上清液,BCA法進行蛋白定量,取待測樣本進行SDS-聚丙烯酰氨凝膠電泳,經電轉、封閉后,按照比例稀釋一抗(兔抗人Cbfα-1、Smad3、TGF-β1、ColⅡ多抗)、二抗(HRP標記的山羊抗兔IgG),進行孵育,最后曝光、顯影;掃描拍照后灰度值分析,以目的蛋白條帶灰度值與內參對照的比值代表相對表達量。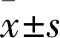
2 結果
2.1 原代hASCs細胞形態觀察及鑒定
原代hASCs細胞培養1 d開始貼壁,細胞呈卵圓形;培養至第3天,細胞開始增殖,逐漸伸展呈梭形或多角形生長,細胞體積增大;培養至第7天,細胞大量增殖,呈長梭形或旋渦狀生長,排列有序,見圖1。流式細胞術鑒定第3代hASCs細胞表面標志物CD29、Sca-1表達陽性,陽性率分別為99.8%、98.4%;CD34、CD45表達陰性,陽性率分別為22.0%、4.96%,符合hASCs細胞表面抗原表達,見圖2。2.2 轉染后hASCs細胞miR-205基因表達量
轉染后miR-205過表達組、miR-NC組、對照組miR-205基因相對表達量分別為(1.76±0.20)、(0.35±0.05)、(0.37±0.05),組間比較差異有統計學意義(F
=217.811,P
<0.001);miR-205過表達組miR-205基因相對表達量高于miR-NC組和對照組(q
=15.294、15.077,均P
<0.001),miR-NC組和對照組比較差異無統計學意義(q
=0.632,P
=0.545)。
圖1 原代hASCs細胞形態 ×100 A:培養1 d;B:培養3 d;C:培養7 d

圖2 第3代hASCs細胞表面標記流式細胞術檢測結果
2.3 雙熒光素酶實驗結果
miR-205過表達組、miR-NC組、對照組野生型熒光素酶報告質粒相對活性值分別為(0.56±0.09)、(1.01±0.15)、(1.03±0.13),組間比較差異有統計學意義(P
<0.05);與對照組和miR-NC組比較,miR-205過表達組Cbfα-1 mRNA 3′UTR野生型熒光素酶報告質粒相對活性值下降,差異有統計學意義(P
<0.001),對照組與miR-NC組比較,差異無統計學意義;miR-205過表達組、miR-NC組、對照組突變型熒光素酶報告質粒相對活性值分別為(1.02±0.10)、(1.02±0.12)、(0.98±0.11),組間比較差異無統計學意義。見圖3。
圖3 Cbfα-1 mRNA 3′UTR與miR-205互補配對的結合位點
2.4 轉染后hASCs細胞增殖
miR-205過表達組培養3、7 d MTT試驗A值高于對照組和miR-NC組(P
<0.05),而對照組與miR-NC組比較,差異無統計學意義;3組MTT試驗A值隨培養時間延長呈升高趨勢(P
<0.05)。見表1。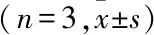
表1 轉染后hASCs細胞不同時刻MTT試驗A值
2.5 轉染后誘導hASCs細胞向軟骨細胞分化
誘導hASCs細胞分化2周后,甲苯胺藍染色顯示miR-205過表達組細胞染色呈深藍色,細胞內呈現藍紫色顆粒,集落生長區域細胞藍紫色染色尤為明顯,呈強陽性(圖4A3),對照組和miR-NC組為微弱淺藍色,呈弱陽性(圖4A1、A2)。免疫細胞化學染色顯示,miR-205過表達組細胞及胞外基質棕黃色,呈強陽性(圖4B3),對照組和miR-NC組為淡黃色,弱陽性,Ⅱ型膠原表達較少(圖4B1、B2)。免疫熒光染色顯示,miR-205過表達組紅色熒光強度較強(圖4C3),對照組和miR-NC組紅色熒光強度較暗淡(圖4C1、C2)。2.6 誘導分化后Cbfα-1、Smad3、TGF-β1、ColⅡ mRNA表達
miR-205過表達組誘導分化后Cbfα-1 mRNA相對表達量低于對照組和miR-NC組,Smad3、TGF-β1、ColⅡ mRNA相對表達量高于對照組和miR-NC組(P
<0.05),而對照組與miR-NC組比較,差異無統計學意義。見表2。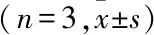
表2 誘導分化后Cbfα-1、Smad3、TGF-β1、 ColⅡ mRNA相對表達量
2.7 誘導分化后Cbfα-1、Smad3、TGF-β1、ColⅡ蛋白表達
miR-205過表達組誘導分化后Cbfα-1蛋白相對表達量低于對照組和miR-NC組,Smad3、TGF-β1、ColⅡ蛋白相對表達量高于對照組和miR-NC組(P
<0.05),而對照組與miR-NC組比較,差異無統計學意義。見表3、圖5。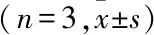
表3 誘導分化后Cbfα-1、Smad3、TGF-β1、 ColⅡ蛋白相對表達量
3 討論
關節軟骨損傷是骨性關節炎、老年性關節炎等關節軟骨退行性疾病的重要病理特征。隨著軟骨組織工程學的不斷發展,為軟骨損傷、缺損的修復帶來新的方向。種子細胞的選擇、刺激種子細胞軟骨細胞分化是軟骨組織工程的關鍵步驟。既往研究顯示,骨髓間充質干細胞受生長分化因子刺激后可向軟骨細胞方向分化,但在分化后期存在軟骨肥大細胞易凋亡的缺陷,尋找合適的種子細胞,同時維持干細胞向軟骨細胞分化的穩定性十分重要。Cbfα-1是干細胞軟骨分化晚期重要的轉錄調控因子,抑制Cbfα-1的表達對維持干細胞軟骨細胞分化的穩定性有重要意義。

圖4 轉染后誘導hASCs細胞向軟骨細胞分化

圖5 Cbfα-1、Smad3、TGF-β1、ColⅡ蛋白Western blot條帶圖 A:對照組;B:miR-NC組;C:miR-205過表達組
本研究中顯微鏡觀察hASCs細胞形態由卵圓形逐漸呈梭形或多角形,后逐漸增殖為排列有序的長梭形或旋渦狀,經歷生長停滯期、對數生長期及平臺期,與既往報道結果相似。miR-205是miRNA家族成員之一,具有miRNA調節細胞增殖、分化、凋亡等多種生理過程的作用。既往多將miR-205作為腫瘤抑制因子廣泛研究,近年來研究顯示,miR-205參與調節間充質干細胞軟骨方向分化,但具體機制不明,過表達miR-205可靶向抑制Cbfα-1基因,從而逆轉miR-205對人胰腺癌細胞的增殖和侵襲能力;Zhang et al在研究骨肉瘤MG63、U2OS細胞抑癌實驗中得出了相似的結論。本研究采用慢病毒轉染法使miR-205基因過表達,結果顯示轉染后miR-205基因相對表達量明顯升高,提示轉染成功;采用雙熒光素酶試驗驗證了miR-205與Cbfα-1間的靶向關系;miR-205過表達組轉染后hASCs細胞培養3、7 d MTT試驗A值高于對照組和miR-NC組,且誘導分化2周后,甲苯胺藍染色、免疫細胞化學染色、免疫熒光染色均顯示miR-205過表達組細胞向軟骨細胞方向分化更為明顯,提示抑制miR-205表達可促進hASCs細胞增殖及軟骨細胞方向分化。
此外,miR-205過表達組誘導分化后Cbfα-1 mRNA和蛋白相對表達量低于對照組和miR-NC組,Smad3、TGF-β1、ColⅡ mRNA和蛋白相對表達量高于對照組和miR-NC組,提示miR-205過表達可能通過抑制Cbfα-1,激活TGF-β1/Smad3信號通路發揮促進hASCs細胞增殖及軟骨細胞方向分化的作用。Cbfα-1是軟骨細胞發育過程的重要轉錄因子,可能通過激活細胞內某靶分子而引起TGF-β1/Smad3信號通路激活,發揮相應調控作用,但具體調控機制仍需要進一步探索。研究顯示,Cbfα-1基因缺失可引起成骨特異性骨鈣素基因表達抑制,從而進而避免多能干細胞分化為肥大軟骨細胞和成骨細胞。因此可推測,抑制Cbfα-1基因表達可為hASCs細胞分化為穩定軟骨細胞提供條件。TGF-β1促進多能干細胞向軟骨細胞分化多肽類生長因子,Smad3是其下游重要信號蛋白分子,直接參與TGF-β1信號轉導過程,參與調控軟骨細胞增殖、分化。Col Ⅱ是軟骨細胞功能基因,是維持軟骨網架系統、調節軟骨細胞生長代謝的重要因子。本研究通過促進miR-205過表達,使Cbfα-1基因和蛋白表達抑制,激活TGF-β1/Smad3軟骨細胞增殖、分化信號通路,從而發揮促進hASCs細胞增殖、軟骨細胞方向分化作用。

