基于TCGA數據庫構建腎透明細胞癌自噬相關基因風險預測模型
陳俊逸,陳 晶,張 蒙,梁朝朝,陳先國
腎透明細胞癌(clear cell renal cell carcinoma,ccRCC)是泌尿系統最常見的惡性腫瘤之一,其發病率占腎細胞癌(renal cell carcinoma,RCC)發病率的70%~80%。手術是局限性RCC的主要治療方式,而晚期和轉移性RCC主要依賴于免疫治療、靶向藥物和化療。該疾病的病死率仍呈逐年上升趨勢。因此,鑒定出新型的生物標志物可用于ccRCC患者的復發或死亡風險預測,對于患者的術后治療意義重大。
自噬是一種重要的生物學現象,在自噬相關基因(autophagy-related genes,ARG)的調控下,細胞可通過分解大分子物質提供氨基酸及合成新蛋白的其他必需因子。已有大量研究支持自噬與ccRCC的發生和進展密切相關。然而,關于ARGs是否可用于ccRCC患者術后預后評估尚未明確。
1 材料與方法
1.1 數據資料
從TCGA中下載ccRCC患者的ARGs表達譜數據及臨床數據,包括537例ccRCC腫瘤和96例非腫瘤組織的RNA測序數據,其中包括489例有配對臨床資料的ccRCC樣本。提取的臨床數據信息包括總生存期(overall survival,OS)、年齡、性別、腫瘤分級、T分期、病理分級。所有數據下載于2020年4月12日。1.2 方法
應用R統計軟件中的“EdgeR”軟件包對下載的數據進行提取分析,篩選出ccRCC和非腫瘤組織間的差異表達自噬相關基因(differentially expressed autophagy-related genes,DEARGs)(篩選條件為log FoldChange≥2或≤-2,FDRP
<0.05)。然后,對DEARGs采用單因素Cox回歸分析,依據P
<0.05篩選出與患者OS相關的DEARGs。接下來,將篩選出的與預后相關的DEARGs納入多因素Cox回歸分析中并建立預后風險評分RS(risk score,RS)模型,計算每位患者的RS,依據評分中位值將患者分為高、低風險組,利用卡普蘭一梅爾估計量(Kaplan-Meier,K-M)法對比組間預后的差異,并計算受試者工作特征(receiver operating characteristic,ROC)曲線評價模型的有效性,并計算曲線下面積(area under curve,AUC)。最后通過多因素Cox回歸分析探討該RS是否獨立于各項臨床病理參數(年齡、性別、腫瘤分級、T分期、病理分級),作為ccRCC患者獨立預后因子。2 結果
2.1 篩選
DEARGs從TCGA數據庫中獲取了537例ccRCC腫瘤和96例非腫瘤組織的RNA測序數據,提取了215個ARGs的表達譜。利用“EdgeR”軟件對比了癌和非癌組織,以logFoldChange≥2或≤-2和FDR
P
<0.05為截斷標準,共篩選出了36個上調和9個下調的ARGs。圖1A散點圖顯示了9個下調基因(FAM215A
、DIRAS3
、PRKCQ
、GABARAPL1
、ERBB2
、BAG1
、HIF1A
、TP63
和MTOR
)和36個上調基因(CX3CL1
、ATG12
、BID
、IL24
、RACK1
、FAS
、BAX
、CASP4
、VMP1
、CCR2
、P4HB
、GAPDH
、ERO1A
、GRID1
、EGFR
、MYC
、BNIP3
、SERPINA1
、SPHK1
、RAB24
、RGS19
、CASP1
、NLRC4
、NRG3
、APOL1
、EIF4EBP1
、HSPB8
、ATG16L2
、BIRC5
、CXCR4
、ATG9B
、TP73
、NKX23
、VEGFA
、IFNG
和CDKN2A
)。圖1B熱圖顯示DEARGs表達水平的層次聚類。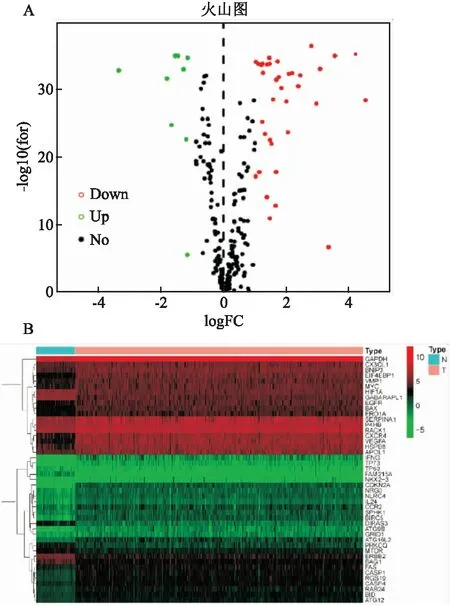
圖1 ccRCC組織與正常組織之間DEARGs
2.2 基于DEARGs的預后模型的建立
將有配對臨床資料的489例ccRCC樣本(表1),通過隨機抽樣的方法按照7 ∶3的拆分為訓練組(n=344)與驗證組(n
=145),訓練組用于建模,驗證組用于外部驗證預后模型的效能。通過對這45個DEARGs的單因素Cox回歸分析后,得到了21個與OS有關的DEARGs(圖2),納入多因素Cox回歸分析,篩選出8個DEARGs用于模型的構建(BID
、EIF4EBP1
、ATG16L2
、CX3CL1
、IFNG
、PRKCQ
、EIF4EBP
、VMP1
)。其中,ATG16L2
,RAB24
,EIF4EBP1
,IFNG
和BID
為高風險基因,而VMP1
,PRKCQ
和CX3CL1
為保護基因。各基因的風險系數(coefficient,COEF)及風險比(hazard ratio,HR)見表2。COEF×風險基因表達值為RS的因變量,得到OS RS=(0.718×BID
表達值)+(0.281×EIF4EBP1
表達值)+(0.326×ATG16L2
的表達值)+(-0.220×CX3CL1
表達值)+(0.280×IFNG
表達值)+(-0.299×PRKCQ
表達值)+(0.281×EIF4EBP1
表達值)+(-0.233×VMP1
表達值)。2.3 預測模型的有效性和穩定性評估
訓練組中位RS為0.95,將評分<0.95的172例患者納入低風險組,評分≥0.95的172例患者納入高風險組。訓練組中ccRCC患者的RS評分、生存分布和ARGs表達見圖3,本研究發現隨著RS值的升高,患者生存時間呈縮短趨勢,且死亡患者人數明顯增加(圖中紅點顯示)。熱圖中高RS患者顯示VMP1
、ATG16L2
、RAB24
、BID
和EIF4EBP1
上調,而IFNG
、CX3CL1
和PRKCQ
降低,低風險患者顯示IFNG
、CX3CL1
和PRKCQ
上調,VMP1
、ATG16L2
、RAB24
、BID
和EIF4EBP1
上調。進一步K-M法結果顯示,高風險組患者的預后比低風險組差(圖4A,P
<0.05),且ROC曲線提示該模型具有較高的預測價值(圖4B,AUC=0.783,95%CI
=0.723~0.897)。為驗證預后預測模型的靈敏度與穩定性,對驗證組進行了分析。依據RS評分,將驗證組145例ccRCC患者分為高風險(n
=72)和低風險(n
=73)組,K-M法揭示低風險組患者與高風險組相比OS延長(P
<0.05)(圖5)。ROC曲線提示該模型在驗證隊列中仍持有較高的預測價值(AUC=0.754,95%CI
=0.706~0.873),特異度為84.1%。綜上所述,這些結果提示DEARGs預測模型能夠有效的預測ccRCC患者的預后。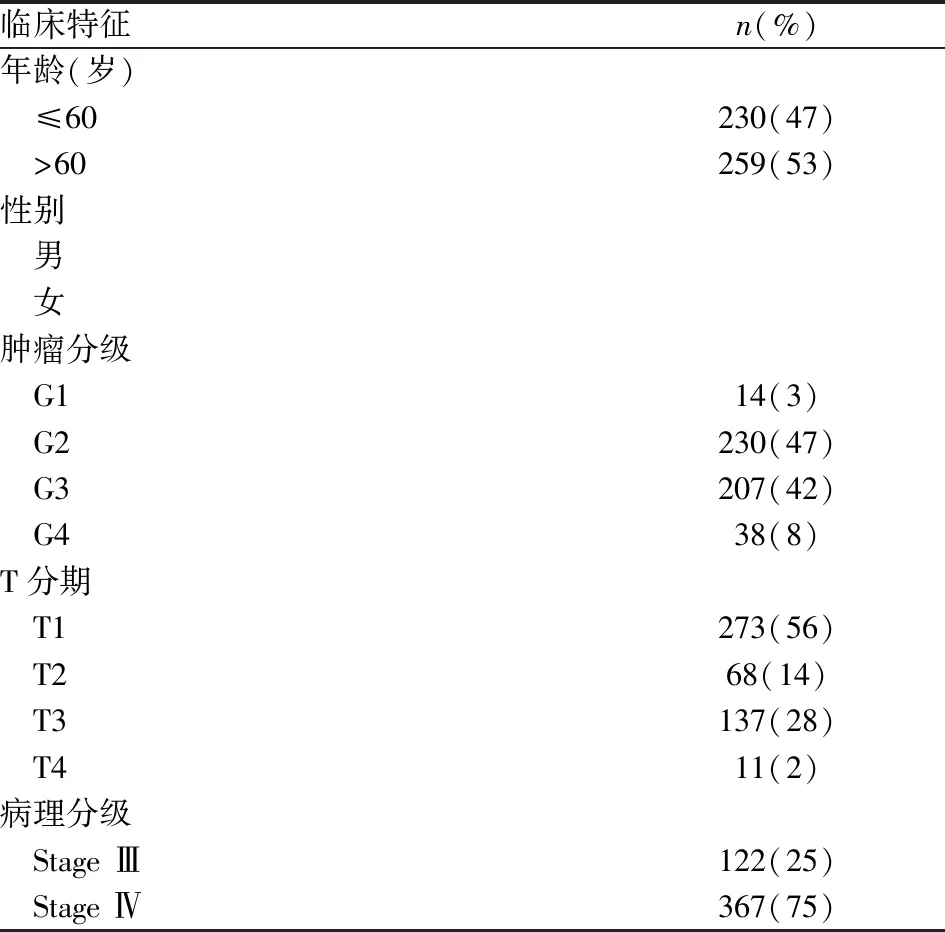
表1 TCGA數據庫中489例ccRCC患者的臨床特征
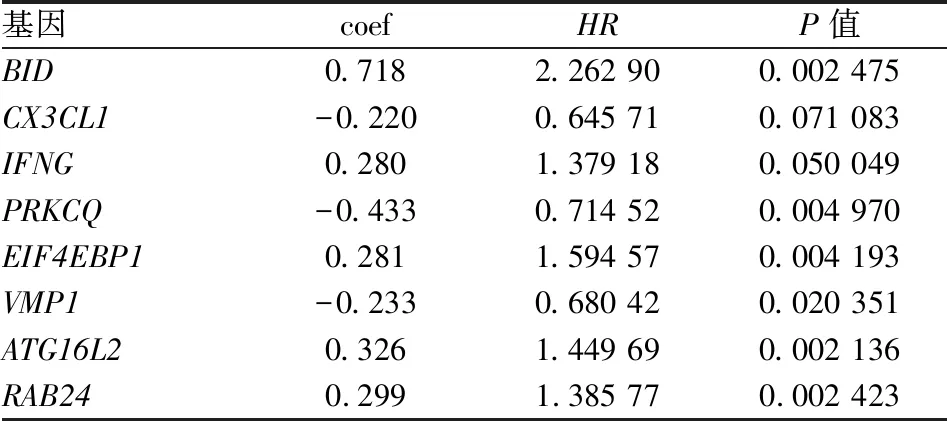
表2 DEARGs多因素Cox回歸分析
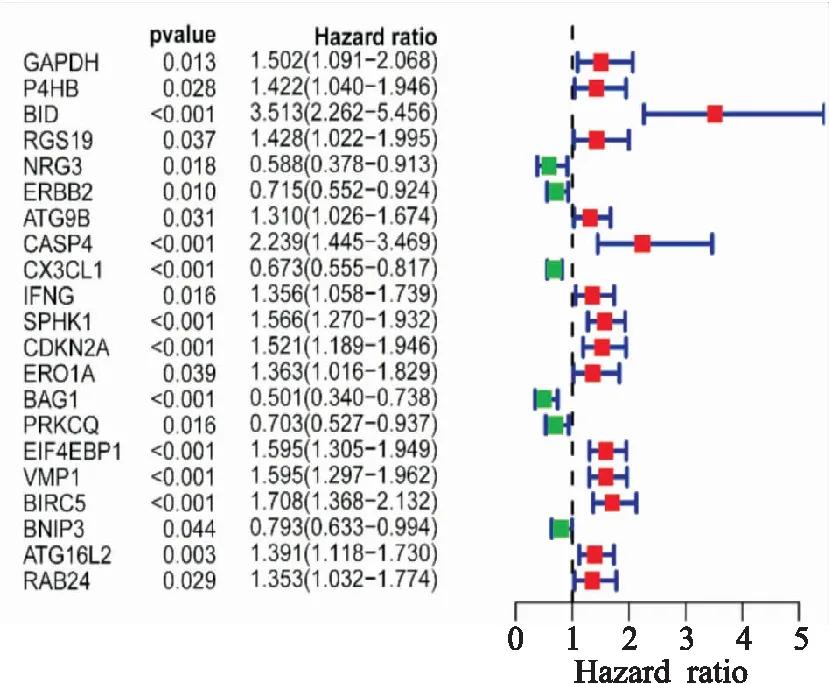
圖2 單因素Cox回歸中21個與總體生存有關的ARGs森林圖
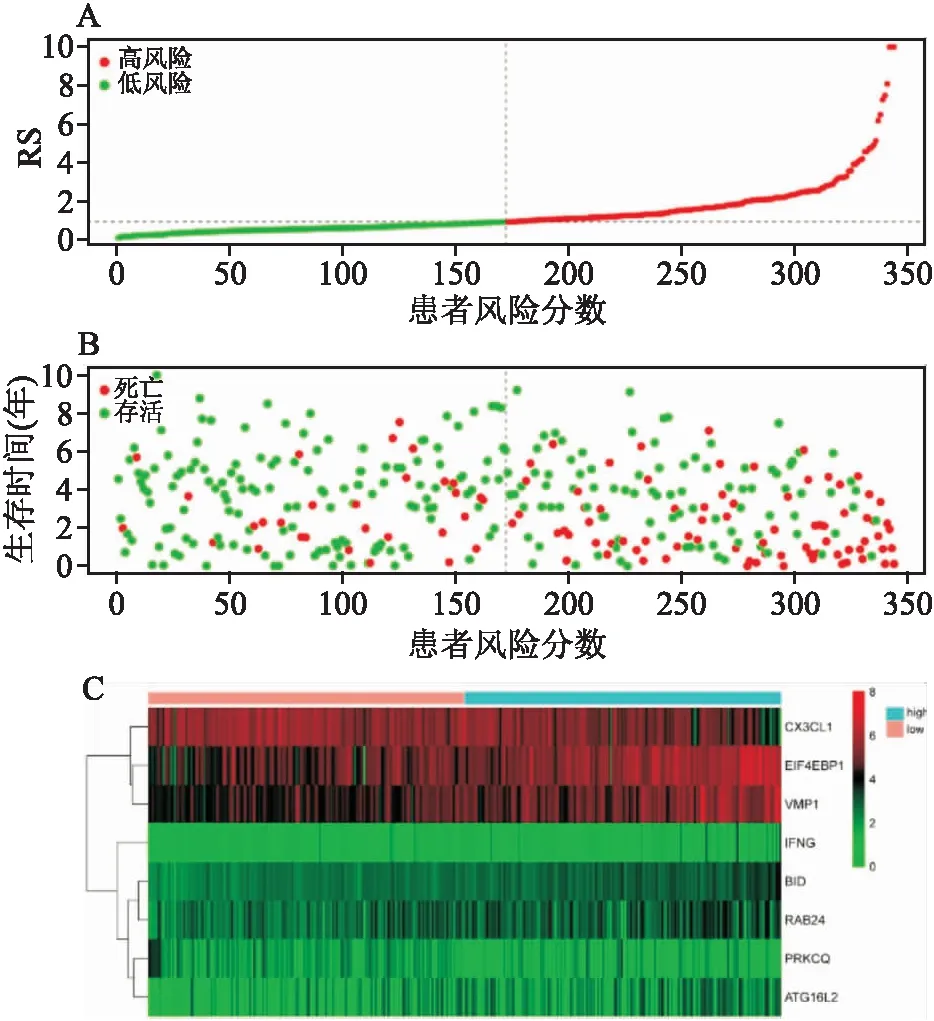
圖3 RS分布圖與DEARGs熱圖及生存時間散點圖
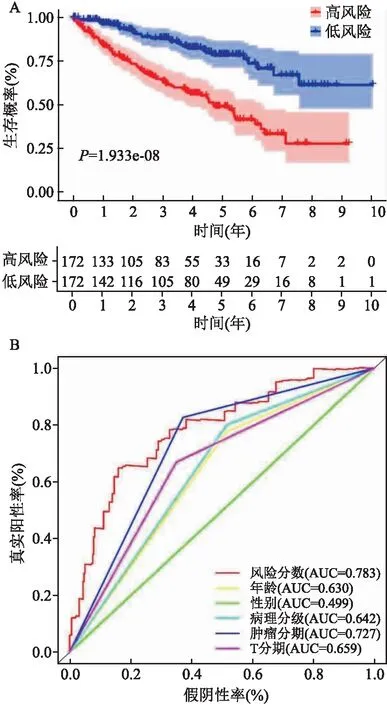
圖4 訓練組DEAGs模型預測效果評估
2.4 自噬相關預后模型與患者生存期獨立相關
研究進一步利用多因素分析評估了訓練組RS與臨床病理參數(年齡、性別、腫瘤分期、T分期、病理分級之間的關系。如表3所示,單因素Cox回歸分析表明ccRCC患者的年齡、性別、腫瘤分期、病理分級、RS與OS相關(P
<0.05)。多因素Cox回歸分析揭示RS與總體生存相關,可作為患者OS評估的獨立預測因子(P
<0.05)。此外,病理分級也與患者OS相關(P
<0.05),可作為預后評估獨立因子。這些結果表明,基于DEARGs的OS預后預測模型可有效區分高危和低危死亡風險的ccRCC患者,且可作為預后評估的獨立預測因子。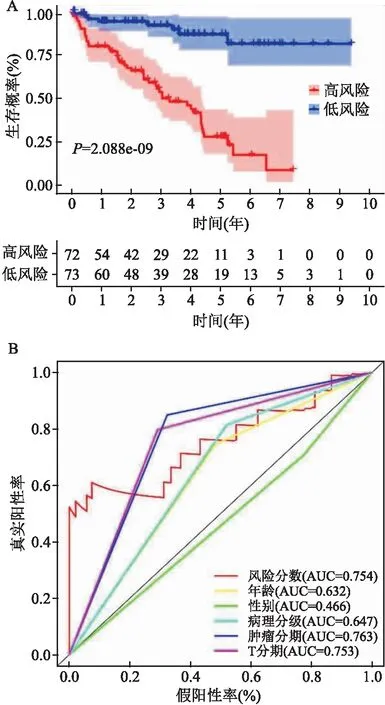
圖5 驗證組DEAGs模型預測效果評估
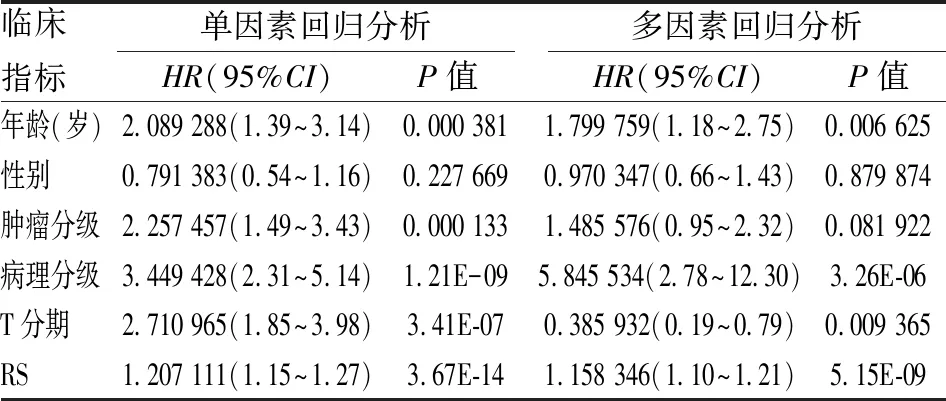
表3 單因素和多因素Cox回歸分析影響患者總體生存期的因素
3 討論
有研究表明了多個ARGs與ccRCC發病或進展之間的關聯,但尚無系統研究評估ARGs是否可以作為ccRCC患者預后評估標志物。本研究從TCGA數據庫中ccRCC和正常組織表達譜與臨床生存資料進行統計分析得到基于8個AGEs的多因素RS模型:RS=(0.718×BID
表達值)+(0.281×EIF
4EBP1
表達值)+(0.326×ATG16L2
的表達值)+(-0.220×CX3CL1
表達值)+(0.280×IFNG
表達值)+(-0.299×PRKCQ
表達值)+(0.281×EIF
4EBP1
表達值)+(-0.233×VMP1
表達值)。K-M法、log-rank法和ROC分析在訓練組和驗證組中揭示了預測模型的特異性和穩定性。同時,多因素分析揭示該模型為ccRCC患者OS的獨立預測因素,進一步佐證了ARGs與ccRCC的關聯。模型共納入8個差異表達的ARGs。BID
位于染色體22q11.21上,編碼與凋亡相關的蛋白,研究顯示其可在甲狀腺癌組織中高表達,并與患者預后緊密相關。ATG16L2
位于11號染色體上,尚無文獻報道該基因在腫瘤發生或進展中的作用。而在當前研究中,顯示ATG16L2
表達上調并與ccRCC患者的OS降低有關。EIF4EBP1
在肝細胞癌和乳腺癌組織中表達水平升高且與患者預后不佳有關。PRKCQ
在腫瘤中的作用機制尚未完全闡明,研究表明,PRKCQ
在包括胃腸道間質瘤在內的實體腫瘤中均表達上調。RAB24目前在功能方面研究較少,Chen et al發現其在肝細胞癌中上調,過表達該基因可促進肝癌細胞進展和上皮-間質轉化過程。CX3CL1
基因位于16號染色體,研究表明CX3CL1
與CCR1
,CCL5
受體協同誘導結直腸癌的肝轉移。VMP1
在肝細胞癌中,抑制增殖和轉移,而在胰腺細胞系中,對VMP1
的抑制會降低細胞凋亡。IFNG
在腫瘤方面研究較少,Garcia-tunon et al發現IFNG在乳腺纖維囊性病變、原位和浸潤性腫瘤中的表達量上調,提出IFNG可作為乳腺癌的一種前瞻性治療方式。綜上所述,本研究通過Cox回歸分析組建了由8個DEARGs構成的ccRCC患者預后預測模型。研究證明了該模型具有較高的特異性與靈敏度,其可補充臨床病理參數用于術后患者的預后評估和治療指導,推進了ccRCC患者的個體化醫療進展。

