Glut 1基因沉默對人結腸癌HT-29細胞株增殖、分化及凋亡的影響及機制研究
郭圣超,武雪亮,薛 軍,韓 磊,孫光源,楊東東,屈 明
葡萄糖轉運蛋白在向代謝活性細胞提供能量的過程中發揮著關鍵作用,葡萄糖轉運蛋白-1(glucose transporter-1,Glut
1)在真核生物和原核生物中均有發現,其表達升高或激活已被證明是諸多惡性腫瘤發生的主要原因。轉化生長因子(transforming growth factor,TGF)-β是與腫瘤發生、進展和轉移調控密切相關的分泌型配體。TGF-β信號通路在控制細胞增殖和結腸直腸癌的分化中具有重要作用。現已證實磷脂酰肌醇3-激酶/蛋白激酶B/哺乳動物雷帕霉素靶標(phosphatidylinositol 3-kinase/protein kinase B/mammalian target of rapamycin,PI3K-AKTmTOR)信號通路與細胞凋亡、增殖、血管生成和轉移密切相關,也是導致結直腸癌變的重要機制。因此,該研究旨在探討Glut
1基因沉默介導的TGF-β/PI3K-AKT-mTOR信號通路對結腸直腸癌細胞的作用,為結直腸癌的靶向診療提供科學參考。1 材料與方法
1.1 材料與主要試劑
人結腸癌細胞株HT-29細胞(上海生物工程研究所);10%胎牛血清RPMI 1640、DMEM(美國Gibco公司);siRNA干擾序列(上海生工生物工程技術服務有限公司),載體pSIREN(北京華奧正生科技有限公司),Lipofectamine 2000(美國Invitrogen公司),DAPI(上海碧云天生物技術有限公司),TRIzol試劑 (美國Invitrogen公司),PrimeScriptTM RT reagent Kit (北京智杰方遠科技有限公司),引物(北京擎科新業生物技術有限公司),BCA檢測試劑盒(上海碧云天生物技術有限公司),酶抑制劑(北京嘉美紐諾生物科技有限公司),MTT溶液(美國Sigma-aldrich公司)、PI染液(上海前塵生物科技有限公司)。1.2 細胞培養
將H-29細胞培養于含有10%胎牛血清的RPMI 1640培養基中,以1×10個/孔的密度將細胞分種于6孔培養板,并置于37 ℃、5% CO及飽和濕度的孵箱中培養。1.3 構建質粒
siRNA序列設計根據Genbank中的Glut 1的mRNA全序列(005983)從Glut 1編碼區中尋找符合設計原則的靶序列,通過BLAST軟件確定與其他非相關基因無同源性,按照Pg-PU 6/Neo載體的要求設計能編碼siRNA的寡核苷酸鏈 (正:5′-CACCGGGAGTGACAAAGACTTTGTTCAAG CA-3′;反:5′-GATCCAAAAAAGGGAGTGACAAAGA CTTCTC-3′),對所有的寡核苷酸片段進行合成。1.4 細胞分組與轉染
選對數生長期細胞,接種于6孔板,每孔5×10個細胞,給予新鮮完全培養基培養至細胞融合度接近50%~80%時進行轉染。依據Lipofectamine 2000轉染,將細胞分為3組:Blank組(人結腸癌HT 29細胞)、NC組(轉染非干擾序列的HT-29細胞)和shGlut 1組(轉染siRNA序列的HT-29細胞)組。lipo溶液:240 μl無血清培養基+10 μl lipo溶液,總體積250 μl,溫育5 min。質粒溶液:20 μl無血清培養基+4 μg質粒總體積24 μl。分別將lipo溶液和質粒溶液混合,室溫下放置20 min,混合液逐滴加入孔中,搖動培養板,輕輕混勻。在37 ℃,5%CO中保溫,5~6 h后,換完全培養基,繼續培養24~48 h,進行后續實驗。1.5 免疫熒光法
將細胞接種于6孔板中,加入2 ml完全培養基,置CO孵箱中37 ℃培養過夜。待細胞長到50%~ 80%時,在滅菌的離心管中配制如下溶液。溶液A:將4 μg待轉染的純DNA稀釋到250 ml無血清培養基中,靜置5 min;溶液B:將2~25 ml LipofectAMINE稀釋到250 ml無血清培養基中,靜置5 min。混合溶液A和B,室溫放置15~45 min。用2 ml無血清培養基洗凈細胞,加入0.8 ml無血清培養基/孔,將脂質體復合物滴加在孔中混勻,置CO孵箱中37 ℃孵育20~24 h。DAPI避光孵育30 min。用完全培養基替換轉染液,繼續培養。24 h后在熒光顯微鏡下觀察蛋白表達情況,取2個表達區域保存,取均值,轉染效率=轉染細胞數目/總細胞數目。1.6 qRT-PCR法
取結直腸癌組織和癌旁正常組織各30 mg,加入1 ml的TRIzol試劑,在冰浴中粉碎,提取組織中總RNA,采用紫外分光光度法檢測RNA的純度及濃度,將純度為A260/280=1.8~2.0的所有樣品濃度調整為0.1 ng/μl,用逆轉錄試劑盒PrimeScriptRT reagent Ki將RNA逆轉錄成cDNA (50 ng/μl),逆轉錄體系10 μl,參照說明書進行,設定反應條件為:37 ℃、15 min × 3次 (逆轉錄反應)、85 ℃、5 s (逆轉錄酶失活反應)、-80 ℃凍存、備用。通過Premier 5.0 軟件自行設計引物,按兩步法在ABI 7900 HT實時定量PCR儀上進行,以GAPDH為內參照。反應條件:95 ℃預變性30 s;95 ℃變性5 s;58 ℃退火30 s;72 ℃延伸15 s;40個循環。采用2法計算mRNA的相對表達水平,每個樣品的每個基因設3個復孔。實驗重復3次。1.7 Western blot法
取組織樣品30 g,檢測總蛋白濃度。取對數生長期細胞,以3 000 r/min、4 ℃離心20 min,棄上清液,估計細胞壓積(packed cell volume,PCV),按每20 μl細胞壓積加入裂解液100 μl和酶抑制劑1 μl的比例冰上裂解30 min,低溫12 000 r/min離心10 min,取上清液蛋白定量檢測。取50 μg蛋白溶于2×SDS上樣緩沖液中,將樣本100 ℃煮沸5 min后,將上述各樣品經質量濃度10% SDS-PAGE凝膠,轉移至PVDF膜,用質量濃度5%脫脂奶粉室溫封閉1 h,孵育兔抗人一抗 (Glut
1:1 ∶1 000、TGF-β 1:1 ∶1 000、PI3K:1 ∶2 000、AKT:1 ∶500、p-PI3K:1 ∶800、p-S 308-AKT:1 ∶1 000、p-S 473-AKT:1 ∶1 000、p-T 389-S6K1:1 ∶500、p-T 70-4 EBP1:1 ∶500、PTEN:1 ∶600、mTOR:1 ∶500、Bax:1 ∶800、Bcl-2:1 ∶1 000、Cleaved Caspase-3:1 ∶1 000、Cleaved-PARP:1 ∶1 000),用TBST洗3遍后將膜與1 ∶5 000稀釋的HRP標記二抗羊抗孵育1 h。TBST漂洗后,ECL顯色,X片曝光、照相。使用凝膠成像分析系統對顯色條帶進行吸光度分析。樣本蛋白的相對含量=樣本的平均吸光度/內參照的平均吸光度,并做統計分析圖。重復3次。1.8 MTT法
轉染24 h后,取對數生長期的細胞,用含10%胎牛血清的RPMI 1640培養基制備成2.5×10個/ml 的細胞懸液,接種到96孔培養板,根據實驗分組,每組各設8孔,每孔100 μl,置于37 ℃、5% CO細胞培養箱中培養,分別于培養24、48、72 h時取出培養板,每孔加入5 mg/ml MTT溶液10 μl繼續培養4 h,終止培養后,棄上清液,每孔加150 μl DMSO,充分溶解,自動酶標讀數儀490 nm處測定各孔吸光度(optical density,OD)值。重復3次。1.9 流式細胞術
細胞轉染48 h后,0.25%胰蛋白酶消化,使細胞數調整為1×10/ml,取1 ml細胞1 500 r/min離心10 min,棄上清液,加2 ml PBS,離心棄上清液,加入預冷的70%乙醇固定細胞,4 ℃過夜。用PBS洗滌細胞2遍,取100 μl細胞懸液,加入50 μg含RNAase的PI染液,避光30 min后用100目的尼龍網過濾,流式細胞儀記錄激發波長在488 nm處紅色熒光檢測細胞周期。Annexin V-FITC/PI雙標染色檢測細胞凋亡,將處理好的細胞置于37 ℃、5% CO培養箱中培養48 h,收集細胞,PBS洗滌2遍后離心將細胞重懸于200 μl結合緩沖液中,加入10 μl Annexin V-FITC和5 μl PI混勻,避光室溫反應15 min,加入300 μl結合緩沖液,用流式細胞儀檢測細胞凋亡情況,重復3次。1.10 平板克隆形成實驗
用胰蛋白酶消化各組細胞,血清終止后重懸并計數,按照每孔1 000個細胞的密度接種于6孔板中,37 ℃、5% CO培養于半固培養基中,2周后用結晶紫染色,觀察細胞集落數量和大小的變化。重復3次。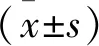
2 結果
2.1 癌組織及癌旁正常組織中TGF-β、PI 3 K-AKT-mTOR信號通路及凋亡蛋白的表達
qRT-PCR和Western blot結果顯示,和癌旁正常組織比較,結直腸癌組織中Glut 1、TGF-β 1、AKT、mTOR、Bcl-2 mRNA和蛋白的表達上調(t
=19.91、42.55、28.96、26.63、17.39,P
均<0.05);PTEN、Bax的mRNA和蛋白的表達明顯下調(t
=54.01、28.21),p-PI3K、p-S 473-AKT、p-S 389-S6K1和p-T 70-4 EBP1蛋白的表達明顯上調(t
=23.17、34.81、31.25、27.84),Cleaved Caspase-3、Cleaved-PARP蛋白的表達明顯下調(t
=27.62、16.61,P
均<0.05),p-T 308-AKT蛋白則差異無顯著意義,見圖1。2.2 轉染效率檢測
細胞轉染72 h后,在熒光顯微鏡下可見明顯熒光。計算視野中NC組的平均轉染效率為 (75.2±3.1) %,shGlut 1組的平均轉染效率為 (92.5±4.2) %,符合實驗要求,見圖2。2.3 各組細胞中中TGF-β、PI3K-AKT-mTOR信號通路及凋亡蛋白的表達
qRT-PCR與Western blot結果顯示,與Control組比較,其余各組細胞Glut
1、TGF-β 1、AKT、mTOR、Bcl-2 mRNA(F
=26.00、26.41、20.57、31.18、27.96)和蛋白(F
=21.29、22.76、23.97、26.15、37.64)的表達明顯上調(P
均<0.05),PTEN、Bax的mRNA(F
=84.94、96.18)和蛋白(F
=26.87、22.01)的表達明顯下調,p-PI3K、p-S 473-AKT、p-S 389-S6K1和p-T 70-4 EBP1蛋白(F
=62.52、87.08、37.73、34.31)的表達明顯上調,Cleaved caspase-3、Cleaved-PARP蛋白(F
=74.98、104.8)的表達明顯下調(P
均<0.05),與Blank組和NC組比較,shGlut1-1組Glut 1、TGF-β 1、AKT、mTOR、Bcl-2 mRNA和蛋白的表達明顯下調(P
均<0.05),PTEN、Bax的mRNA和蛋白的表達明顯上調,p-PI3K、p-S 473-AKT、p-S 389-S6K1和p-T 70-4 EBP1蛋白的表達明顯下調,Cleaved Caspase-3、Cleaved-PARP蛋白的表達明顯上調(P
均<0.05),各組p-T 308 -AKT蛋白則差異無顯著意義,見圖3。
圖1 癌組織和癌旁正常組織相關mRNA和蛋白表達水平比較

圖2 熒光顯微鏡下觀察轉染效率 ×200 A:明場;B:暗場

圖3 轉染后各組細胞中mRNA和蛋白表達水平比較
2.4 各組細胞增殖能力變化
MTT結果表明,與24 h(F
=0.65)比較,各組細胞在48、72 h (F
=24.87、36.66)后細胞OD值升高,差異有統計學意義(P
均<0.05),和Control組比較,其余各組細胞OD值較高(P
均<0.05),與Blank組和NC組比較,shGlut 1組OD值較低(P
均<0.05),見圖4。
圖4 各組細胞增殖能力變化
2.5 各組細胞周期及凋亡情況
PI單染法顯示:和Control組比較,其余各組細胞G/G期較少而S期較多(F
=18.82,P
均<0.05);與Blank組和NC組比較,shGlut1組G/G期較多而S期較少,凋亡率較高(F
=798.8,P
均<0.05);各組細胞G/M期差異無顯著意義,見圖5。和Control組比較,其余各組凋亡率較低 (P
均<0.05),與Blank組和NC組比較,shGlut 1組凋亡率較高(F
=49.39,P
均<0.05),見圖6。
圖5 各組細胞周期檢測
2.6 平板克隆形成實驗結果
和Control組比較其余各組細胞克隆細胞形成數顯著較多(F
=77.91,P
均<0.05),Blank組和NC組克隆細胞形成數差異無顯著意義;與Blank組和NC組比較,shGlut 1組克隆形成數明顯小于Blank組和NC組,腫瘤增長速度最慢,差異有統計學意義(P
均<0.05),見圖7。3 討論
惡性腫瘤的高消耗、高代謝病理特征客觀上要求攝取較普通細胞成倍的能量,但在正常情況下,葡萄糖無法獨立通過細胞膜的雙分子層結構,必須依賴跨膜分布的葡萄糖轉運蛋白作為載體,因而這類載體的活性及表達量對腫瘤細胞的惡性增殖具有非常重要的意義。Glut
1是葡萄糖轉運蛋白最重要的成員,內含492個氨基酸,由12個疏水性的跨膜α螺旋結構域、2個電荷的膜內區及膜外區構成,這即是其轉運的基礎框架。Zhao et al通過臨床薈萃分析證實高表達Glut
1可作為諸多癌癥一個獨立的預后指標,可用于監測癌患者的生存預后情況;Kurahara et al證實在胰腺導管癌組織中Glut
1表達明顯上調,且Glut
1表達水平越高的患者預后越差;Seleit et al報道Glut
1在非黑色素瘤皮膚癌中高表達,考慮為該病變的潛在風險因子。但Glut
1在結直腸癌中的研究較少,其致癌機制尚不明確,基于此,本研究通過TGF-β/PI3K-AKT-mTOR信號通路探究Glut
1基因對結腸癌細胞生物學行徑的影響。
圖6 各組細胞凋亡率檢測

圖7 平板克隆形成實驗
本研究通過qRT-PCR法和Western blot法檢測表明,與Control組比較,結直腸癌組織中Glut1、TGF-β1、PI3K、AKT、mTOR、Bcl- 2 mRNA和蛋白的表達上調,差異顯著,因而證實Glut
1表達升高滿足了結腸癌細胞對能量的大幅度需求,促進癌細胞的生長。Yang et al納入2 077例結直腸癌患者行Meta分析證實Glut
1的表達與結直腸癌的總生存期和無病生存期相關,同時也是結直腸癌的侵襲性臨床特征的指標,本研究結果與之一致。既往研究表明PI3K/AKT信號傳導與結直腸癌的發生、發展相關。由于上游致癌基因(PI3K,AKT)的激活和(或)腫瘤抑制因子(PTEN,LKB1)的失活,諸多惡性腫瘤中均檢測到mTORC 1活性升高,而作為PI3K/AKT信號轉導的下游效應因子,mTOR調節結腸直腸癌的腫瘤發生,因而考慮抑制PI3K-AKT-mTOR信號傳導過程可能拮抗結直腸癌的進一步發展。TGF-β隨著多細胞生物體的進化而出現,在胚胎發生中起關鍵作用,對于組織穩態至關重要。據報道,TGF-β可通過激活PI 3K-Akt-mTOR信號通路介導對葡萄糖的反應。本實驗研究結果顯示shGlut 1組較NC組和Blank組Glut 1-AKT-mTOR和TGF-β 1的mRNA和蛋白表達均明顯下降;且shGlut 1組結腸直腸癌細胞增殖能力顯著下降,而細胞凋亡增加,從而證實Glut 1表達降低/沉默通過抑制TGF-β-PI3K-AKT-mTOR信號通路來抑制細胞生長,促進細胞凋亡。

