形變配準算法在宮頸癌后裝治療分次間總劑量評估中的應用
李紀璇,單國平,王彬冰,周劍良
1.南華大學核科學技術學院,湖南衡陽421001;2.中國科學院大學附屬腫瘤醫院放射物理室,浙江杭州310022
前言
形變配準算法通過數學方法,建立兩組CT影像之間的映射關系[1-3]。它能處理不同CT影像間感興趣區域(Region of Interest,ROI)的運動位移,并受到廣泛的關注[4-6]。形變算法通常是一個優化過程,首先確定一個目標函數,通過尋找給定的目標函數的最小值完成優化得到最優解。目前使用較多的形變配準算法主要有有限差分(Finite Difference)的形變配準方法[7-8]、Demons形變配準算法[9-11]、基于B樣條的配準算法等[12-13]。根據相似性測度函數的不同,以上配準算法主要分為兩大類:基于圖像灰度的配準算法與基于輪廓的配準算法。
后裝治療中,正常組織受照劑量和放射毒副反應有明顯的相關性。目前主要還是使用GECESTRO推薦的分次間劑量累加方法,即把分次間最大劑量數值相加作為多個分次的正常組織最大劑量。盡管GEC-ESTRO方法被認為是一種可靠的經驗方法,但它是建立在每次治療計劃的高劑量區位置沒有變化的假設基礎上,并且忽略了膀胱直腸的充盈程度、形狀以及位置變化情況等因素對累積劑量計算帶來的影響。劑量形變算法是非剛性圖像形變在醫學物理中的一種擴展應用。劑量形變以非剛性圖像形變產生的形變圖像位移矢量場(Displayment Vector Field,DVF)為依據,把屬于移動圖像的三維劑量分布逐體素的映射到固定圖像上。因此,劑量形變可以評價多次治療計劃的疊加劑量,而不會受到膀胱和直腸位置的移動、形狀體積變化的影響,對于多次計劃累積劑量安全性的評估具有重要意義[14]。有文獻報道在使用不同形變方法計算累積劑量時,可能會對最終結果產生影響[15]。因此正確理解圖像形變配準(Deformable Image Registration)的局限性和適用性有助于在評估累積劑量時得到更準確的劑量分布。
本研究首先對基于圖像灰度的混合形變配準算法(Hybrid Intensity Deformation)準確性進行了評估,使用相似度系數(Dice Similarity Coefficient,DSC)評價形變結果,比較了基于圖像灰度的混合形變算法在處理不同體積膀胱直腸形變時DSC的結果。然后在圖像形變基礎上,對形變劑量D0.1cc、D1cc、D2cc(0.1 cc,1 cc,2 cc的最大體積劑量)進行疊加計算,最后對比了GEC-ESTRO推薦的估算方法和劑量形變累加的差異。對劑量形變累加的臨床正確應用提出了建議。
1 材料與方法
1.1 數據準備
隨機選取了2015年2月~2018年10月在浙江省腫瘤醫院接受后裝治療的32例宮頸癌患者。患者每次后裝治療前均在Philips CT模擬機(Philips Medical System,Eindhoven,Netherlands)定位,掃描層厚2.5 mm。每個病人在后裝治療之前,已經完成了1.8 Gy(25~27 F)的外照射計劃。每個病人的后裝計劃包括3~5個分次的治療計劃,32例宮頸癌患者共130組輪廓,108次形變。其中18例膀胱、直腸體積控制組病人在治療前遵從了醫囑,進行直腸控制,并且在治療過程中,控制每次CT掃描的膀胱體積,在掃描前排空膀胱注入一定量的生理鹽水,治療前重復操作。另外14例膀胱、直腸體積未控制組病人沒有執行相關醫囑,在治療期間,也未做膀胱體積控制處理。輪廓勾畫根據GEC-ESTRO工作組的推薦對靶區及正常組織進行勾畫[16]。后裝治療總劑量40 Gy EQD2(2 Gy分次放射等效劑量),使得高危靶體積(High Risk-Clinical Target Volume,HR-CTV)總處方劑量達到85 Gy EQD2,中危靶體積(Intermediate Risk-Clinical Target Volume,IR-CTV)總處方劑量70 Gy EQD2。同時膀胱D2cc劑量不超過85 Gy EQD2,直腸、乙狀結腸D2cc劑量不超過75 Gy EQD2。每個分次的勾畫和治療計劃都在Oncentra(Elekta Brachytherapy,Veenendaal,the Netherlands)上完成,隨后圖像輪廓勾畫和劑量文件被傳輸到Raystation(RaySearch Laboratories AB Stockholm Sweden)計劃系統進行形變劑量疊加。
形變配準:形變流程如圖1所示。形變之前先以固定圖像(Fixed Image)為參考,在Raystation治療計劃系統上,對移動圖像(Moving Image)進行平移和旋轉,通過目測檢查,確保圖像在橫截面、冠狀面、矢狀面基本重合。然后使用Raystation治療計劃系統中的剛性配準工具,以圖像灰度互信息為測度,以骨性標記和外輪廓為參考做剛性配準。選取膀胱、直腸作為形變ROI,采用混合形變配準算法進行形變。因為本研究主要關注膀胱和直腸的形變劑量,ROI以外區域的形變結果不在本文討論范圍之內。
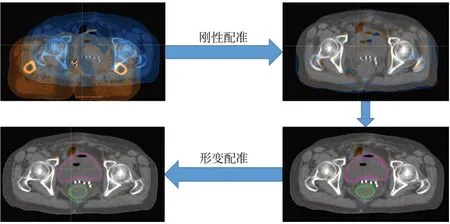
圖1 剛性配準和形變配準的前后對比Fig.1 Before and after rigid registration and deformation registration
形變劑量計算在獲取圖像位移矢量場(Displayment Vector Field,DVF)的基礎上進行。DVF是一個包含了移動圖像上每個體素映射到固定圖像的矢量場。因此根據DVF結果,可以將和移動圖像網格匹配的劑量體元,遷移到固定圖像上,得到形變后劑量。不同分次的形變劑量依次被疊加到固定圖像上形成累積劑量并用于評估,過程如圖2所示。本研究分別選取每次治療前對膀胱、直腸作體積控制和未作體積控制的形變結果。比較形變膀胱、直腸體積差異對形變相似度,膀胱直腸D0.1cc、D1cc、D2cc累積劑量的影響。定義分別表示第n次治療時的膀胱、直腸劑量。分別表示第i次治療時的劑量分布映射到參考圖像后的形變劑量。累積總劑量計算方法描述為:
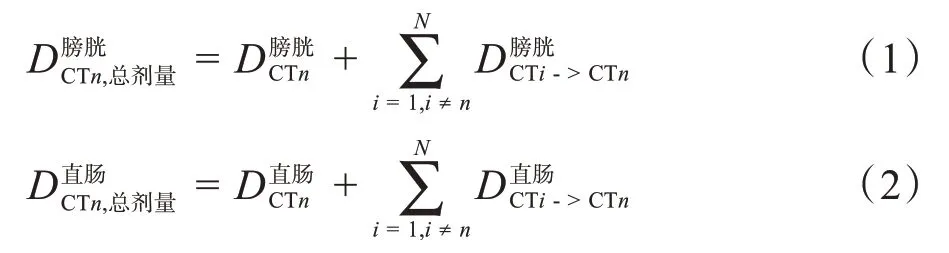
本文使用DSC作為形變結果的評價指標,對于某一形變器官的DSC,定義為形變后的目標圖像輪廓與參考圖像輪廓的重合度,公式如下:
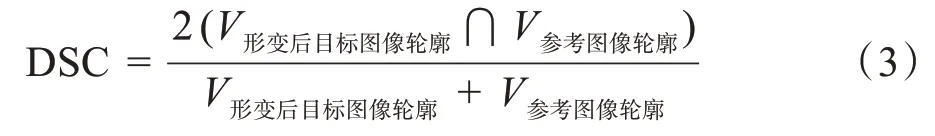
DSC值越接近于,表示兩輪廓體積在空間上重合越好。
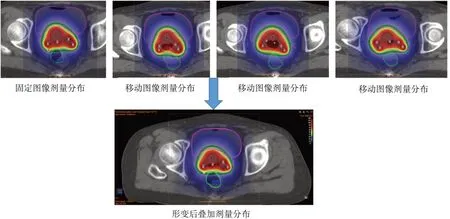
圖2 形變前的劑量分布和形變后的疊加劑量分布Fig.2 Dose distribution before deformation and superimposed dose distribution after deformation
1.2 形變累積劑量結果評估
在后裝治療中,對膀胱、直腸多個治療分次所受總劑量的評估,GEC-ESTRO推薦的方法是通過對各分次間的D0.1cc、D1cc、D2cc相加獲得的。由于每次治療的最大體積劑量熱點不可能完全重合,因此該方法也被稱為“最壞估計”法(worst assumption)。本文比較了形變累積劑量計算得到的D0.1cc、D1cc、D2cc和GEC-ESTRO推薦方法結果的比值,記為DDIR/DGEC。該比值小于1,則表示GEC-ESTRO推薦方法高估了累積最大點劑量;反之,如果比值大于1,則表示使用形變累積劑量的結果比GEC-ESTRO推薦方法的結果更高。形變累積劑量和GEC-ESTRO推薦的劑量評估方法的比值DDIR/DGEC,反映了經驗估算方法和形變方法的差異。
2 結果
32例患者中,體積控制組中膀胱各分次間體積變化最大患者的波動范圍是189.84~336.29 cc,體積變化最小患者的波動范圍是183.38~197.03 cc,直腸各分次間體積變化最大患者的波動范圍是11.51~31.38 cc,體積變化最小患者的波動范圍是15.67~20.70 cc。體積未控制組中膀胱分次間體積變化最大患者的波動范圍是53.75~263.38 cc,體積變化最小患者的波動范圍是121.78~167.62 cc,直腸各分次間體積變化最大患者的波動范圍是13.82~24.88 cc,體積變化最小患者的波動范圍是11.67~18.6 cc。由此看出,膀胱和直腸分次間體積相比,膀胱有更大的分次間體積差,體積控制對膀胱分次間體積變化效果更顯著。
以膀胱、直腸作為形變ROI,108次形變結果的DSC與形變ROI的體積比變化關系如圖3所示,體積比定義為參與形變的兩組CT影像中的ROI體積之比即V移動/V固定(移動圖像和固定圖像體積比),DSC隨相對體積增大呈下降趨勢。對于膀胱而言,當V移動/V固定小于1.5時,輪廓重合度較好,DSC為0.95~1。當相對體積大于1.5時,DSC開始明顯下降;而對于直腸來說,輪廓重合度劣于膀胱,不存在明顯的閾值,下降趨勢也不明顯。
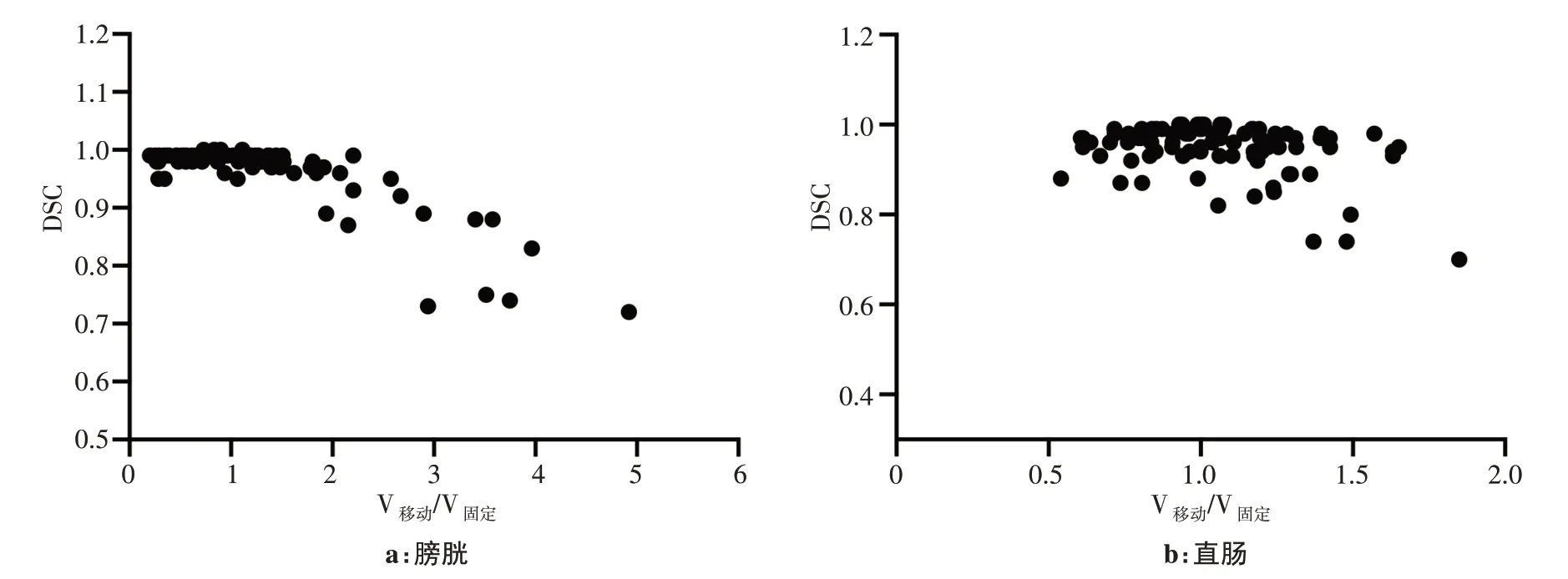
圖3 膀胱和直腸的相似度系數隨形變體積比的變化Fig.3 Change of Dice similarity coefficient of bladder and rectum with deformation volume ratio
體積控制組中,由于患者遵從了醫囑,膀胱和直腸分次間體積差異較小。反之,體積未控制組分次間體積差異較大,如圖4和圖5所示。圖中橫坐標為患者的分次間體積比平均值,縱坐標為形變累積劑量計算得到的D0.1cc、D1cc、D2cc和GEC-ESTRO推薦方法結果的差異比值(DDIR/DGEC)。體積未控制組膀胱D0.1cc、D1cc、D2cc對應的最大DDIR/DGEC值分別為1.09、1.06和1.07,最小DDIR/DGEC值分別為0.79、0.78和0.80;體積控制組膀胱最大DDIR/DGEC值小于體積未控制組,分別為1.03、1.05和1.05,最小DDIR/DGEC值分別為0.85、0.87和0.91。由于控制了膀胱體積,DDIR/DGEC數值變化范圍變小,說明按每個分次劑量相加的GEC-ESTRO推薦方法和形變累積劑量接近。如果沒有對膀胱體積進行控制,GEC-ESTRO推薦方法不能很好地評估真實的累積劑量。對于直腸的分析結果和膀胱接近,體積控制組直腸D0.1cc、D1cc、D2cc最大DDIR/DGEC值分別為1.03、0.99和0.99,最小DDIR/DGEC值分別為0.81、0.80和0.80,比體積未控制組變化波動小。未控制組DDIR/DGEC值最大值和最小值分別為1.02、1.05、1.06和0.77、0.85、0.85。
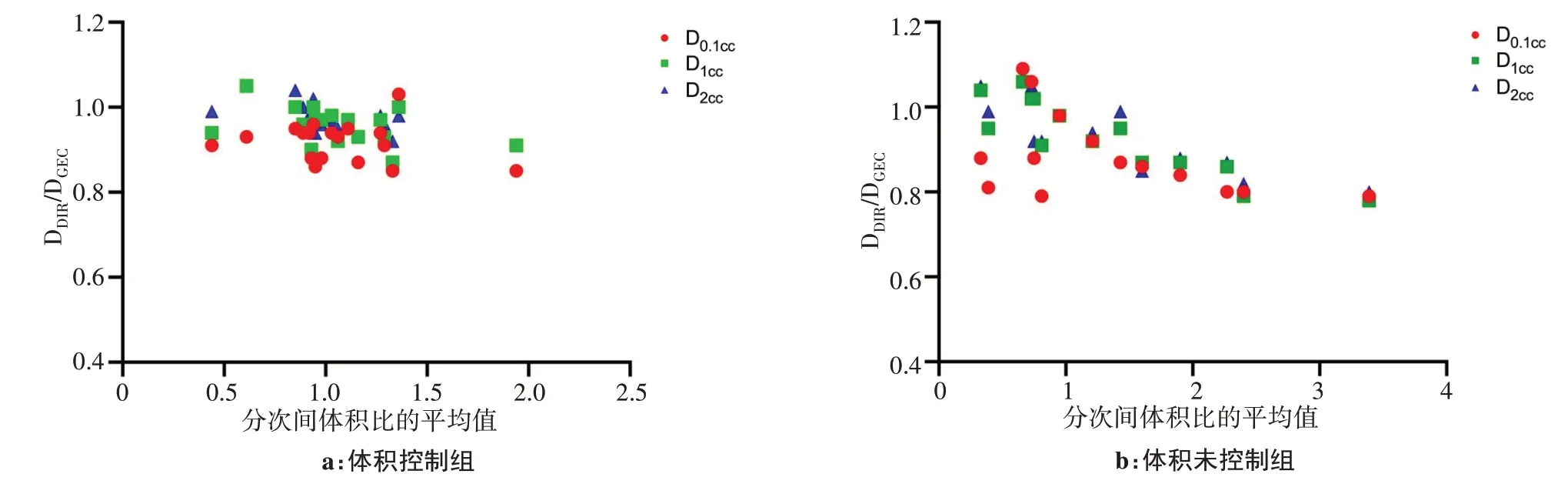
圖4 體積控制組和未控制組的膀胱形變累積劑量比隨形變體積比的變化Fig.4 Deformation cumulative dose ratio of the bladder in volume control group and volume uncontrolled group changing with deformation volume ratio
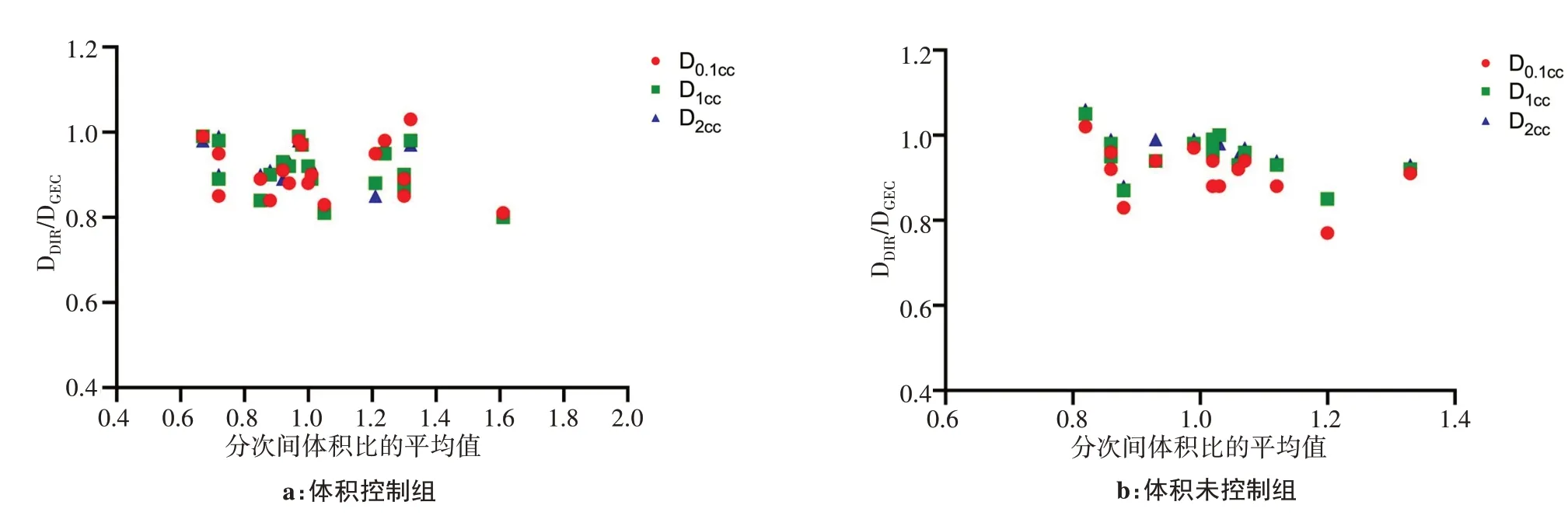
圖5 體積控制組和未控制組的直腸形變累積劑量比隨形變體積比的變化Fig.5 Deformation cumulative dose ratio of the rectal in volume control group and volume uncontrolled group changing with deformation volume ratio
3 討論
本研究首先對混合形變算法準確性進行了評估,使用DSC作為相似度評價形變結果,比較了混合形變算法在處理不同體積膀胱直腸形變時DSC的結果。然后在此DVF基礎上,對形變累積劑量D0.1cc、D1cc、D2cc進行計算,對比GEC-ESTRO推薦的估算方法和形變劑量疊加劑量的差異。本研究第一次嘗試比較了后裝治療中形變算法對體積控制和未作體積控制的計劃累積劑量的結果。對圖像引導后裝放射治療累積劑量計算的臨床應用具有一定意義。
對膀胱形變相對體積與D0.1cc、D1cc、D2cc等劑量學參數的研究發現,形變劑量受到固定圖像和移動圖像ROI體積縮放的影響。本研究發現,當相對體積<1時,即參考體積大于目標體積,目標體積被放大,相應的劑量網格也被放大,受到某劑量照射的體積也放大。相反,當相對體積>1時,照射某劑量的體積將被縮小。即當劑量分布隨著DVF,從一個小體積映射到大體積時,在評價劑量分布時,相應劑量的體積變大。和圖3中相對體積與劑量學結果呈負相關的觀察結果一致。但是,使用同樣研究方法,在直腸的形變上未發現明顯的相關性。筆者認為原因可能是形變模型不能處理不同性質器官的形變。這個結果提示我們,需要在今后的工作中,使用其他模型來研究比較形變算法對不同性質器官的影響。另一個可能的原因是本研究中,直腸的相對體積變化小于膀胱,相對體積在0.5~1.8內波動,小于膀胱0.2~4.9的波動范圍,因此劑量體積的放大縮小效果不明顯。此外,從圖3中可以發現,控制膀胱體積能得到分布區間更窄的DDIR/DGEC值。即形變結果的不確定性較小。但對于直腸,是否進行體積控制對DDIR/DGEC值分布區間影響不大。
研究發現參與形變輪廓的相對體積對DSC結果會產生影響。形變算法無法處理固定圖像和移動圖像相對體積差別較大,特別是固定圖像輪廓體積遠小于移動圖像輪廓體積的情況。當相對體積小于1.5時,形變DSC值高,形變結果較理想。但是當兩者體積比大于1.5時,DSC結果明顯變差。換言之,當選擇的參考圖像輪廓體積較小時,形變結果往往不佳。例如,本研究所選取的病例中,有一例移動圖像輪廓體積為固定圖像輪廓體積的3.5倍,其形變輪廓重合度只有80%。但是如果選取輪廓體積較大的圖像作為固定圖像,則形變輪廓的重合度能提高到98%。對于體積未控制組,如果選取最小體積者作為固定圖像,DSC不準確。本研究中,第22個病例,先選取膀胱最小體積者作為固定圖像,其移動圖像與固定圖像體積比分別為2.10、2.90、3.52,此時V移動/V固定要大于1.5,形變結果不理想,DSC值較差,分別為0.91、0.89、0.75,累積劑量由于體積縮放而變小,D0.1cc、D1cc、D2cc的DDIR/DGEC分別為0.80、0.86、0.87,而對于同一病例,如選取膀胱最大體積者作為固定圖像,DSC值明顯高于這個結果,其V移動/V固定分別為0.28、0.60、0.82,形變相似度較選取最小體積作為固定圖像高,DSC分別為0.98、0.99、0.98。但由于高劑量體積被放大而導致劑量疊加變大,其D0.1cc、D1cc、D2cc的DDIR/DGEC分別為0.90、1.35、1.18。而選擇中位體積者作為固定圖像時,V移動/V固定分別為0.48、1.38、1.68,形變結果較理想,DSC值比其他兩種情況高一些,分別為0.99、1、1,累積劑量準確度也有所提高,其D0.1cc、D1cc、D2cc的DDIR/DGEC分別為0.98、1.01、1.03。因此,選擇中位體積者作為固定圖像是減少兩種誤差的折中方法。對于直腸的研究也觀察到了類似結論。而體積控制組同時避免了兩種誤差的發生,既提高了DSC,也不會引入體積縮放,累積劑量結果具有較大參考價值。
綜上所述,后裝治療中,形變累積劑量計算存在不確定性,這些不確定性來自形變算法、形變體積等因素。合理控制這些因素有助于提高形變準確性。本研究比較發現,那些控制了膀胱體積的組,劑量學參數比未控制膀胱體積的組有更好的一致性,說明對體積的控制有助于減小形變體積帶來的不確定性。提示在使用形變算法計算累積劑量時,必須注意形變輪廓的體積,并在多個分次圖像中,盡量使用具有中位體積值的圖像作固定圖像。但是對于直腸,這個結論未必有意義,需要擴大統計樣本量。

