物理改性對小米水溶性膳食纖維的結構表征及硒化能力的影響
王 娟 魏春紅 王維浩,2 趙姝婷 劉德志王一飛 武云嬌 蘇有韜 曹龍奎,2
(黑龍江八一農墾大學食品學院1,大慶 163319)(黑龍江八一農墾大學國家雜糧工程技術研究中心2,大慶 163319)
小米是糖尿病患者的理想食物,其碳水化合物含量低于大米、小麥和玉米,多酚含量、VB1、VB2含量高于小麥和大米[1],且其膳食纖維(DF)含量是大米的2.5倍[2]。DF包括水溶性膳食纖維(SDF)和不溶性膳食纖維(IDF)[3],SDF在防治心血管疾病[4]、糖尿病[5]、動脈硬化等方面具有良好的作用且優于IDF[6],但是天然DF中的SDF含量較低,口感粗糙,阻礙了其在食品工業中的應用。因此,對DF進行改性提高SDF的含量成為很多學者研究的重點[7]。目前對DF的改性方法有物理方法、生物方法、化學方法或聯合幾種方法進行改性[8],但考慮到生物方法成本高、反應條件苛刻,化學方法安全性低、污染高,綜合考慮對小米進行物理改性。現階段,對于小米SDF的研究還停留在提取工藝、理化性質研究及加工方式對結構的影響[9,10],而在小米SDF改性方面的研究涉及較少。
目前對于DF功能性質的研究主要集中在吸水性、吸油性、膽固醇吸附能力等方面[11],而其對微量元素的影響鮮有報道。硒是人體的必需微量元素,可以抗氧化、促進免疫、參與基因表達[12]。自然界中的硒大多以無機硒存在,其吸收率較低,且對人體有一定的毒副作用,有機硒毒性小、安全指數高、體內轉化率高,但有機硒含量相對較少[13],所以有機硒的開發利用至關重要。研究表明,將無機硒與多糖結合不僅可以降低無機硒毒性,還可以增加多糖的生物活性[14],而SDF與多糖具有相似的結構,如C—H、C—O等基團[15],這些基團在多糖與硒的結合中起著重要作用。因此,本實驗研究改性前后的SDF的結構并研究其硒化修飾能力,以篩選出一種可使SDF硒化能力增強的改性方法,為進一步開發有機硒新產品、拓寬小米及小米SDF的應用提供借鑒。
1 材料與方法
1.1 實驗材料
小米品種為東方亮谷,顆粒飽滿均勻,色金黃,無霉爛碎米;蛋白酶(水解酶類,60 000 U/mL),耐高溫α-淀粉酶(水解酶類,40 000 U/mL),淀粉葡糖苷酶(水解酶類,100 000 U/mL);溴化鉀,光譜級;95%乙醇等試劑均為分析純。
1.2 儀器與設備
GDE-CSF6膳食纖維測定儀,LHL型流化床式氣流粉碎機,Nicolet 6700傅里葉變換紅外光譜儀,LC20+RID20A凝膠滲透色譜儀,D8 ADVANCEX射線粉末衍射儀,SU8020場發射掃描電子顯微鏡,CW-2000A超聲-微波協同萃取反應儀。
1.3 方法
1.3.1 小米前處理
小米粉的制備:取適量小米,經粉碎過60(D50=250.00 μm)目篩,進行脫脂處理,備用。
超微粉碎小米粉的制備:取適量小米,進行超微粉碎(D50=13.29 μm)后脫脂,備用。
流化床氣流粉碎系統設有3個噴嘴,噴嘴間平面角度為120°,以潔凈壓縮空氣為粉碎工質,空氣溫度不高于45 ℃。粉碎操作參數:持料量1.0 kg;進料頻率3 Hz;粉碎工質壓力0.8 MPa,分級機轉速3 600 r/min;引風機流速15 m3/min;粉碎時間30 min。
脫脂:利用索氏提取法對小米粉進行脫脂處理[16]。
1.3.2 小米SDF的制備
1.3.2.1 超聲-微波(U-M)萃取改性小米SDF的制備
稱取5.00 g經普通粉碎的脫脂小米粉,在U-M萃取儀中按照微波功率550 W,料液比1∶25 (V∶V),微波溫度55 ℃,微波時間20 min進行處理,將溶液轉至500.00 mL燒杯中,加入250.00 mL磷酸鹽緩沖溶液(0.08 mol/L,pH=6),分別加入耐高溫α-淀粉酶、中性蛋白酶、淀粉葡萄糖苷酶進行酶解,期間用碘液檢測淀粉含量,硫酸銨使蛋白質充分沉淀,之后滅酶,濾液經濃縮后,4倍體積的95% (體積分數)乙醇溶液醇沉、離心、干燥得U-M萃取改性小米SDF (SDF1)。同時去除空白、未消化蛋白質、灰分的影響。
1.3.2.2 小米SDF的制備
稱取5.00 g經普通粉碎脫脂小米粉,加入125.00 mL蒸餾水,加入250.00 mL磷酸鹽緩沖溶液(0.08 mol/L,pH=6),分別經耐高溫α-淀粉酶、中性蛋白酶、淀粉葡萄糖苷酶進行酶解,期間用碘液檢測淀粉含量,硫酸銨使蛋白質充分沉淀,滅酶,濾液濃縮后,用4倍體積的95% (體積分數)乙醇溶液醇沉、離心、干燥得小米SDF (SDF2)。同時去除空白、未消化蛋白質、灰分的影響。
1.3.2.3 超微粉碎協同U-M萃取改性小米SDF的制備
稱取5.00 g經超微粉碎的脫脂小米粉,在U-M萃取儀中按照微波功率550 W,料液比1∶25 (V∶V),微波溫度55 ℃,微波時間20 min進行處理,后續過程同(1),得超微粉碎協同U-M萃取改性小米SDF (SDF3)。
1.3.2.4 超微粉碎改性小米SDF的制備
稱取5.00 g經超微粉碎的脫脂小米粉,后續過程同1.3.1,得超微粉碎改性小米SDF (SDF4)。
1.3.3 小米SDF的傅里葉變換紅外光譜測定
參照張艷榮等[17]方法,稱取干燥樣品2.00 mg與溴化鉀粉末200.00 mg于研缽中,充分混勻,研磨,制片。在4 000~400 cm-1進行紅外光譜掃描。
1.3.4 小米SDF超微結構的觀察
參照Park等[18]方法,將樣品干燥至恒質量,取適量進行黏臺、鍍金,對樣品進行5 000、10 000、20 000、50 000倍微觀結構觀察拍照。
1.3.5 小米SDF分子質量分布的測定
稱取適量樣品于容量瓶中,用流動相溶解,定容。色譜條件:色譜柱:TSKgel GMPWXL,流動相:水相,少量硝酸鈉、疊氮化鈉,流速:0.5 mL/min,柱溫:30 ℃,進樣量:20 μL。
1.3.6 小米SDF的X射線衍射測試
取適量干燥后的SDF于樣品槽中用玻璃板壓平,將其置于自動X射線衍射儀中[19]。參數設置:λ=0.156,管壓36 kV,管流20 mA,Cu靶,掃描速率2 (°)/min,衍射角度2θ,掃描范圍2°~40°,掃描頻率0.02 (°)/步。
1.3.7 陽離子交換能力的測定
參照Chau等[20]的方法測定4種SDF的陽離子交換能力,稱取小米SDF 1.00 g于250.00 mL三角燒瓶中,加入1 mol/L HCl溶液50.00 mL,攪拌均勻后密封,靜置24 h,加入5 g/100 mL的NaCl溶液50.00 mL,攪拌均勻,加入2滴酚酞指示劑,用1 mol/L NaOH溶液滴定至終點,記錄滴定體積。同時做空白實驗,陽離子交換能力按式(1)計算。
(1)
式中:V1為滴定樣品消耗氫氧化鈉溶液體積/mL;V0為滴定空白樣消耗氫氧化鈉溶液體積/mL;m為樣品干質量/g;1為滴定所用氫氧化鈉溶液濃度/mol/L。
1.3.8 硒化能力的測定
準確稱取500.00 mg SDF,緩慢滴加0.5%的HNO350 mL,邊加邊攪拌,均勻后加入0.65 g BaCl2固體粉末,然后滴加5 mg/mL Na2SeO3溶液4.00 mL,50 ℃恒溫下攪拌反應6 h,冷卻至室溫,無水碳酸鈉調節pH=5~6,加入一定量硫酸鈉固體粉,離心得上清液用流水透析1 d,透析液減壓蒸餾至10~20 mL,之后再用蒸餾水透析1 d,透析液冷凍干燥得硒化小米SDF。
稱取50.00 mg硒化小米SDF,加入3.00 mL混酸(V硝酸∶V高氯酸=4∶1) 浸泡過夜,次日加熱消解至消化液出現淺棕色,冷卻至室溫;加入0.50 mL的雙氧水,加熱到出現白煙,冷卻至室溫;用10.00 mL蒸餾水沖洗瓶壁,然后加熱趕酸至剩余體積為1~2 mL,然后加入6 mol/L混酸,定容至10.00 mL;取2.00 mL溶液,加6.00 mL蒸餾水,1.0 mol/L的鹽酸溶液調至pH=2~3,加入4.00 mL體積分數為2%的鄰苯二胺溶液,放置暗處20 min,質量分數5% 的NaOH溶液調節至中性,加入5.00 mL甲苯振蕩2 min,靜置分層,甲苯層在334 nm處測吸光度,得其含量為x[21,22],硒含量按式(2)計算。
(2)
式中:Se為硒多糖中硒的含量/mg/g;Cx為甲苯萃取溶液中硒的濃度/μg/mL;V1為待測水溶液的體積/mL;V2為甲苯萃取液的總體積/mL;V3為用于絡合測試的待測水溶液的體積/mL;m為多糖亞硒酸酷的質量/g。
1.4 數據統計與分析
所有實驗均進行3次平行,取其平均值,SPSS 22軟件對數據進行顯著性分析(P<0.01),Excel 2019對數據進行統計分析,用Origin 8.0軟件進行繪圖處理。
2 結果與分析
2.1 改性小米SDF的紅外光譜分析
小米SDF的紅外光譜圖如圖1所示,4種SDF具有相似的光譜模式,但改性后部分纖維素類多糖特征吸收峰強度發生變化[23]。4種SDF在2 984 cm-1處出現飽和的C—H伸縮振動,峰強較弱,這可能是烷烴類的C—H振動峰;2 192~2 204 cm-1處的特征吸收峰由炔烴C—H的伸縮振動所致;1 467 cm-1處可能是O—H的變形振動引起;1 400~1 200 cm-1范圍內為C—H或C—O的變角振動吸收峰,這些區域的吸收峰為糖類的特征吸收峰[24],SDF2和SDF3在1 361 cm-1處出現特征吸收峰,SDF1和SDF4在1 358 cm-1處出現特征吸收峰,這是甲基的C—H對稱彎曲振動引起的,由此可知小米SDF與糖類存在相似的結構;指紋區在1 300~650 cm-1處出現吸收峰,分別在1 279、869、855、753 cm-1處出現吸收峰,分別對應C—O、C—C伸縮振動峰和C—H面外彎曲振動吸收峰[25],其中869 cm-1處的特征吸收峰,是糖分子中次甲基的橫向振動吸收,表明小米SDF中有甘露糖苷鍵存在[26]。4種SDF雖然改性方法不同,但峰型及出峰位置無明顯變化,說明物理改性不會改變物質結構,但由于官能團含量或結合方式不同,所以導致峰的吸收強度不同,且這些基團對SDF理化性質如持水力、油能力、陽離子吸附和金屬螯合等起著重要作用[27]。
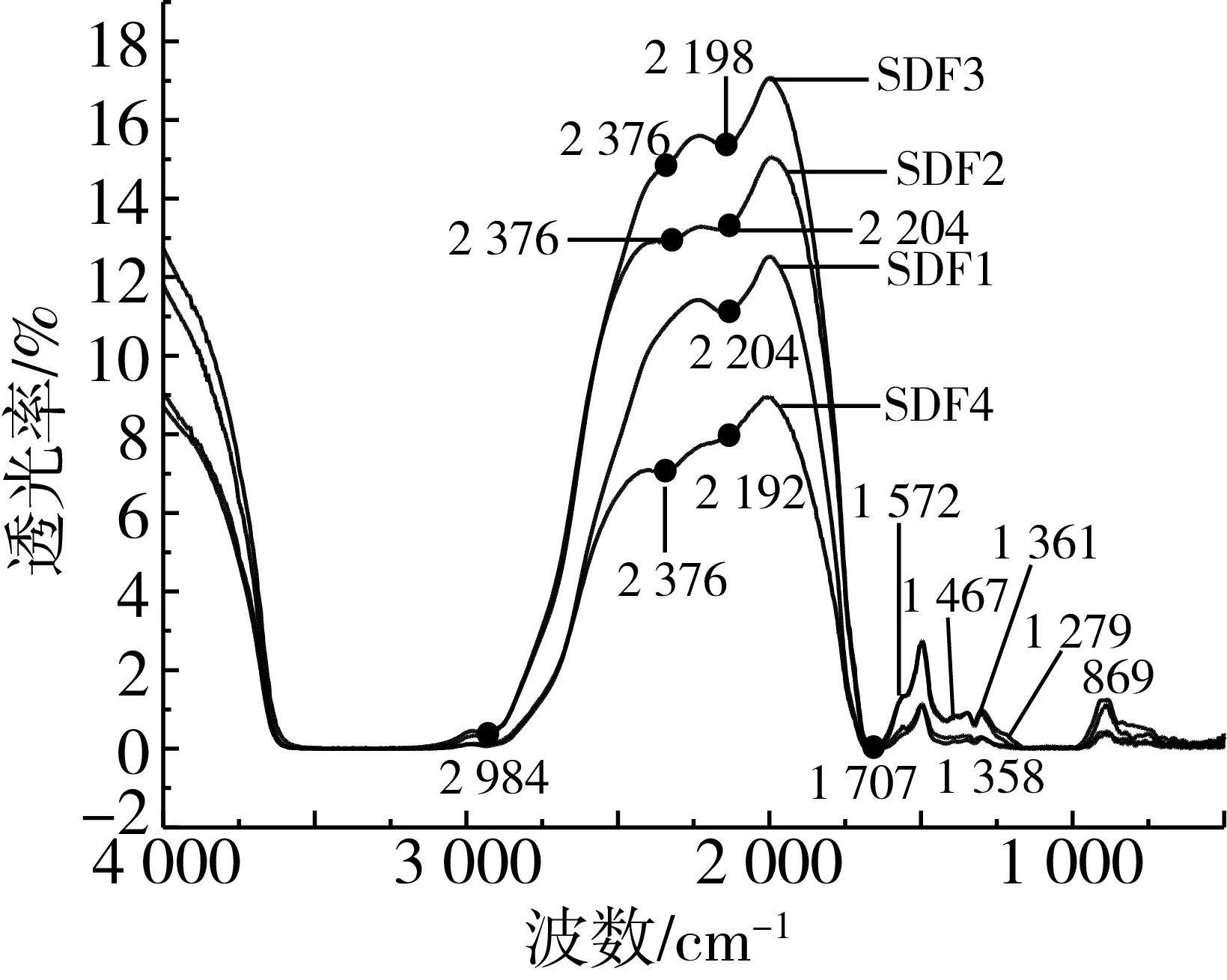
圖1 小米SDF的傅里葉變換紅外光譜圖
2.2 改性小米SDF的顯微結構
4種小米SDF的微觀形態如圖2所示,2萬倍放大倍數下,小米SDF表面網狀結構被破壞,組織結構疏松,放大倍數增大后,小米SDF微觀結構為大小不一的顆粒圓球狀,分布較密集。當放大倍數為2萬倍時,SDF3較其他3種SDF出現明顯的片層結構,而放大倍數為5萬倍時,SDF1微觀結構似葡萄串狀,中間有較大孔隙,SDF2結構分布較均勻,SDF3結構為顆粒圓球狀,有較明顯的片層存在,SDF4孔隙較大。可能是因為物料經過處理后粒度更加均勻,使其微觀結構和分子大小改變[28],或者超微粉碎協同U-M作用極大程度地破壞了纖維的糖苷鍵及分子間氫鍵作用力,使得SDF降解,分子質量降低,聚合度變小[29]。超微粉碎協同U-M萃取改性可破壞SDF的網狀結構,使SDF表面粗糙,出現片層結構,而且超微粉碎極大的剪切力可以使SDF的內部結構發生變化,使包裹在內部的基團暴露出來,與傅里葉紅外光譜的結果也一致[30]。

注: 圖b、圖d、圖f和圖h分別為圖a、圖c、圖e和圖g的局部放大圖。圖2 小米SDF的掃描電子顯微鏡圖
2.3 改性小米SDF的相對分子質量分布
采用凝膠滲透色譜法測定4種SDF分子質量繪制出的分布圖,結果如表1所示。從重均相對分子質量角度分析,SDF2的重均分子質量大于其他3種SDF,說明SDF2較其他3種SDF分子鏈長,分析可能是由于酶法提取的反應條件較溫和,作用于物料細胞壁釋放SDF,而未對SDF大分子進行降解[31],而其他3種SDF的分子鏈被切斷,聚合度降低,從而使其重均相對分子質量降低[32]。4種SDF的分散指數均大于1,說明分子質量呈多分散,有自由基產物存在,其中SDF2分散指數大于3,說明SDF2的分子質量較大且分布范圍廣[33]。超微粉碎協同U-M萃取改性會使小米SDF分子鏈被切斷,聚合度降低,分子質量降低。

表1 小米SDF分子質量測試結果
2.4 改性小米SDF的X射線衍射結果
圖3為4種SDF的X-衍射圖譜, SDF1在2θ為14.08°、19.85°和32.19°處有明顯的結晶衍射峰,SDF2在2θ為21.02°處有明顯的結晶衍射峰,這表明SDF1的晶體為纖維素Ⅰ型和纖維素Ⅱ型,SDF2的晶體為纖維素Ⅰ型[34],根據Segal[35]的計算方法,可計算兩者的結晶度分別為24.50%、20.19%,說明U-M萃取處理使小米SDF表面結構被破壞,結晶區暴露,從而結晶度增大[36];SDF3和SDF4在2θ范圍內衍射強度較弱,無明顯的結晶衍射峰。李楊等[37]研究發現物料粒度對DF衍射峰的位置無明顯影響,但是衍射峰的強度卻隨著物料粒度的減小而減小,而且衍射峰寬度增加;王秋陽等[38]分析造成這種現象的原因是超聲波使結晶區纖維素分子間的氫鍵破壞,纖維素分子發生部分降解,進而使得衍射峰不明顯,本結果與前人研究結果相同,證明物料粒度及超聲波對物料結構具有一定影響。超微粉碎對小米SDF結晶區造成破壞,但不會改變晶體結構。
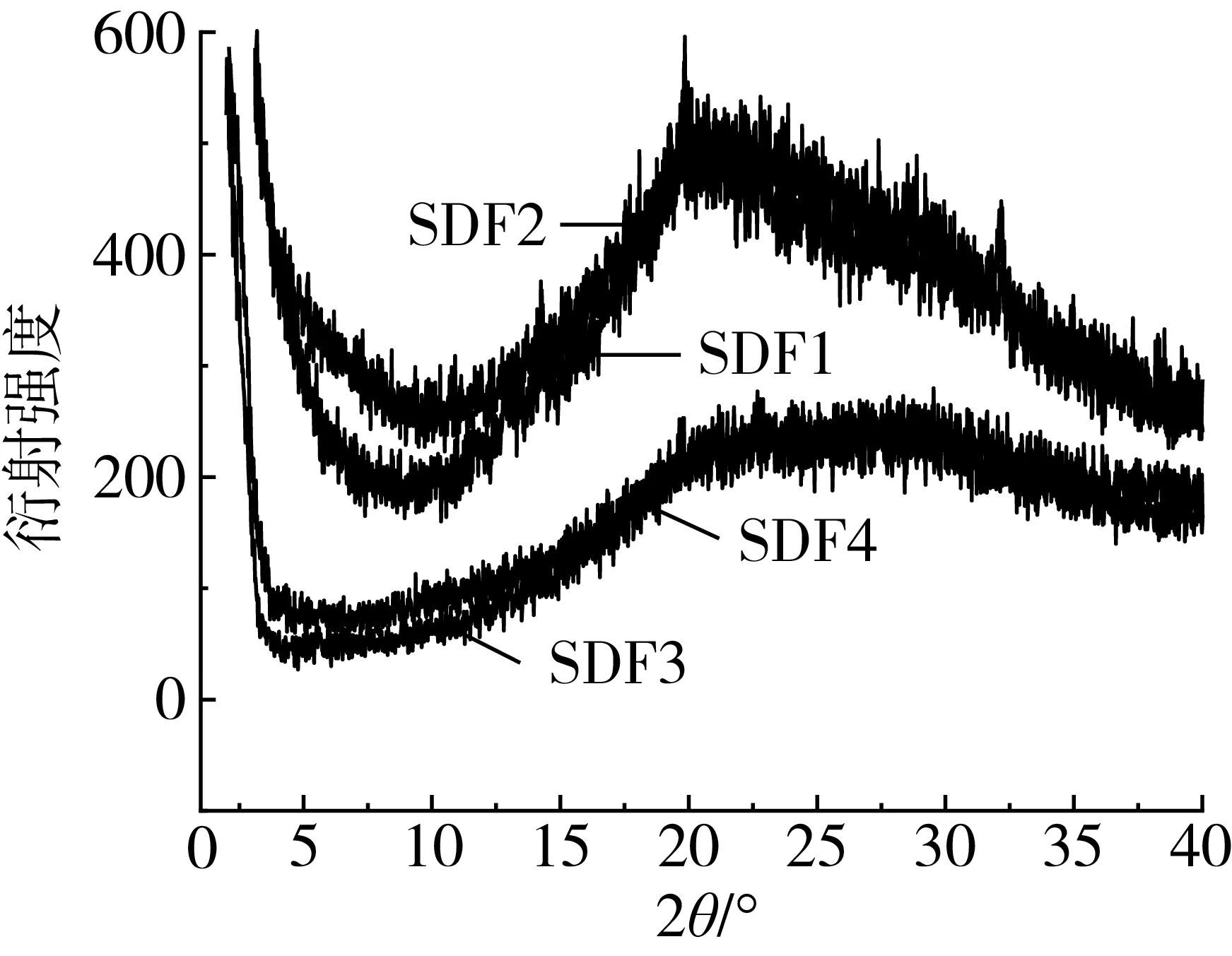
圖3 小米SDF的X-衍射圖譜
2.5 改性小米SDF的陽離子交換能力的比較
膳食纖維的羧基、羥基等離子型官能團的暴露量是判斷其陽離子交換能力強弱的關鍵影響因素[39]。由圖5可知,4種SDF的陽離子交換能力強弱依次為SDF3>SDF1>SDF4>SDF2,說明物料經超微粉碎協同U-M萃取改性可以提高小米SDF陽離子交換能力,這可能是由于超微粉碎減小了物料粒度,使其表面暴露出許多糖醛酸結合位點[40],增加了交換的概率,再加上U-M萃取具有超聲波的空化作用及微波的高能作用[41],可以使SDF表面積增大,基團暴露,與傅里葉紅外光譜測定結果一致。本研究表明超微粉碎協同U-M萃取改性對小米SDF的陽離子交換能力具有顯著的增強作用,有助于SDF與硒的結合能力的提高。
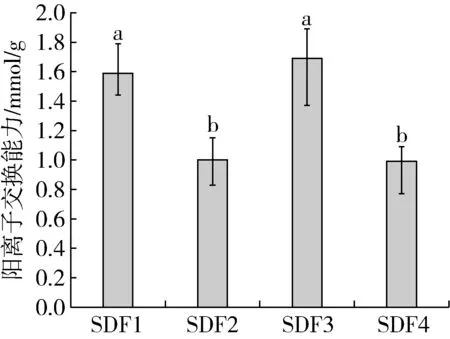
圖5 小米SDF的陽離子交換能力的比較
2.6 改性小米SDF硒化能力的測定

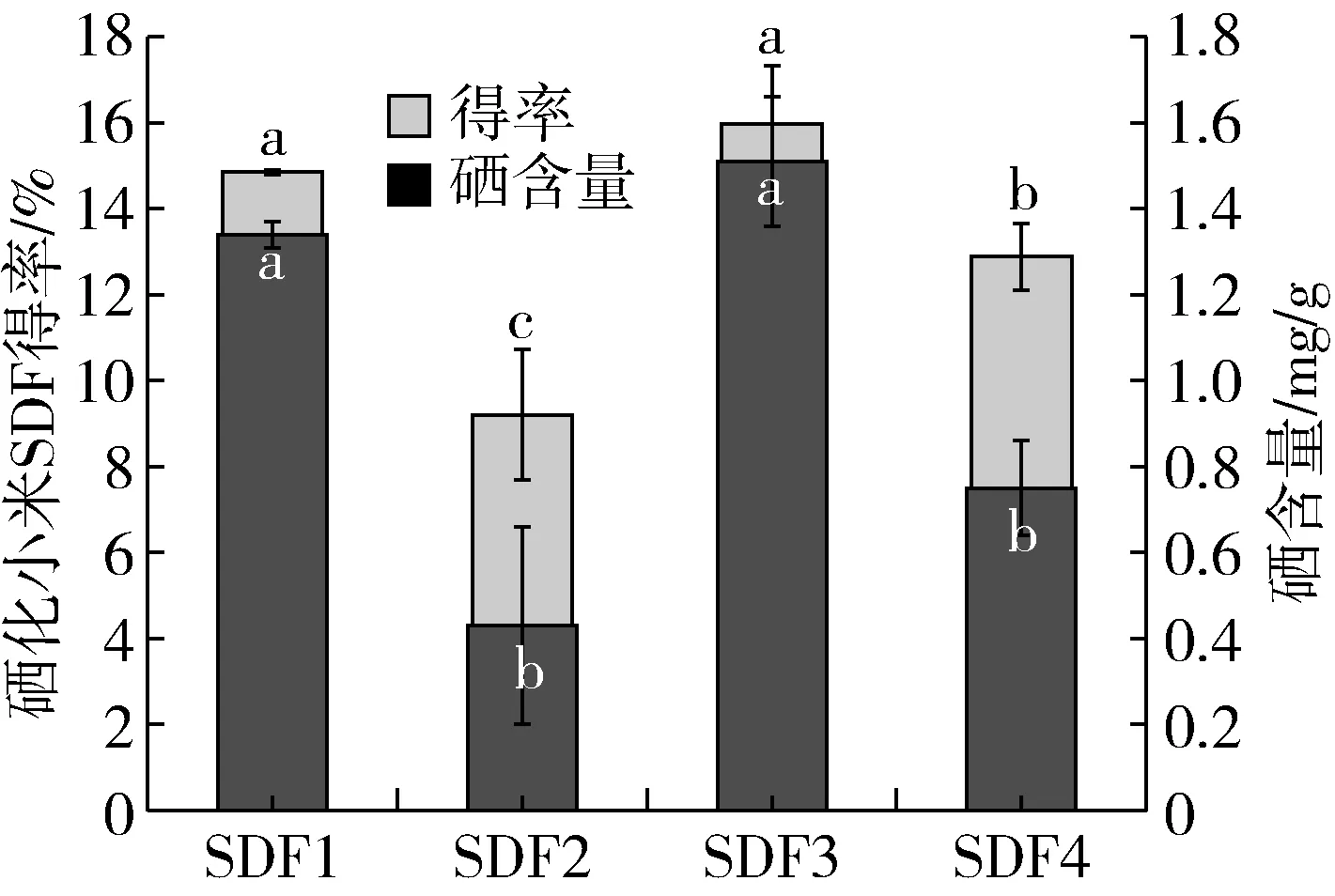
圖6 小米SDF硒化能力的比較
3 結論
利用3種物理方法對小米進行改性處理,并對4種小米SDF與硒元素的結合能力進行考察,實驗結果表明物理改性對小米SDF官能團、結晶度無明顯影響,而對于小米SDF微觀結構、分子質量大小及分布范圍具有一定影響,其中超微粉碎協同U-M萃取可使小米SDF呈現較明顯的特征吸收峰,分子質量減小,X-衍射峰寬度增加,并且使SDF具有較強的陽離子交換能力和硒化能力。本研究僅對小米中的SDF進行了物理改性,后續可利用生物方法或物理生物相結合的方法對其進行改性。

