金喉健配方超臨界提取工藝產物體外抗病毒研究
溫榮城 賈金艷 李霞
【摘 要】 目的:評價金喉健配方超臨界提取物的體外抗流感(H1N1)病毒活性。方法:通過流感病毒感染MDCK細胞來測定病毒TCID50/mL=10-6.25;將提取物加入細胞已成膜的96孔板中檢測金喉健配方超臨界提取工藝產物對細胞的毒性;將提取物和病毒混合后加入細胞中檢測金喉健配方超臨界提取工藝產物體外抗流感病毒活性。結果:提取物的抗病毒活性與濃度呈正相關性,半數抑制濃度(IC50)為8.71μg/mL,在6.25~50μg/mL的有效劑量范圍內,未見對細胞產生毒性,選擇指數(SI)大于11.48。結論:金喉健配方超臨界提取工藝產物具有抗H1N1流感病毒活性。
【關鍵詞】 金喉健;超臨界提取;抗病毒藥;H1N1
Abstract:Objective To evaluate the in vitro anti-influenza (H1N1) virus activity of the product extracted by supercritical fluid extraction of Jinhoujian Spray formulation. Methods TCID50 was determined by influenza virus infecting MDCK cells(TCID50/mL=10-6.25). The extract was added into the 96-well membrane of the cell to detect the toxicity of the product of the supercritical extraction process of Jinhoujian Spray formulation. The extracts were mixed with the virus and then added to the cells to detect the effect of the product on the virus in vitro. Results The antiviral activity of the extract was positively correlated with the concentration. The half-inhibitory concentration (IC50) of the extract was 8.71μg/mL, no cytotoxicity was observed in the effective dose range of 6.25~50g/mL, and the selection index (SI) was greater than 11.48. Conclusion The supercritical extraction process of Jinhoujian Spray formulation has anti-H1N1 influenza virus effect.
Keywords:Jinhoujian; Supercritical Extraction; Antiviral Agents; H1N1
我國自古有采用熏蒸藥材或佩戴含藥材的香囊來避疫、防病的傳統,稱之為“芳香避穢”。芳香類藥材具有抗菌、抗病毒、免疫調節的作用[1- 2]。金喉健噴霧劑(國藥準字Z20025361)是基于民族藥用植物艾納香[Blumea balsamifera(L.)DC.]和大果木姜子(Litsea lancilimba Merr.)兩個芳香類藥材的現代中成藥制劑,其中含有大量揮發油、黃酮和萜類成分[3-6],在臨床上被廣泛用于急慢性咽炎、扁桃體炎、急性支氣管炎、小兒皰疹性咽峽炎等多種疾病[7-10],也有被用于治療柯薩奇病毒感染引發的手足口病,緩解口腔局部癥狀的相關報道[11-13]。金喉健噴霧劑顯現出具有抗病毒活性的新應用潛質,但迄今未有直接的研究報道。
本研究采用現代CO2超臨界提取工藝獲得金喉健傳統配方中的提取物,通過H1N1流感病毒感染MDCK細胞來評價該提取物的體外抗病毒作用,符合中藥品種二次開發和民族醫藥產業的創新與發展戰略,為拓展金喉健噴霧劑在防治呼吸道傳播疾病方面的新應用提供參考。
1 材料
1.1 試劑 DMEM培養基(Gibco公司);DMSO(天津津東天正精細化工試劑廠);奧司他韋(OSV,安耐吉公司);TPCK-胰蛋白酶(上海國源生物技術有限公司);CellTiter-Glo試劑盒((Promega Corp., Madison, WI, USA)。
1.2 儀器 QP-160型CO2恒溫培養箱(BIOBASE公司);XDS-1倒置相差顯微鏡(深圳市星明光學儀器有限公司);L500低速離心機(湖南湘儀實驗儀器開發有限公司);1510全波長酶標儀(Thermofisher公司)。
1.3 病毒與細胞 甲型流感病毒減毒株A/WSN/33(H1N1),由中國醫學科學院醫學生物研究所提供;犬腎細胞(Madin-Daby canine kidney cells, MDCK),由中國醫學科學院醫學生物研究所提供。
2 方法
2.1 供試品制備 使用超臨界CO2提取法對金喉健配方的中藥飲片進行提取獲得提取物,由貴州宏宇藥業有限公司提供(批號:19ZY023001)。以DMSO溶解提取物配置成濃度為10mg/mL、5mg/mL、2.5mg/mL、1.25mg/mL、0.63mg/mL、0.32mg/mL、0.16mg/mL、0.08mg/mL的母液,再分別將母液用培養基稀釋,依次配置成為100μg/mL 、50μg/mL、25μg/mL、12.5μg/mL、6.25μg/mL、3.13μg/mL、1.56μg/mL和0.78μg/mL八個濃度,作為提取物組待測溶液。
以DMSO溶解OSV,再用培養基稀釋為100μm/mL濃度,作為陽性對照組待測溶液;配置含1%DMSO的培養基,作為空白對照組待測溶液。
2.2 病毒培養與毒力測定 將病毒接種于9~11日齡的雞胚尿囊腔,35℃培育72h,無菌操作收獲尿囊液。3000rpm離心15min以除去沉淀,收集上清液。將收集的病毒液做10倍系列稀釋為10-1至10-8共8個稀釋度,加入已貼壁的96孔板MDCK細胞中,每個濃度8個孔,每孔細胞大約3×104個,同時設空白對照組。各孔中MDCK細胞于35℃吸附病毒2h后換用培養液,置于培養箱中繼續培養(37℃,5%CO2),48h后在顯微鏡下觀察細胞病變效應,根據按Reed-Muench法計算病毒的半數細胞培養物感染量TCID50/mL=10-6.25。
2.3 提取物對細胞的毒性作用測定 將MDCK細胞以每孔3×104個細胞接種于96孔板,置培養箱(37℃,5%CO2)中,待細胞單層吸附于96孔板,吸棄上清液。分別加入100μL不同濃度提取物溶液作為提取物組,每個濃度重復3個孔,同時設陽性對照組(OSV, 100μM/mL)和空白對照組(DMSO,1%),置培養箱(37℃,5%CO2)中培養36~40h后,采用CellTiter-Glo試劑盒檢測細胞活力。
細胞活力=各組細胞的檢測值/空白對照組細胞的檢測值×100%
2.4 提取物對流感病毒感染細胞活性的影響 取細胞已單層吸附的96孔板,接種100 TCID50病毒液,每孔100μL,在培養箱(37℃,5%CO2)中吸附2h后,吸棄病毒液。往各孔中分別加入不同濃度提取物溶液作為提取物組,每個濃度重復3個孔,同時設陽性藥組、病毒對照組和空白對照組。置培養箱(37℃,5%CO2)中培養36~40h以后,測定含病毒狀態下各組的細胞活力。計算提取物對病毒的抑制率,采用Probit回歸分析[14]得出半數抑制濃度(50% Inhibiting Concentration, IC50),并計算選擇指數(Selection Index,SI)。
提取物對病毒抑制率=1-(提取物對細胞作用檢測值-提取物對病毒作用檢測值)/(空白組檢測值-病毒對照檢測值)
2.5 統計方法 實驗數據采用SPSS 21.0軟件進行統計學分析,計量資料采用均數加減標準差(x±s)表示,多組間數據比較采用單因素方差分析。P<0.05為差異具有統計學意義。
3 結果
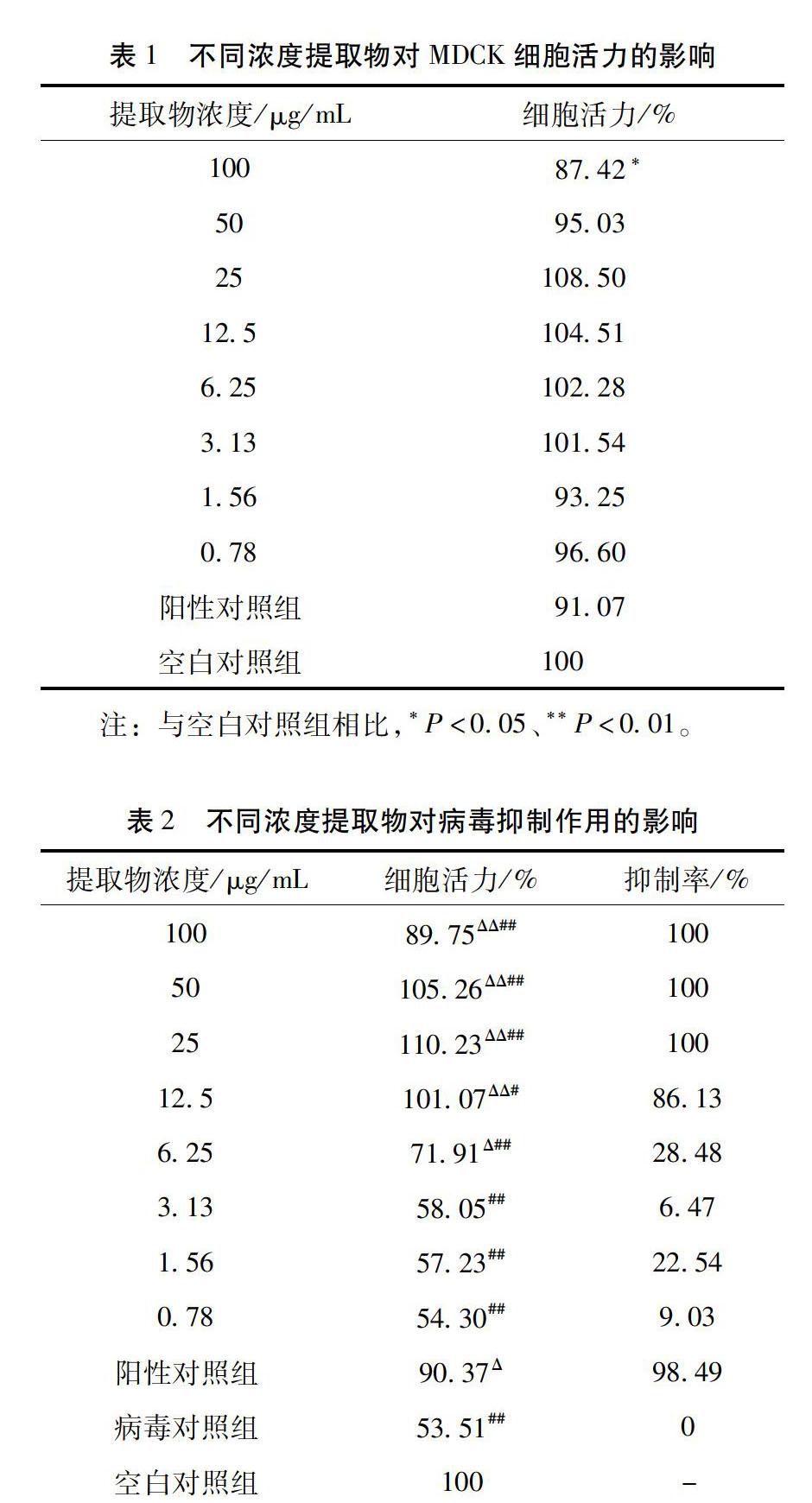
3.1 提取物對細胞毒性作用測定結果 當提取物濃度為0.78μg/mL、1.56μg/mL、3.13μg/mL、6.25μg/mL、12.5μg/mL、25μg/mL和50μg/mL時,細胞活力與空白組差異無統計學意義(P>0.05);在取物濃度升高到100μg/mL時,細胞活力降低至87.42%,低于空白對照組(P<0.05),提取物在此濃度下表現出輕微細胞毒性,但也可推斷提取物對細胞的半數中毒濃度(TC50)應大于100μg/mL。見表1。
3.2 提取物體外抗病毒作用測定結果 當提取物濃度為0.78μg/mL、1.56μg/mL、3.13μg/mL時,提取物組的細胞活力與病毒對照組相比差異無統計學意義(P>0.05),表明提取物在這些濃度時對流感病毒沒有抑制作用;當提取物濃度為6.25μg/mL、12.5μg/mL、25μg/mL、50μg/mL、100μg/mL時,提取物組細胞活力高于病毒對照組,差異有統計學意義(P<0.05),表明提取物在這些濃度時對流感病毒有抑制作用。見表2。
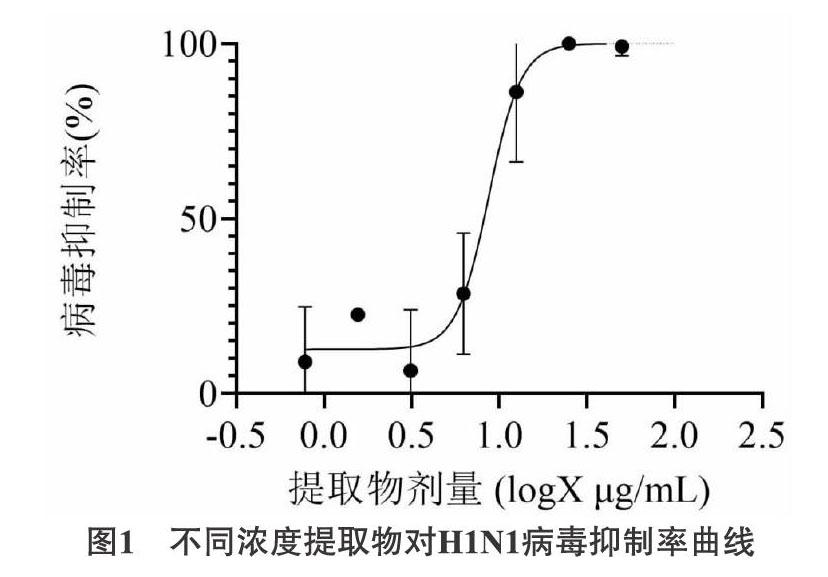
3.3 提取物對病毒的半數抑制濃度 通過Probit回歸分析計算提取物對病毒的半數抑制濃度(IC50)為8.71μg/mL,SI = TC50 / IC50,因TC50應大于100μg/mL,所以提取物選擇指數SI應大于11.48。(在此篩選體系下OSV的IC50為7.12μg/mL)。如圖1所示。
4 討論
流感是由流感病毒引起的一種急性、傳染性呼吸系統疾病,主要通過接觸傳播、飛沫傳播和氣溶膠傳播[15]。人類感染流感病毒后常出現發燒、肌痛、全身乏力、咳嗽咽痛和鼻炎[16]。2019年流行病學研究顯示,全球每年有38.9萬例呼吸性死亡與流感有關,相當于全年呼吸性死亡總數的2%[17],僅2017年流感引發的呼吸道感染導致全球945萬人入院和14.5萬人死亡[18]。因此控制流感的流行已是全球公共衛生系統所面臨的重要問題之一。
目前,抗流感病毒的化學藥主要分為M2離子通道抑制劑、神經氨酸酶抑制劑及RNA聚合酶抑制劑三類,其共同特點是針對病毒生命周期中的特異性靶點設計,作用機理較為清晰,但由于流感病毒基因復制過程中的高突變率易導致各類抗流感藥物臨床應用均受日益顯著的耐藥性限制。M2離子通道抑制劑(M2 Inhibitor),如金剛烷胺,能阻礙病毒外膜與內涵體膜融合,達到阻止病毒基因組復合體無法進入胞漿的目的[19],但目前流行的流感毒株對金剛烷胺類大多耐藥,金剛烷胺在美國已不被推薦用作抗流感藥物[20]。神經氨酸酶抑制劑(NA Inhibitor),如奧司他韋,通過抑制流感病毒的NA蛋白發揮抗病毒作用[21],如今也已出現耐藥性病毒株的傳播。流感RNA聚合酶抑制劑(RNA Polymerase Inhibitor),如巴洛沙韋,可阻止聚合酶功能和流感病毒mRNA復制[22],此類新藥目前僅在美國和日本上市,尚處于專利保護期[23],價格昂貴。因此,尋找兼具低耐藥性與經濟性優勢的新一代病毒抑制劑的研究需求依舊迫切。
天然藥物在我國資源分布廣泛,易獲取,成本低廉,不受化學藥專利保護制約,是我國創新藥物研究的制高點。民間使用藥用植物在預防和治療呼吸傳播疾病有著悠久的歷史,在流感防治方面具有獨特的優勢,不僅表現出廣譜抗病原微生物作用,同時還兼有提升機體免疫和抗炎功效,從而起到綜合治療的效果[24]。本研究發現,金喉健噴配方使用CO2超臨界提取工藝得到的提取物對流感病毒(H1N1)有較好的體外抑制作用,提取物在6.25~50μg/mL的有效劑量范圍內,未見提取物對細胞產生毒性,并且提取物對病毒的半數抑制濃度(IC50)為8.71μg/mL,SI大于11.48,證明了該提取物在抗流感病毒方面的有效性和安全性。本研究為未來金喉健噴霧劑的二次開發,拓展新應用提供了一定的理論依據。
參考文獻
[1]宋文娟,顧偉.芳香中藥的藥理學研究概況與展望[J].中華中醫藥雜志,2017,32(6):2609-2611.
[2]譚艷云,趙揚,王文平,等.藥用香囊淺談[J].中國民族民間醫藥,2017,26(14):6-7.
[3]劉杰,郭江濤.大果木姜子揮發油的研究進展[J].化學工程師,2019,33(12):48-50,36.
[4]王軍才,劉濟明,文愛華,等.貴州省苗藥植物大果木姜子的研究進展[J].黑龍江農業科學,2015(5):157-160.
[5]韋睿斌,龐玉新,楊全,等.艾納香黃酮類化學成分研究進展[J].廣東藥學院學報,2014,30(1):123-127.
[6]吳麗芬. 艾納香提取物質量標準與GC指紋圖譜的研究[D].廣州:廣東藥學院,2015.
[7]丁健,張先華.金喉健噴霧劑對小兒急性化膿性扁桃體炎的療效觀察[J].湖南師范大學學報(醫學版),2008(2):44-46.
[8]杜廣亮,廖媛.金喉健噴霧劑輔助治療小兒皰疹性咽峽炎療效觀察[J].中醫臨床研究,2017,9(32):31-32.
[9]王俊,戚建偉.金喉健噴霧劑臨床療效觀察[J].山西醫藥雜志(下半月刊),2008(10):888-889.
[10]袁娟,劉艷玲.金喉健霧化吸入聯合抗感染治療急性支氣管炎療效觀察[J].中國衛生產業,2014,11(11):14-15.
[11]李亞平,魏劍平,戎萍,等.金喉健噴霧劑治療小兒手足口病32例臨床觀察[J].河北中醫,2011,33(4):634-635.
[12]梁建衛,張玉振,張靜,等.清心瀉脾湯聯合金喉健噴霧劑治療手足口病普通型100例[J].中藥材,2012,35(9):1537-1539.
[13]錢丹丹,蘭和魁,陳劍鋒,等.金喉健噴霧劑治療手足口病口腔皰疹80例[J].世界中醫藥,2012,7(2):119.
[14]田連起,黃鶴歸,葉曉川,等.大青龍湯顆粒劑體外抗甲型H1N1流感病毒實驗研究[J].中醫學報,2013,28(2):172-175.
[15]李夢薇,王婷婷,丁玥,等.黃芩苷協同利巴韋林對流感病毒A/FM/1/47(H1N1)的體內外抑制作用[J].藥物生物技術,2016,23(1):30-34.
[16]COSTA SNIA S,COUCEIRO JOS NELSON S S,Silva Isabel CRISTINA V,et al. Flavonoids in the therapy and prophylaxis of flu: a patent review[J]. Expert opinion on therapeutic patents,2012,22(10):1111-21.
[17]CHRISTOPHER E T,BRIGETTE F B,IBRAHIM A K,et al. Mortality, morbidity, and hospitalisations due to influenza lower respiratory tract infections, 2017: an analysis for the Global Burden of Disease Study 2017[J]. The Lancet Respiratory Medicine,2019,7(1):68-69.
[18]PAGET J,SPREEUWENBERG P,CHARU V,et al. Global mortality associated with seasonal influenza epidemics: New burden estimates and predictors from the GLaMOR Project[J]. Journal of global health,2019,9(2):020421.
[19]CLERCQ D E.Antiviral agents active against influenza A viruses[J]. Nature reviews. Drug discovery,2006,5(12):1015-25.
[20]BASSETTI M,CASTALDO N,CARNELUTTI.Neuraminidase inhibitors as a strategy for influenza treatment: pros, cons and future perspectives[J]. Expert opinion on pharmacotherapy,2019,20(14):1711-1718.
[21]JING X H,MA C L,OHIGASHI Y,et al. Functional studies indicate amantadine binds to the pore of the influenza A virus M2 proton-selective ion channel[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(31):10967-72.
[22]YOUNG-A H. Baloxavir: First Global Approval[J]. Drugs,2018,78(6):693-697.
[23]李佳悅,劉洋.巴洛沙韋[J].中國藥物化學雜志,2019,29(5):411.
[24]徐培平,趙昉,劉妮,等.中藥體外防治甲型H1N1流感病毒實驗研究[J].實用預防醫學,2012,19(8):1121-1124.

