組合式血液凈化治療急性呼吸窘迫綜合征對患者炎癥因子和生物標志物的影響
姚淑雯 許卓謙 利雪燕 李東華 葉家駿 王淑香 鄭國營
廣州市花都區人民醫院重癥醫學科 510800
急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)是多種致病因素(非心源性)所導致的急性、缺氧性呼吸衰竭[1]。臨床表現主要為進行性呼吸困難、心率增速、呼吸窘迫等。ARDS發病機理復雜,確切的發病機制尚不明確,具有發病急和發展快等特點、病死率較高,達到30%~60%[2]。因此探索有效的治療手段,對患者ARDS及時救治,可以有效改善患者的預后情況。近幾年臨床研究和實踐中,血液凈化技術為危重癥患者的治療提供了新的思路和方法[3-5]。血液凈化技術可以有效清除各種毒素和炎癥因子等,保持內環境和代謝的正常穩定,為疾病的恢復創造條件。本研究對本院58例ARDS患者進行組合式血液凈化治療,評估組合式血液凈化措施治療ARDS的臨床效果,同時分析治療后炎癥因子和生物標志物的變化,評估生物標志物在ARDS患者恢復過程中的指示作用,現報道如下。
1 資料與方法
1.1 一般資料 選取2015年4月至2017年4月本院ICU住院的58例ARDS患者,所有患者均符合2012年ARDS診斷柏林標準。納入標準:1個月內未接受過免疫調節治療者;入院前未予以血液凈化治療;氧合指數≤200 mmHg(1 mmHg=0.133 kPa);肺動脈嵌頓壓≤18 mmHg/無左心房壓力增高;急性起病;X線胸片(正位)現雙肺有斑片狀陰影。患者及家屬知情且簽署知情同意書,本研究經本院醫學倫理委員會批準。58例患者男32例,女26例;年齡范圍為28~70歲,年齡(51.9±17.2)歲。以同期58例體檢健康者[男33例,女25例;年齡范圍為26~69歲,年齡(52.7±14.4)歲]作為對照組。兩組研究對象基本資料比較,差異均無統計學意義(均P>0.05),具有可比性。
1.2 方法 患者進行組合式血液凈化治療。首先使用血液灌流器(BS330-Ⅱ,珠海健帆)進行血液灌流(hemoperfusion,HP)治療,HP治療時間為2 h,HP治療結束后拆除血液灌流器繼續進行脈沖式高容量血液濾過(pulsed high volume hemofiltration,PHVHF)治療。前稀釋法,置換液速度70 ml/(kg·h)治療6~8 h后,續行連續靜脈-靜脈血液濾過(continuous veno-venous hemofiltration,CVVH)治療,置換液速度35 ml/(kg·h)。采用肝素對血路進行抗凝,并用無菌氯化鈉溶液間斷性對血路和濾器進行沖洗。
1.3 臨床指標 治療前后分別檢測患者血流動力學指標[血氧分壓(PaO2)、動脈血二氧化碳分壓(PaCO2)、血氧飽和度(SaO2)]和心肺功能指標(心率、肺動脈壓及肺動脈楔壓),分析組合式血液凈化治療措施對患者臨床指標的改善情況。
1.4 炎癥因子檢測 患者治療前后血清中白細胞介素(IL)-2、IL-4、IL-8和腫瘤壞死因子(TGF)-β的表達水平使用酶聯免疫吸附試驗(ELISA)進行檢測。用于檢測的ELISA試劑盒均購自美國OMEGA公司,檢測程序嚴格按照說明書進行。比較分析治療前后各項炎癥因子的表達水平。
1.5 生物標志物的檢測 有研究表明ARDS患者血清血管生成素2和Ⅱ型肺泡細胞表面抗原(KL-6)的表達水平比健康人群更高,提示血管生成素2和KL-6是ARDS潛在的生物標志物。與健康人群相比,ARDS患者血清蛋白C濃度顯著降低。本研究使用商品化ELISA試劑盒分別檢測患者治療前后血清中血管生成素2、KL-6和蛋白C的表達量,ELISA試劑盒購自美國R&D Systems公司。
1.6 統計學分析 用SPSS 21.0統計軟件處理數據,符合正態分布的計量資料采用(±s)表示,組間比較進行獨立樣本t檢驗,組內多時間點比較采用方差分析,計數資料采用例(%)表示,進行χ2檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1 血氣指標 與健康對照組相比,ARDS患者PaO2、SaO2明顯降低,PaCO2明顯升高;ARDS患者經過組合式血液凈化治療后4 h,患者的PaO2、PaCO2、SaO2開始改善,與治療前相比,差異均有統計學意義(均P<0.01);治療后8 h、12 h檢測發現效果越明顯;治療組治療后血氣指標顯著改善,差異均有統計學意義(均P<0.01),見表1。
2.2 臨床癥狀 與健康對照組相比,ARDS患者的心率明顯加快,肺動脈楔壓明顯升高,但是肺動脈壓明顯降低;ARDS患者經過組合式血液凈化治療后4 h,患者的上述臨床指標開始改善,且隨著時間的延長,效果越明顯,差異均有統計學意義(均P<0.01),見表2。
2.3 炎癥因子水平 治療組經過治療后IL-2、IL-4、IL-8、TGF-β炎癥因子濃度比治療之前顯著下降,差異均有統計學意義(均P<0.05),見表3。
2.4 血管生成素2、KL-6水平 與健康對照組相比,ARDS患者血清血管生成素2、KL-6濃度顯著升高,ARDS患者經過組合式血液凈化治療后4 h,患者的血管生成素2、KL-6濃度開始降低,且隨著時間的延長,效果越明顯,和治療之前的濃度相比,差異均有統計學意義(均P<0.05),見表4。
2.5 組合式血液凈化對ARDS患者蛋白C的影響ARDS患者血清蛋白C濃度是以對照組健康體檢者濃度百分比表示。從圖1可以看到,ARDS患者血清蛋白C濃度在治療前僅僅相當于健康對照組的52.8%,說明ARDS患者蛋白C濃度顯著低于健康對照組。ARDS患者經過組合式血液凈化治療后4 h,ARDS患者的血蛋白C濃度開始升高,但差異無統計學意義(P>0.05)。然而隨著時間的延長,治療后8 h,ARDS患者的血蛋白C濃度繼續上升,和治療前相比,差異有統計學意義(P<0.05);且隨著時間的延長,效果越明顯。
表1 對照組健康體檢者與治療組急性呼吸窘迫綜合征患者治療前后血氣指標比較(±s)
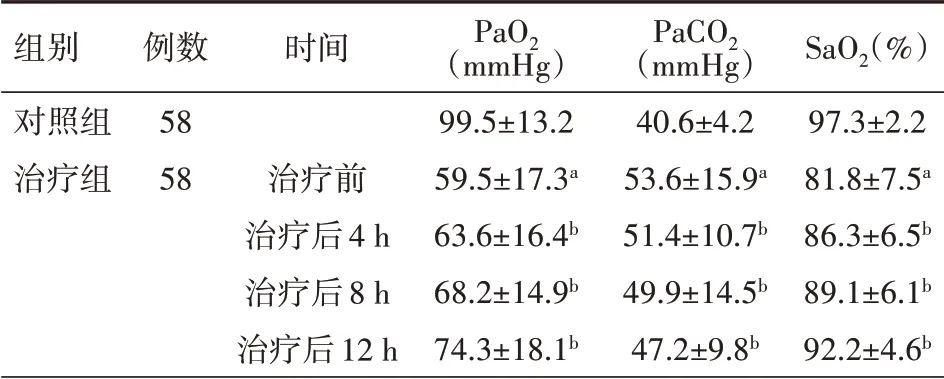
表1 對照組健康體檢者與治療組急性呼吸窘迫綜合征患者治療前后血氣指標比較(±s)
注:與對照組相比,a P<0.01,與本組治療前相比,b P<0.01;PaO2為血氧分壓,PaCO2為動脈血二氧化碳分壓,SaO2為血氧飽和度;1 mmHg=0.133 kPa
組別對照組治療組例數58 58時間治療前治療后4 h治療后8 h治療后12 h PaO2(mmHg)99.5±13.2 59.5±17.3a 63.6±16.4b 68.2±14.9b 74.3±18.1b PaCO2(mmHg)40.6±4.2 53.6±15.9a 51.4±10.7b 49.9±14.5b 47.2±9.8b SaO2(%)97.3±2.2 81.8±7.5a 86.3±6.5b 89.1±6.1b 92.2±4.6b
表2 對照組健康體檢者與治療組急性呼吸窘迫綜合征患者治療前后臨床癥狀比較(±s)
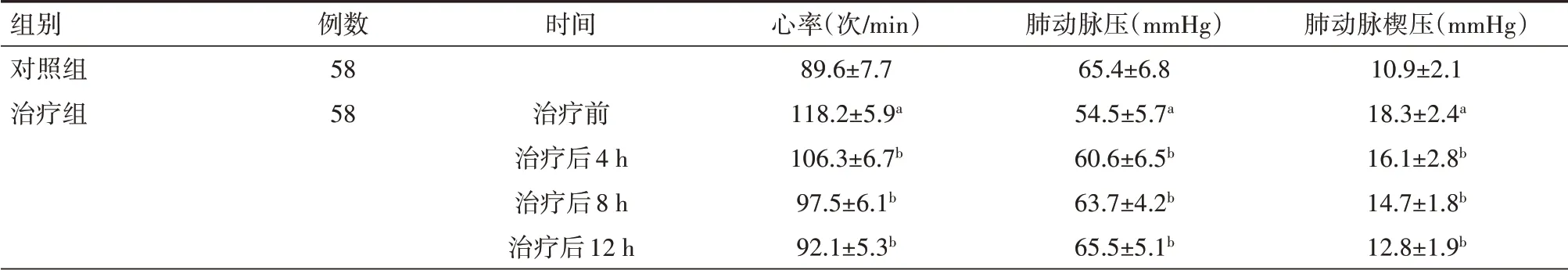
表2 對照組健康體檢者與治療組急性呼吸窘迫綜合征患者治療前后臨床癥狀比較(±s)
注:與對照組相比,a P<0.01,與本組治療前相比,b P<0.01;1 mmHg=0.133 kPa
組別對照組治療組例數58 58時間治療前治療后4 h治療后8 h治療后12 h心率(次/min)89.6±7.7 118.2±5.9a 106.3±6.7b 97.5±6.1b 92.1±5.3b肺動脈壓(mmHg)65.4±6.8 54.5±5.7a 60.6±6.5b 63.7±4.2b 65.5±5.1b肺動脈楔壓(mmHg)10.9±2.1 18.3±2.4a 16.1±2.8b 14.7±1.8b 12.8±1.9b
表3 對照組健康體檢者與治療組急性呼吸窘迫綜合征患者治療前后炎癥因子水平比較(ng/L,±s)
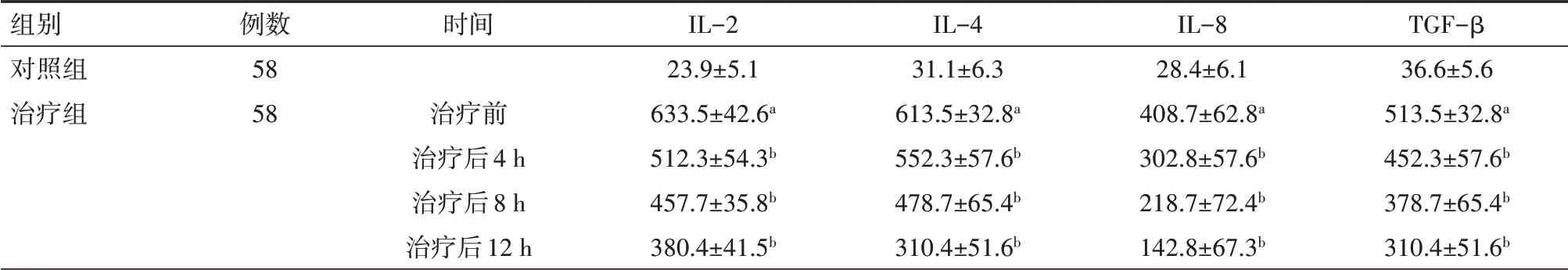
表3 對照組健康體檢者與治療組急性呼吸窘迫綜合征患者治療前后炎癥因子水平比較(ng/L,±s)
注:與對照組相比,a P<0.01,與本組治療前相比,b P<0.01;IL-2為白細胞介素-2,IL-4為白細胞介素-4,IL-8為白細胞介素-8,TGF-β為轉化生長因子β
組別對照組治療組例數58 58時間治療前治療后4 h治療后8 h治療后12 h IL-2 23.9±5.1 633.5±42.6a 512.3±54.3b 457.7±35.8b 380.4±41.5b IL-4 31.1±6.3 613.5±32.8a 552.3±57.6b 478.7±65.4b 310.4±51.6b IL-8 28.4±6.1 408.7±62.8a 302.8±57.6b 218.7±72.4b 142.8±67.3b TGF-β 36.6±5.6 513.5±32.8a 452.3±57.6b 378.7±65.4b 310.4±51.6b
3 討 論
ARDS誘發因素較多,比如肺炎、大手術、全身感染等都可能導致ARDS的發生,病死率較高,ARDS患者由于呼吸衰竭進而誘發多器官功能障礙是導致其死亡的主要原因。盡管其明確的發病原因還不明確,目前關于其主要發病機制有以下幾種解釋。(1)毛細血管內皮細胞和肺泡上皮細胞損傷和功能障礙,肺泡內聚集蛋白質水腫液;(2)大量中性粒細胞進入肺毛細血管,激活的中性粒細胞釋放大量有害分子;(3)巨噬細胞遷移至損傷部分釋放炎癥因子[6]。因此,觀點是失控的炎癥反應是ARDS發生和進展的關鍵因素。ARDS發生的一個重要特征是巨噬細胞和氣道上皮細胞釋放腫瘤壞死因子(TNF)、IL等炎癥介質,繼而誘導以IL-8為主的中性粒細胞趨化因子的產生,使中性粒細胞在肺內集聚和活化,造成肺部急性損傷[7]。有研究人員使用針對TNF、IL-1和IL-8的抗體對ARDS進行治療,結果并不理想,使用抗體治療沒有降低患者病死率[8]。該結果說明ARDS涉及多種因素和多種炎癥因子,單獨阻斷特定的一個或幾個炎癥因子不能有效改善患者癥狀和預后。因此炎癥因子的清除可實現ARDS較為充分的治療,提高患者的生存率[2]。
表4 對照組健康體檢者與治療組急性呼吸窘迫綜合征患者治療前后血管生成素2、KL-6水平比較(±s)
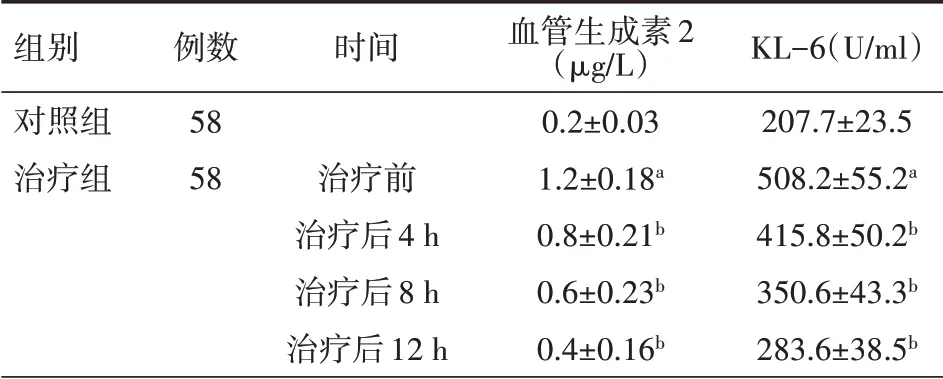
表4 對照組健康體檢者與治療組急性呼吸窘迫綜合征患者治療前后血管生成素2、KL-6水平比較(±s)
注:與對照組相比,a P<0.01,與本組治療前相比,b P<0.01;KL-6為Ⅱ型肺泡細胞表面抗原
組別對照組治療組例數58 58時間治療前治療后4 h治療后8 h治療后12 h血管生成素2(μg/L)0.2±0.03 1.2±0.18a 0.8±0.21b 0.6±0.23b 0.4±0.16b KL-6(U/ml)207.7±23.5 508.2±55.2a 415.8±50.2b 350.6±43.3b 283.6±38.5b

圖1 組合式血液凈化對58例急性呼吸窘迫綜合征患者(治療組)血清蛋白C濃度的影響
組合式血液凈化能夠有效清除血液中有害物質,已經在臨床上廣泛應用,治療急性中毒、膿毒癥和尿毒癥等[3-5]。組合式血液凈化技術是將PHVHF和HP有機結合的治療技術,充分發揮了各種的治療長處。PHVHF作為血液凈化治療中一項重要模式,它主要是以置換液輸入量的增加來清除更多的大中分子溶質,相比傳統血液凈化治療模式可更好改善細胞功能,實現免疫穩態等。HP通過具有廣譜高效吸附效果的活性炭或樹脂灌流器與固態的吸附劑相連,通過吸附將體內外源性或內源性毒物清除出去,之后再將凈化的血液重新送回患者體內,能有效吸附單純PHVHF清除效果不好的大分子炎性介質,清除外源性和內源性毒素,進一步加強清除炎癥介質、細胞因子、膽紅素的作用,從而達到血液凈化的目的。
本次研究則將PHVHF聯合HP對ARDS進行治療,結果顯示,組合式血液凈化患者的血氣指標顯著改善,差異有統計學意義(P<0.05);除此之外,我們還檢測了相關炎癥因子的變化。之前的研究表明,IL和TNF在呼吸系統疾病的發生及發展過程中發揮著重要角色。有研究顯示,ARDS患者血清TNF表達水平較高,與患者病情的嚴重程度呈正相關[9]。上文提到,ARDS發生的一個重要特征是巨噬細胞和氣道上皮細胞釋放TNF、白細胞介素等炎癥介質,繼而誘導以IL-8為主的中性粒細胞趨化因子的產生,使中性粒細胞在肺內集聚和活化,造成肺部急性損傷。而且IL-8也是一個ARDS相關的生物標志物,在早期監測早產兒呼吸窘迫綜合征的研究中證實IL-8水平可以作為臨床預測早產兒ARDS的重要指標,在臨床上具有重要的參考價值[10]。在本研究中,ARDS患者經過治療后IL-2、IL-4、IL-8和TNF顯著降低,標志著該治療方式可以有效清除患者體內炎癥因子,而且進一步證實了IL-8作為生物標志物的作用。
現階段關于ARDS研究集中在治療和炎癥因子的清除,但是相關生物標志物研究甚少。盡管有研究已經鑒定出數個生物標志物,然而他們在ARDS治療和恢復中扮演的角色還很少研究。本研究中,我們選擇以下幾個標志物進行檢測:血管生成素2、KL-6和蛋白C。血管生成素2濃度的提高和肺氣體交換功能障礙相關;KL-6主要在Ⅱ型肺泡壁細胞中表達,其表達量的上升提示肺泡上皮細胞受到損傷。已經有研究證實,外周血中血管生成素2和KL-6的表達水平和ARDS患者的疾病嚴重程度呈正相關,即血管生成素2和KL-6水平越高,說明ARDS患者病情越嚴重[11-12]。而蛋白C則正好相反,和ARDS患者的疾病嚴重程度呈負相關[13]。血清蛋白C濃度較低的患者通常預后較差,伴隨更長的機械通氣時間和多器官功能障礙等。本研究中,ARDS患者在治療前血管生成素2和KL-6比對照組顯著更高,而蛋白C濃度比對照組低,這和之前的研究是一致的。經過治療后,ARDS患者血清中血管生成素2和KL-6都顯著降低。這和兩組血氣指標等改善的情況相一致。患者病情改善的同時,血清中血管生成素2、KL-6顯著降低,說明患者血管生成素2、KL-6作為ARDS生物標志物是可靠的,可以用來預測患者的病情程度和治療效果。同時,ARDS患者經過治療后蛋白C濃度升高,和之前的研究一致,即ARDS病情和蛋白C濃度負相關。本研究證實,血管生成素2、KL-6和蛋白C作為ARDS的生物標志物是可靠的,值得在ARDS患者治療后的檢測。
綜上所述,組合式血液凈化(PHVHF+HP)治療ARDS可改善血氣指標,有效清除炎癥介質,改善肺功能,降低病死率,臨床效果顯著,值得推廣應用。同時,我們還鑒定了ARDS生物標志物(血管生成素2、KL-6和蛋白C)的實用性。這3個標志物用于預測ARDS患者的預后是可行、可靠的。多個生物標志物的同時監測可能比單一的指標能更好預測ARDS的治療和預后。
利益沖突:作者已申明文章無相關利益沖突。

