甲狀腺癌差異表達基因的生物信息學分析
盛福梅, 連 旭, 韓崇旭1,
(1. 揚州大學醫學院, 江蘇 揚州, 225001; 2. 揚州大學醫學院附屬六合醫院 檢驗科, 江蘇 南京, 211500;3. 江蘇省蘇北人民醫院/揚州大學臨床醫學院 醫學檢驗科, 江蘇 揚州, 225001)
甲狀腺癌(THCA)是內分泌系統常見的惡性腫瘤。近些年, THCA發病率快速上升,根據中國癌癥中心網2018年統計[1]顯示, THCA居常見惡性腫瘤的第7位以及女性常見惡性腫瘤的第4位。THCA已成為耳鼻咽喉頭頸外科學、腺體外科學、內分泌學和腫瘤學共同的研究熱點[2]。THCA的發病率以女性居多,學者們揭示了在THCA發生及發展過程中有著重要影響的體細胞基因的改變,但對相關基因表達差異對THCA發病影響的研究較少。本研究運用統計學方法分析江蘇省揚州地區THCA患病情況,并用生物信息學分析篩選參與女性THCA癌變和進展的差異表達基因(DEGs), 以揭示女性THCA發生發展的分子機制,尋找具有臨床意義的生物標志物,現報告如下。
1 材料與方法
1.1 一般資料
收集江蘇省蘇北人民醫院2020年1—12月診斷為THCA患者的臨床資料,共納入患者1 780例,年齡13~84歲,平均(50.3±11.8)歲。根據性別分為男性組(n=300)和女性組(n=1 480), 其中男性組年齡13~81歲,平均(52.37±12.70)歲; 女性組年齡13~84歲,平均(49.88±11.60)歲。男性患者占總體的16.85%, 女性患者占83.15%。女性THCA發病率高于男性,男女發病的性別比為1∶4.93。
患者均符合美國甲狀腺學會修訂發布的《成人甲狀腺結節與分化型THCA治療指南(2015)》[3]中THCA的診斷標準。本研究已獲倫理委員會批準(倫理批號: 2021ky028)。
1.2 統計學處理
采用統計軟件SPSS 25.0分析數據,計數資料以率表示,組間比較采用卡方檢驗,以P<0.05表示差異有統計學意義。
1.3 數據獲取與基因篩選
從GEO數據庫(http://www.ncbi.nlm.nih.gov/geo)下載基因表達譜數據GSE329265, 該芯片為Affymetrix人基因組U133 2.0芯片(HGU133_Plus_2, 安捷倫GPL570平臺)。GSE29265數據集共包括THCA組織及癌旁正常組織20對。男性組為男性腫瘤(MT)、男性正常(MN),女性組為女性腫瘤(FT)、女性正常(FN)。通過在線工具GEO2R(https://www.ncbi.nlm.nih.gov/geo/geo2r/), 以P<0.05和|logFC|>2對2組基因表達數據進行分析。利用Venn軟件(http://bioinformatics.psb. ugent. be/webtools/Venn/)在線獲取各組上調基因、下調基因。logFC>0的DEGs被認為是上調基因, logFC<0的DEGs被認為是下調基因。
1.4 PPI網絡與模塊分析
利用數據分析軟件STRING(https://string-db. org/cgi/input. pl)分別對FT和MT差異基因編碼蛋白進行相互作用分析(置信度≥0.4, 互作最大值=0), 并建立PPI網絡。通過Cytoscape 3.6.0軟件的MCODE 插件從構建的PPI 網絡中選取連接最緊密的模塊進一步分析(設置參數為degree=2, node score=0.2, k-core=2, max. depth=100), 模塊所含基因為關鍵樞紐基因(Hub基因)。
1.5 基因的功能富集
通過在線DAVID網站(https://david.ncifcrf.gov/)對DEGs進行基因本體(GO)功能注釋和京都基因與基因組百科全書(KEGG)通路富集,分析這些基因的生物學過程、細胞組成、分子功能以及主要涉及的腫瘤相關通路。
2 結 果
2.1 不同性別THCA年齡分布比較
60歲以下年齡段,男性和女性THCA患病率隨年齡增長均呈增高趨勢(男性趨勢χ2=191.1,P<0.000 1; 女性趨勢χ2=562.2,P<0.000 1), 女性THCA 40~49歲年齡段的分布高于男性, ≥60歲年齡段的分布低于男性,差異有統計學意義(P<0.05 )。見表1。
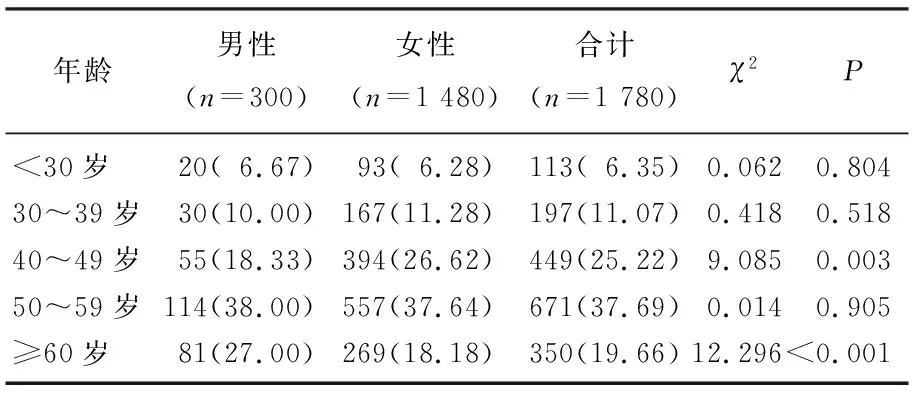
表1 不同性別THCA年齡分布比較[n(%)]
2.2 THCA及正常組織中差異表達基因
通過在線工具GEO2R和Venn分析,在MT中檢測到165個差異倍數達 4 倍以上的顯著DEGs, 包括70個上調基因和95個下調基因; 在FT中檢測到163個顯著DEGs, 包括83個上調基因和80個下調基因,見圖1。2組共有55個上調差異基因, 59個下調差異基因,見圖2。
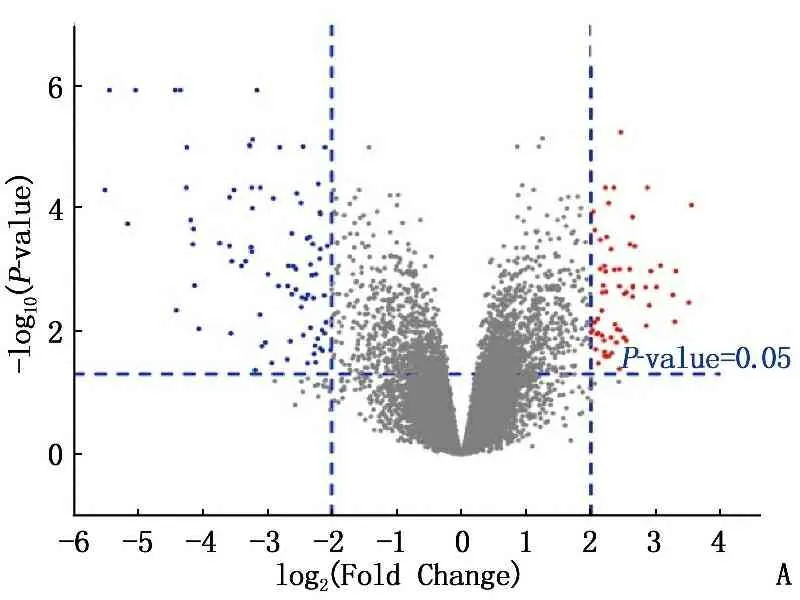
A: 男性組; B: 女性組。
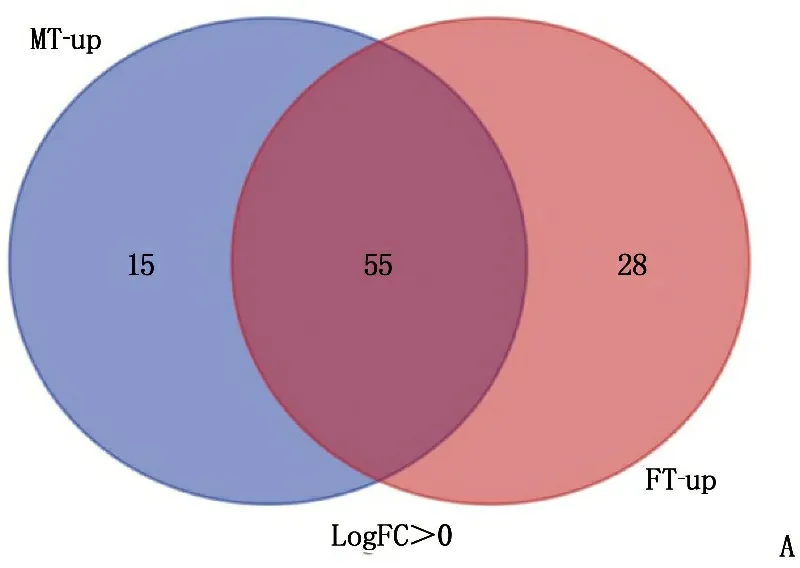
A: MT、FT上調差異表達基因; B: MT、FT下調差異表達基因。MT: 男性腫瘤; FT: 女性腫瘤。
2.3 構建PPI網絡及篩選鑒定Hub基因
分別將MT、FT中篩選獲得的164、190個差異基因輸入到STRING網站,構建各自PPI 網絡(圖3A、圖4A), 然后用Cytoscape軟件中MCODE 插件提取PPI 網絡中連接最為緊密的模塊基因。MT中評分最高的模塊包含了8個基因,共形成了28種相互作用關系,為MT的Hub基因(圖3B)。FT中具有最高連接度的模塊包含了10個Hub基因,共形成25種相互作用關系(圖4B)。結果顯示, Hub基因中有SERPINA1、FN1、CHRDL1和GPC34種基因在2組同時存在,其中SERPINA1、FN1為上調基因,CHRDL1、GPC3為下調基因;APOE、TIMP1、FAM20A和CDH2在MT中獨立存在,均為上調基因; 而PROM1、EVA1A、PRSS23、ITGA2、NCAM1和KIT這6個基因在FT中獨立存在,其中PROM1、NCAM1與KIT為下調基因,EVA1A、PRSS23和ITGA2為上調基因,提示性別因素對THCA的發病機制存在一定影響。
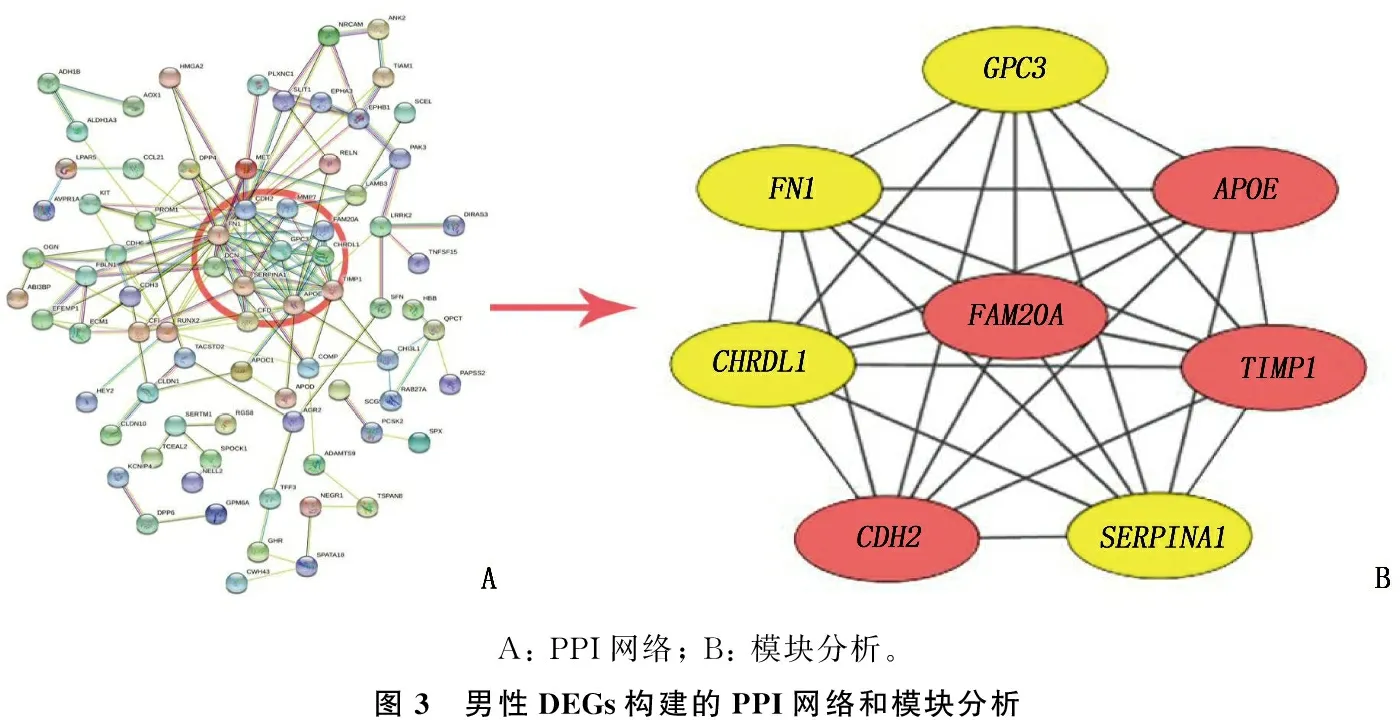
A: PPI網絡; B: 模塊分析。圖3 男性DEGs構建的PPI網絡和模塊分析
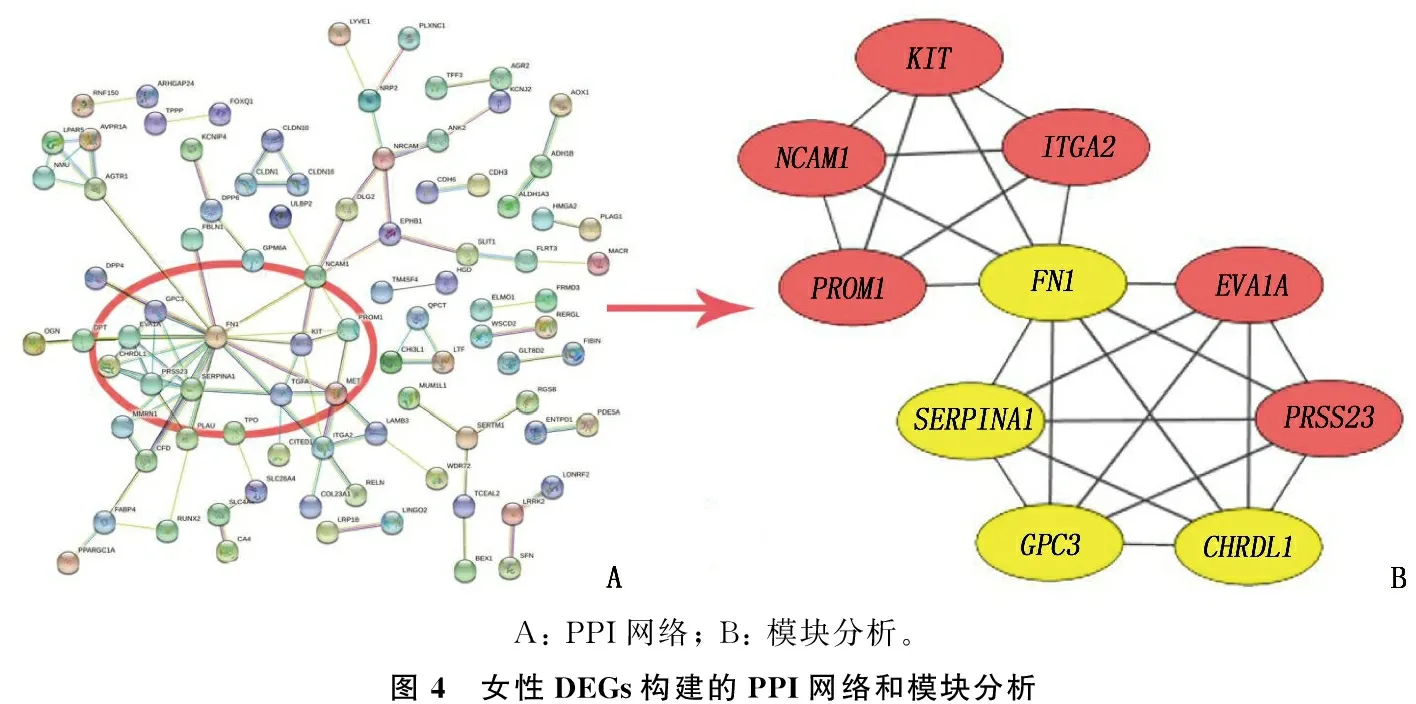
A: PPI網絡; B: 模塊分析。圖4 女性DEGs構建的PPI網絡和模塊分析
2.4 THCA女性組Hub基因GO功能注釋及KEGG信號通路分析
GO分析表明THCA女性組Hub基因:ITGA2、FN1、NCAM1參與細胞黏附生物學過程;KIT、FN1參與基因表達的正調控等生物學過程。SERPINA1、FN1、GPC3、PROM1、PRSS23與細胞外泌體細胞組分相關;FN1、PROM1與內質網-高爾基體中間區室細胞組分相關。SERPINA1、KIT主要分子功能為蛋白酶結合。KEGG分析顯示FT中DEGs主要富集于3條信號通路,富集于蛋白聚糖腫瘤信號通路的基因有ITGA2、GPC3、FN1; 富集于PI3K-Akt信號通路的基因有ITGA2、KIT、FN1; 富集于癌癥信號通路的基因為ITGA2、KIT、FN1。
3 討 論
THCA是最常見的內分泌惡性腫瘤,約占所有內分泌惡性腫瘤的90%。流行病學研究[1]發現,女性THCA患病率顯著高于男性,其原因尚不明確。基因突變是THCA發生發展的重要因素之一,并與其疾病診斷、預后評估及分子靶向藥物治療密切相關。
本研究分析揚州地區1 780例THCA患者臨床資料,發現女性THCA發病率高于男性,男、女發病的性別比為1∶4.93。60歲以下人群中,男、女THCA患病率隨年齡增長均呈增高趨勢。女性THCA 40~49歲年齡段的分布高于男性, ≥60歲年齡段的分布卻低于男性,差異有統計學意義(P<0.05)。研究[4]顯示女性THCA患病率約為男性的3倍,并發現雌激素可能是甲狀腺良惡性細胞的一種有效生長因子。RUBIO G A等[5]實驗發現,絕經后雌激素受體α表達增加可能與甲狀腺乳頭狀癌的侵襲有關,這與本研究結果一致,女性THCA的發病率隨年齡增長逐漸增加,絕經后開始呈下降趨勢。本研究篩選女性組和男性組內差異表達基因,建立各自組內的PPI網絡,從中將聯系最緊密的一個模塊基因提取出來作為關鍵基因研究。篩選2組共同表達的差異基因,并鑒定為非性別差異性基因, 4個為MT特有基因, 6個FT特有基因。6個FT特有基因為:KIT、EVA1A、ITGA2、NCAM1、PROM1和PRSS23, 其表達水平變化可能在女性THCA的發生發展中起關鍵作用。
KIT基因編碼Ⅲ型受體酪氨酸激酶,其在造血、黑色素的生成、精子的生成以及Cajal間質細胞的發育中起多種作用,并已證實其激活突變與多種腫瘤類型相關[6-7]。研究[8]表明,與良性甲狀腺組織相比,甲狀腺惡性病變中的KIT基因表達降低,這與本研究中女性組KIT基因低表達一致。在正常甲狀腺上皮轉化為腫瘤細胞的過程中,KIT基因表達低下,提示該基因可能參與甲狀腺細胞的分化和腫瘤的進展。EVA1A基因位于染色體2p12, 是一種新型的溶酶體和內質網相關蛋白表達基因,參與自噬和細胞凋亡[9]。研究[10-11]證明,EVA1A基因在肝細胞癌和非小細胞肺癌中低表達,且通過自噬、凋亡抑制腫瘤細胞的生長。在結腸腺癌以及彌漫性大B細胞淋巴瘤中,癌組織中的EVA1A基因表達明顯高于在正常組織中的表達。LIN B Y[12]等發現EVA1A是增強THCA侵襲性的有效癌基因。
ITGA2基因編碼整合素蛋白α2, 該蛋白與β亞基形成異源二聚體,主要介導細胞內外信號傳導,在腫瘤浸潤、侵襲和轉移中發揮重要作用[13]。研究[14-16]表明ITGA2的表達與癌癥的轉移及預后相關,許多組學研究已將ITGA2作為胃癌、前列腺癌及乳腺癌早期診治及預后分析的潛在分子標志物。CHERNAYA G等[17]發現在甲狀腺乳頭狀癌(PTC )組織中,ITGA2基因表達水平高于正常甲狀腺組織,并通過實驗發現侵襲性PTC中miR-16的下調導致ITGA2基因表達上調,從而促進腫瘤的入侵和遷移。 神經細胞黏附分子(NCAM1)是一種膜蛋白表達基因,主要在神經系統中表達。實驗[18-19]發現,NCAM1異常表達與多種癌癥的發生發展有關,如急性髓細胞性白血病和小細胞肺癌[19]。NCAM1同樣存在于正常甲狀腺組織的濾泡上皮細胞中, GOLU I等[20]發現NCAM1的表達可使PTC與非腫瘤性病變的其他甲狀腺疾病區分開,具有非常好的敏感性,并認為標志物NCAM1在診斷PTC時,具有評估邊界病變的發展潛力。
由PROM1基因編碼的CD133是一種戊聚糖跨膜糖蛋白,具有作為泛癌靶標的巨大潛力,其通常與包括THCA在內的多種不同腫瘤類型的癌癥干細胞有關[21-22]。研究[23]發現,乙酰膽堿通過激活CD133-Akt途徑增高CD133的表達量,從而提高THCA細胞的自我更新和免疫逃逸能力。PRSS23是一種新發現的絲氨酸蛋白酶基因,與多種類型的癌癥進展有關,如卵巢癌、胃癌[24-25], 敲低PRSS23基因可抑制EIF2信號傳導,進而在體內外抑制胃癌的生長。目前暫未有研究發現PRSS23與THCA的相關性。上述均提示該6個基因與THCA有較為密切的聯系本研究進一步運用GO和KEGG富集分析,發現女性組DEGs對細胞黏附、基因表達的正調控等生物學過程有一定影響,并參與PI3K-Akt、蛋白聚糖腫瘤、癌癥等信號通路的調控。PI3K-Akt信號傳導途徑被認為是癌癥的主要調控因子[26]。研究[27]表明, Akt 作為PI3K-Akt信號通路的關鍵分子,可使細胞周期激酶抑制劑失活,從而促進細胞的生長及腫瘤的生成。同時,該通路的異常活化促進腫瘤細胞的增殖、分化及轉移。因此,監測該通路可有助于預測女性THCA的進展。
綜上所述,本研究分析了揚州地區THCA患者的臨床資料,篩選出THCA性別差異基因,有助于闡明女性THCA發生發展的分子機制,并為潛在的生物標志物提供理論依據,但后續還需分子生物學研究來驗證結果。

