甲基雙加氧酶對非小細胞肺癌增殖、遷移和侵襲的影響及機制
張偉杰, 張若琛, 陳義坤 , 李 岳 , 黃建安
(1. 蘇州大學附屬第一醫院 呼吸與危重癥醫學科, 江蘇 蘇州, 215006;2. 蘇州大學 呼吸疾病研究所, 江蘇 蘇州, 215006)
肺癌是一類惡性程度極高的癌癥,在所有癌癥種類中死亡率居首位。在新診斷的肺癌病例中,約85%被診斷為非小細胞肺癌(NSCLC)[1], 患者5年生存率僅為24%, 腺癌(LUAD)是NSCLC的主要組織學類型[2]。甲基雙加氧酶(TET2)是TET蛋白家族的一員,可催化5-甲基胞嘧啶(5mC)羥基化的酶活性[3]。研究[4]證實TET2的高表達與肝癌、白血病患者的不良預后相關,同時TET2可以通過抑制CD86來抑制自身免疫[5-6]。有關TET2在NSCLC中的作用研究較少,本研究探索TET2對NSCLC細胞增殖、遷移和侵襲能力的影響及可能機制,現報告如下。
1 材料和方法
1.1 材料
人NSCLC細胞株A549、H1299、H460、SPC-A1和人正常支氣管上皮細胞BEAS-2B均從中國上海中科院細胞庫/干細胞庫購買; TET2引物(Genewiz公司); Trizol、逆轉錄聚合酶鏈反應(RT-PCR)試劑盒 (TaKaRa公司); Lip 2 000轉染試劑 (Thermo公司); 胎牛血清(Gibco公司); RPMI-1640 培養基(Corning公司); 抗體: TET2(Millipore公司)、E-cadherin、N-cadherin、Vimentin、Cyclin D1和β-actin抗體及二抗(CST公司)。
1.2 方法
1.2.1 細胞培養: A549、H1299、H460、SPC-A1和BEAS-2B均使用RPMI-1640培養基培養,培養基于培養細胞前均加入10%胎牛血清配制成完全培養基,置于37 ℃、5%CO2恒溫培養箱中培養。
1.2.2 瞬時轉染: 細胞于前1 d鋪板至六孔板中,第2天觀察細胞密度為50%~60%即可進行轉染,轉染步驟嚴格按照說明書進行。
1.2.3 細胞內TET2 mRNA的檢測: Tizol裂解細胞后提取總 RNA,按照試劑盒說明書進行反轉錄及RT-PCR檢測。TET2 上游引物序列為5′-GATAGAACCAACCATGTTGAGGG-3′, 下游引物序列為5′-TGGAGCTTTGTAGCCAGAGGT-3′。
1.2.4 CCK8和克隆形成實驗: 將轉染完成的細胞消化計數后,按每孔3 000個細胞的密度鋪至96孔板中,并進行CCK8實驗。第2天每孔中加入10 μL CCK8試劑,于培養箱中培養2 h后,用酶標儀測定吸光度差值,繪制增殖曲線。將3 000個細胞加入60 mm培養皿中,約50個集落形成后即中止培養,用甲醇固定細胞后加入結晶紫染色,計數克隆數。
1.2.5 Transwell實驗: 預先向侵襲實驗的小室中加入基質膠,培養箱中孵育2 h。將轉染完成的細胞消化計數,遷移實驗上室中加入40 000個細胞,侵襲實驗加入60 000個,24 h后甲醇固定結晶紫染色,棉簽擦去未穿透的細胞,于鏡下200倍視野下拍照計數。
1.2.6 Western blot實驗: 用RIPA提取細胞總蛋白,每60 μL樣品加入16 μL 5×loading buffer和4 μL 二硫蘇糖醇(DTT)。電泳完成后,濕轉2 h, 封閉1 h后一抗4 ℃孵育過夜。二抗室溫孵育2 h, 用增強化學發光法(ECL)顯影對條帶進行顯色。
1.2.7 流式細胞術: 將轉染完成的細胞加入70%乙醇固定過夜,用PI染色液對細胞進行染色,上機進行細胞計數。
1.3 統計學分析
2 結 果
2.1 TET2在NSCLC細胞株中高表達且與患者預后相關
在線數據庫顯示TET2的高表達與肺腺癌患者的不良預后相關,見圖1A。NSCLC細胞株中TET2的mRNA以及蛋白表達量均高于人正常肺上皮細胞,差異有統計學意義(P<0.01或P<0.001), 見圖1B。
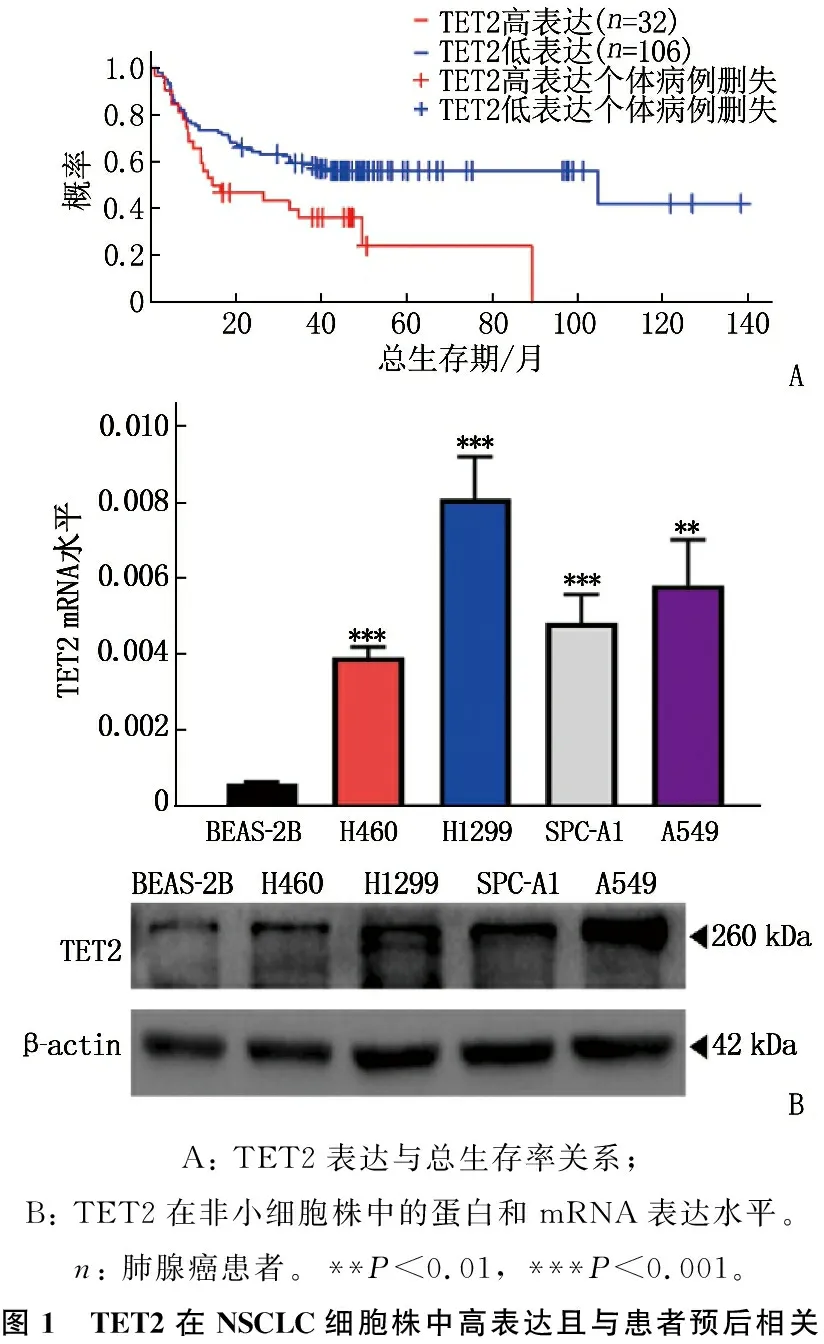
A: TET2表達與總生存率關系; B: TET2在非小細胞株中的蛋白和mRNA表達水平。n: 肺腺癌患者。**P<0.01, ***P<0.001。圖1 TET2在NSCLC細胞株中高表達且與患者預后相關
2.2 敲低TET2可以抑制NSCLC細胞株的增殖能力
瞬時轉染si-TET2后,A549和H1299細胞中TET2的mRNA和蛋白表達均低于對照組,差異有統計學意義(P<0.05或P<0.01或P<0.001), 見圖2A; CCK8(圖2B)以及克隆形成(圖2C)結果提示敲低TET2, NSCLC細胞株增殖能力被顯著抑制(P<0.01或P<0.001)。
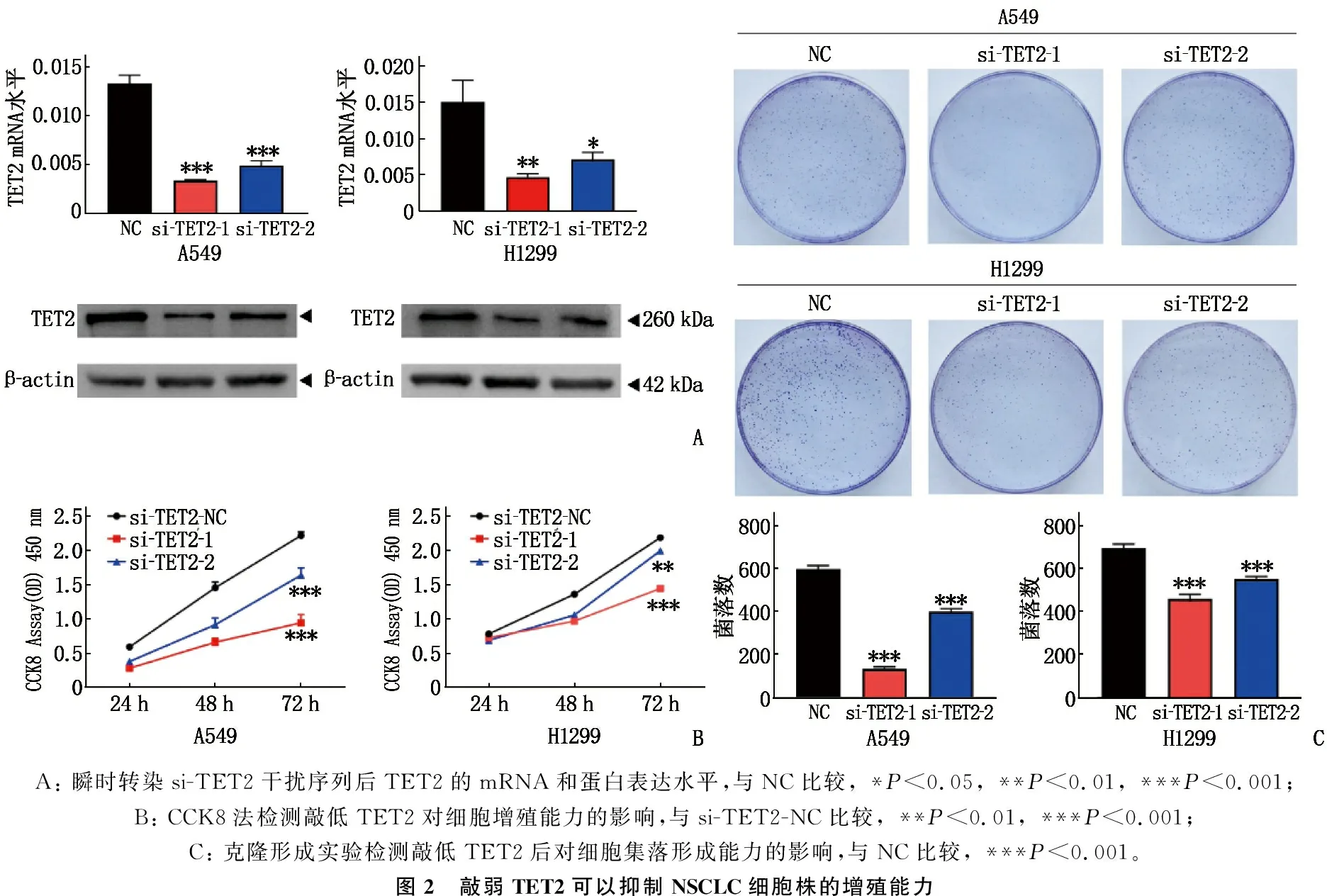
A: 瞬時轉染si-TET2干擾序列后TET2的mRNA和蛋白表達水平,與NC比較, *P<0.05, **P<0.01, ***P<0.001; B: CCK8法檢測敲低TET2對細胞增殖能力的影響,與si-TET2-NC比較, **P<0.01, ***P<0.001; C: 克隆形成實驗檢測敲低TET2后對細胞集落形成能力的影響,與NC比較, ***P<0.001。圖2 敲弱TET2可以抑制NSCLC細胞株的增殖能力
2.3 敲弱TET2可以抑制NSCLC細胞株的遷移和侵襲能力
干擾TET2后, A549和H1299細胞的遷移和侵襲能力顯著減弱(P<0.001), 見圖3。
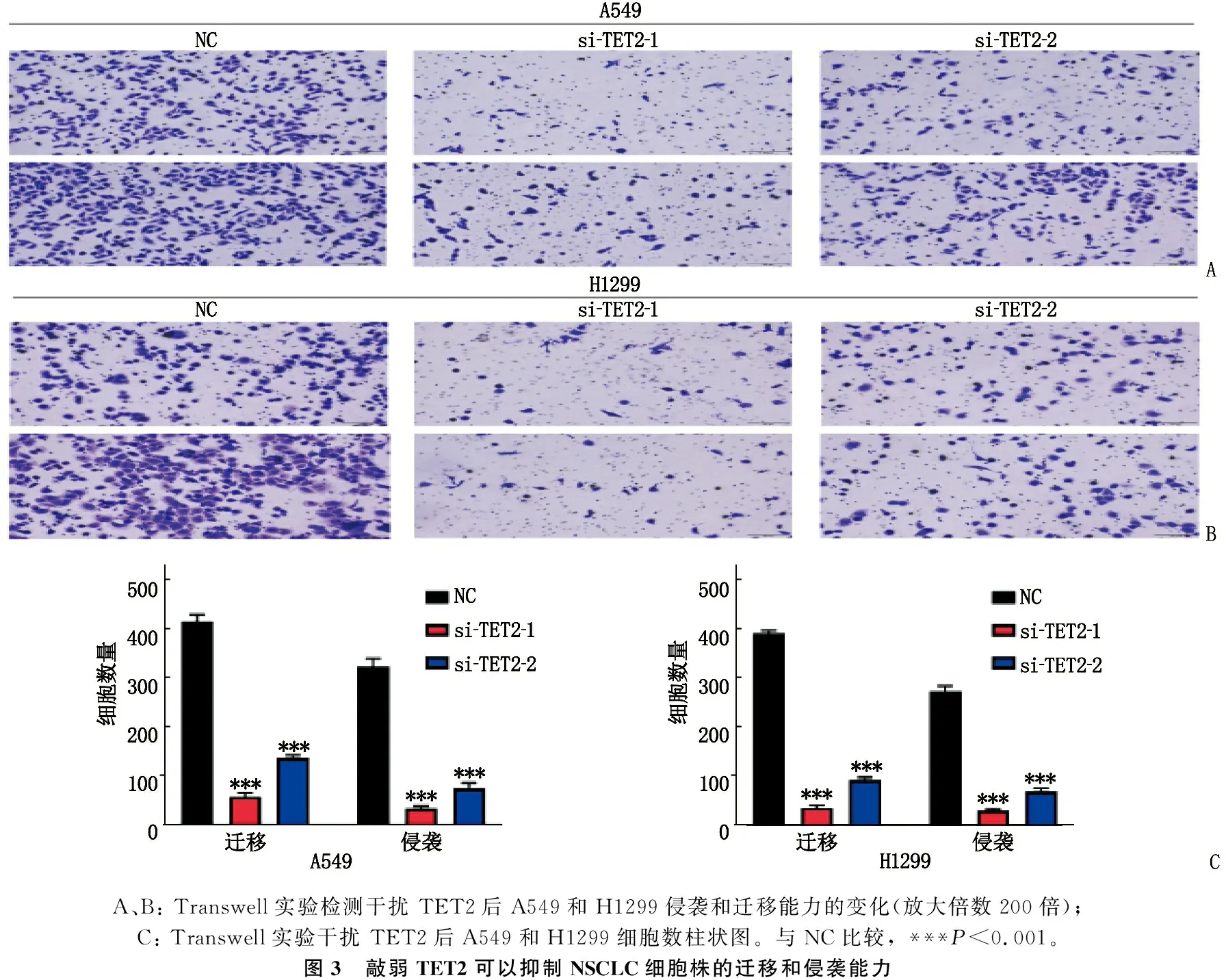
A、B: Transwell實驗檢測干擾 TET2后A549和H1299侵襲和遷移能力的變化(放大倍數200倍); C: Transwell實驗干擾 TET2后A549和H1299細胞數柱狀圖。與NC比較, ***P<0.001。圖3 敲弱TET2可以抑制NSCLC細胞株的遷移和侵襲能力
2.4 敲弱TET2阻滯細胞周期于G0/G1期
敲弱TET2可以將細胞阻滯于G0/G1期,并降低S期細胞比例,見圖4。
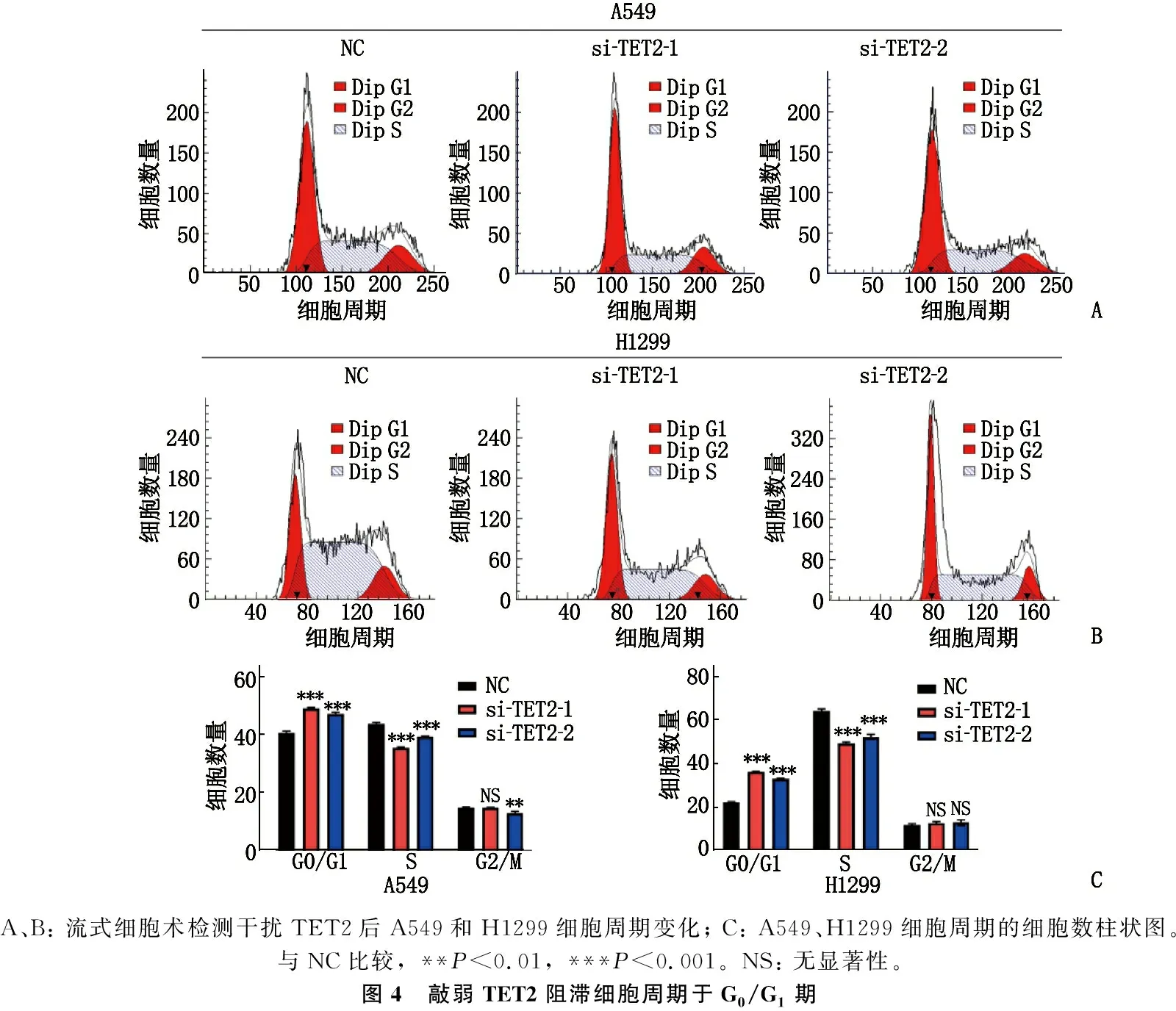
A、B: 流式細胞術檢測干擾TET2后A549和H1299細胞周期變化; C: A549、H1299細胞周期的細胞數柱狀圖。與NC比較, **P<0.01, ***P<0.001。NS: 無顯著性。圖4 敲弱TET2阻滯細胞周期于G0/G1期
2.5 TET2對EMT標志物和細胞周期蛋白的影響
在 A549、H1299細胞中,敲低TET2后, N-cadherin、Vimentin和Cyclin D1蛋白的表達顯著下調, E-cadherin的表達顯著上調,見圖5。
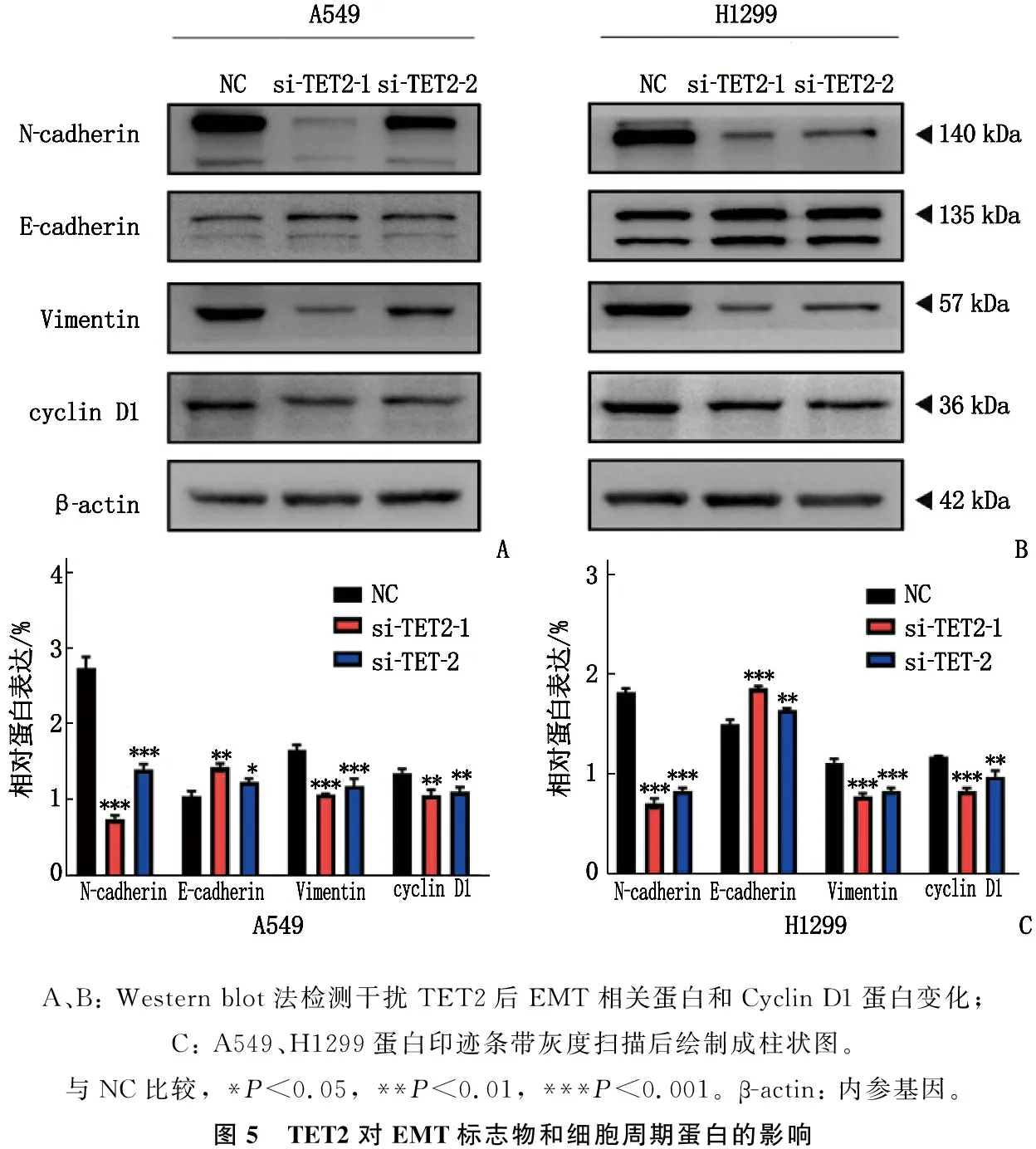
A、B: Western blot法檢測干擾TET2后EMT相關蛋白和Cyclin D1蛋白變化; C: A549、H1299蛋白印跡條帶灰度掃描后繪制成柱狀圖。與NC比較, *P<0.05, **P<0.01, ***P<0.001。β-actin: 內參基因。圖5 TET2對EMT標志物和細胞周期蛋白的影響
3 討 論
TET2作為去甲基化蛋白家族中的一員,已有研究[7]報道同一蛋白家族的TET1在NSCLC中的高表達與患者的不良預后相關。TET2在多種疾病的發生、發展中均扮演了重要的角色,已有研究[4]證實TET2的高表達與肝癌、白血病患者的不良預后相關,同時TET2可以通過抑制CD86來抑制自身免疫[5-6], 但TET2在肺癌中的功能尚未闡明。本研究通過數據庫發現TET2的高表達與NSCLC患者的不良預后相關,并證實TET2可以通過調控細胞周期和EMT進程,促進NSCLC的增殖、遷移和侵襲能力。
TET2作為去甲基化蛋白可以參與甲基化過程,甲基化是指在DNA甲基轉移酶的催化下,在胞嘧啶的C5位上面加上一個甲基,形成5-甲基胞嘧啶的化學修飾過程,其過程受甲基化酶和去甲基化酶的嚴格調控[8]。甲基化主要發生在NSCLC的早期階段,研究[9]表明,BALF的SHOX2/RASSF1A甲基化檢測對Ⅰ期的肺癌患者有極高的檢出率,為85.7%, 遠高于血清CEA和細胞學的10.7%和46.4%。另一項研究[10]通過檢測患者外周血ctDNA中的SHOX2、PTGER4和IDH1的甲基化頻率,證實這3個基因的聯合診斷效能顯著高于單一標志物對肺癌患者的診斷效能。故尋找TET2的甲基化修飾蛋白,發掘新的NSCLC的甲基化診斷標志物,并通過非侵入性手段檢測外周血基因的甲基化頻率,可在提高診斷效能的同時,加強NSCLC的早篩早診,為其診斷提供新的策略。EMT是指上皮細胞丟失原本具有的細胞間的緊密連接,向間質細胞的形態和特性轉變的過程[11-12]。研究[13-15]證實, EMT過程可以促進肺癌、黑色素瘤和乳腺癌的轉移。本研究發現,干擾TET2后可以逆轉EMT進程。EMT在靶向治療后的耐藥研究[16- 17]中同樣被證實具有重要作用,逆轉EMT進程對細胞恢復對靶向藥物的敏感性發揮重大作用,但TET2在耐藥過程中發揮的作用本研究并未進一步探索。
綜上所述, TET2在NSCLC細胞株中高表達,并且可以通過影響細胞周期EMT進程,促進NSCLC細胞的增殖、遷移和侵襲,針對此靶點可以為NSCLC的治療和診斷提供新的策略。

