EPO和CEPO對心肌梗死大鼠梗死面積和血管新生的作用的比較△
黃 妍 冮洪生 李 鳴 徐 標 李文華
(1.武漢市第四醫院,華中科技大學同濟醫學院附屬普愛醫院急診內科 武漢 430033;2.武漢市第四醫院,華中科技大學同濟醫學院附屬普愛醫院心血管內科 武漢 430033)
心肌梗死是冠狀動脈急性、持續性缺氧或缺血引起的心肌梗死,發病后能出現心肌重塑,并在數小時到發生變化,能引起大量中性粒細胞、巨噬細胞浸潤,能造成梗死區心肌局部變薄、分化,從而加重心肌缺血[1]。血管新生最早由1971年在腫瘤生長中提出,逐步被應用于嚴重缺血性疾病的研究中。既往研究表明[2],血管新生具有兩種模式,即芽生式、分割式兩種,而血管內皮生長因子(VEGF)是一種選擇作用血管內皮細胞的細胞因子,主要由垂體濾泡星狀細胞核平滑肌細胞分泌、產生,能增加血管通透性、促進血管新生最強烈的因子之一[3]。血管新生在心肌梗死的發生、發展中發揮了重要的作用,但是其具體機制尚未闡明。氨甲酰促紅細胞生成素(CEPO)屬于是人體內源性糖蛋白激素,能刺激紅細胞生成,廣泛用于獲得性免疫缺陷、貧血、惡性腫瘤中,并發揮了重要作用[4]。同時,CEPO在心臟缺血再灌注損傷時對心臟發揮保護作用[5],但是對心肌梗死新生血管的影響研究較少。本研究以SD大鼠為研究對象,探討CEPO和EPO對心肌梗死大鼠梗死面積和新生血管的作用,現報道如下。
1 資料與方法
1.1 動物資料
購置SD大鼠40只為研究對象,隨機取SD大鼠10只設為空白對照組,剩余30只SD大鼠,采用左冠狀動脈結扎誘導大鼠發生急性心肌梗死動物模型,建模后隨機分為模型對照組、EPO組和CEPO組各10只。40只SD大鼠,雄性,體質量200~250g,平均(230.00±10.00)g。動物合格證號:SCXX-2005-0001,所選動物均購置于實驗動物房,完成大鼠的常規喂養、光照。
1.2 儀器與設備(表1)

表1 儀器與設備
1.3 方法
1.3.1動物處理
(1)建模方法:40只SD大鼠隨機取10只設為空白對照組,剩余30只SD大鼠采用左冠狀動脈結扎誘導大鼠發生急性心肌梗死動物模型。具體方法如下:術前給予75%酒精消毒,并于左胸4~5肋骨部位作橫切口,從左側肋間鈍性分離并將胸腔打開,輕輕擠壓胸腔,并暴露心臟,將心包剪開,在肺動脈圓錐與左心耳交界部位略低處給予無創性縫線完成左側冠狀動脈前降支的結扎,并記錄II導聯心電圖,對于結扎部位以下心肌變白、搏動減弱,且心電圖下可見ST段弓背明顯向上視為建模成功。建模后隨機分為模型對照組、EPO組和CEPO組。(2)處理方法:空白對照組和模型對照組在相同時期給予相同劑量的生理鹽水耳緣靜脈注射;CEPO在冠脈結扎后即刻耳緣靜脈注射CEPO(每周2次),單次注射劑量為50ug/kg;EPO組在冠脈結扎后即刻耳緣靜脈注射EPO,注射劑量為0.3mg/kg。各組大鼠均完成1個月干預。
1.4 觀察指標
(1)血流動力學參數:各組完成1個月干預后經頸動脈插管從BL-410生物技能實驗系統的血流動力學模式下測大鼠血流動力學參數,包括:左心室收縮壓(LVSP)、心室收縮期室內壓上升的最大速率(+dp/dtmax)、左心室舒張壓(LVDP)、心室舒張期室內壓下降的最大速率(-dp/dtmax)水平[6~7];(2)梗死面積:4組大鼠完成1個月干預后以斷頸方式處死大鼠,并取大鼠心臟,將左心室給予生理鹽水漂洗后儲存、備用。常規放置-20℃病學中凍融10min,沿著與心臟長軸垂直方向從心尖向心底做2~3mm切片,并將其放置在37℃溫箱中完成20min染色;取出組織可見梗死心肌為白色,存活心肌為磚紅色,利用剪刀分離梗死區與非梗死區,常規稱重后完成梗死面積計算(梗死面積=左室梗死心肌質量/左室結扎線下心肌質量)[8];(3)血管新生:采用免疫組織化學法測定各組血管新生情況,取上述制備的切片,常規水化后完成組織的修復,經3%過氧化氫阻斷內源性過氧化氫酶的生物學活性,加入單克隆抗體CD34,常溫下15min孵育;向每張切片中加入DAB溶液100uL,沖洗后蘇木素復染;對于染成棕黃色血管內皮細胞計為一個血管計數,每張切片隨機取視野5個,計數梗死邊緣區新生血管數(MVD),取平均值[9~10]。
1.5 統計分析

2 結果
2.1 4組血流動力學參數比較
CEPO組干預后1個月LVSP、+dp/dtmax、-dp/dtmax水平均高于模型對照組和EPO組(P<0.05),LVDP水平低于模型對照組和EPO組(P<0.05);EPO組干預后1個月LVSP、+dp/dtmax、-dp/dtmax水平均高于模型對照組(P<0.05),LVDP水平低于模型對照組(P<0.05),見表2。

表2 4組血流動力學比較
2.2 4組梗死面積比較
CEPO組干預后1個月梗死面積均小于模型對照組和EPO組(P<0.05);EPO組干預后1個月梗死面積小于模型對照組(P<0.05),見表3。
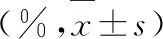
表3 4組梗死面積比較
2.3 4組血管新生比較
免疫組化結果表明:EPO組干預后1個月血管新生數多于模型對照組,但少于CEPO組(P<0.05),免疫組化下染色顏色相對較淡;CEPO組干預后1個月血管新生數量多于其余各組(P<0.05),見圖1。

圖1 4組免疫組化結果(×200)
3 討論
心力衰竭是由于各種心血管疾病發展的終末階段,且臨床已經認識到慢性心力衰竭發生、發展的病理基礎為心室重構。心肌梗死患者發病后心室重構能影響慢性心力衰竭發病率、死亡率[11],因此積極采取措施阻斷心室重構對預防心力衰竭的發生具有重要的意義。本研究以大鼠作為對象,建立心肌梗死動物模型,并給予不同的措施干預,結果表明:CEPO組干預后1個月LVSP、+dp/dtmax、-dp/dtmax水平均高于模型對照組和EPO組(P<0.05),LVDP水平低于模型對照組和EPO組(P<0.05),說明CEPO干預后能改善大鼠血流動力學水平,利于大鼠恢復。CEPO在心肌細胞的凋亡、炎性反應及心肌重構等方面能發揮良好的抑制作用,有助于改善機體的心臟功能[12]。既往研究表明[13]:EPO除了能促進紅細胞生成外,亦可發揮抗凋亡、促進血管新生、調節炎癥反應等作用,對于腦組織、肝臟、腎臟等多個器官具有良好的保護作用。國外學者[14]進行了一項離體心臟模型,結果表明:CEPO的使用能減輕心肌缺血再灌注損傷,能減輕心肌梗死面積;同時,CEPO亦可持續刺激血管新生,能維持心肌所需的營養與血供。本研究中,CEPO組干預后1個月梗死面積均小于模型對照組和EPO(P<0.05);EPO組干預后1個月梗死面積小于模型對照組(P<0.05),提示CEPO和EPO均縮小心肌梗死大鼠梗死面積。此外,國內外實驗證實CEPO能抑制心室重構,而改善心功能,亦可降低血漿內皮素水平,抑制左心室重構,且藥物安全性較高[15]。本研究中,免疫組化結果表明:CEPO組干預后1個月血管新生數量多于模型對照組和EPO組(P<0.05),說明CEPO通過增加梗死部位血管新生數量,能保護心肌功能。
綜上所述,EPO和CEPO均能減少心肌梗死大鼠面積,但是后者效果更佳,能改善病灶部位血流動力學水平,可能與血管新生有關,能為臨床治療提供參考依據。

