雷公藤甲素對人骨肉瘤細胞阿霉素耐藥株的逆轉作用及機制研究
高 峰,王秀會,夏勝利,周小小,易存國,付備剛,沈 超,王明輝
(上海健康醫學院附屬周浦醫院 上海市浦東新區周浦醫院,上海 201318)
骨肉瘤是青少年常見的骨惡性腫瘤,多發于10~16歲,具有惡性程度高和預后差的特點。2009年以前骨肉瘤患者的5年生存率僅為45.7%,隨著新輔助化療技術在骨肉瘤治療中的應用,骨肉瘤患者的生命質量已得到較大提高[1]。新輔助化療技術治療骨肉瘤有兩個顯著弊端:①腫瘤細胞易迅速對化療藥物出現耐藥;②多藥耐藥(Multidrug resistance,MDR)導致化療藥物效能降低[2]。研究[3]指出,P-糖蛋白(P-glycoprotein,P-gp)會將化療藥物從胞內泵出胞外,導致細胞毒藥物濃度降低,單純提高細胞毒藥物濃度來應對MDR效果并不理想。因此,尋找能逆轉MDR作用且毒副作用較小的化療增敏劑對提高骨肉瘤的治療效果具有重要意義。雷公藤草本具有抗炎、抗腫瘤和調節免疫等藥理作用[4]。雷公藤甲素(Triptolide,TPL)是從雷公藤中提取的單體化合物,是雷公藤發揮活性的主要成分之一[5-6]。劉倩等[7]報道TPL可抑制肺小細胞肺癌細胞系A549增殖和誘導凋亡。惠璐璐等[8]證實TPL可提高K562/A02細胞對阿霉素(Adriamycin RD,ADR)的敏感性。因此,本研究探討TPL體外給藥對骨肉瘤細胞MDR效應的逆轉作用及其可能機制。
1 材料與方法
1.1 材料與試劑 人骨肉瘤細胞株U2OS購自中科院上海細胞研究所;CCK-8試劑盒(批號:20170015)購自南京建成生物科技有限公司;實時定量PCR(qRT-PCR)試劑盒(批號:A1852)、羅丹明-123(Rh123,批號:G1124)購自普洛麥格(北京)生物技術有限公司;P-gp單抗(批號:557003)購自美國CST公司;磷酸化蛋白激酶B(p-AKT,批號:G1708)、人磷酸化磷酸肌醇3激酶(p-PI3K,批號:G1708)、多藥耐藥蛋白質1(MDR1)單抗(批號:55510)購自美國Abcam公司;TPL(批號:2017002)和ADR(批號:2017014)購自山東天晟生物科技有限公司;維拉帕米(VER)注射液(批號:國藥準字H31021343)購自上海禾豐制藥有限公司。
1.2 建立耐藥細胞株模型 耐藥細胞株U2OS/ADR使用濃度遞增法進行誘導:取處于對數生長期U2OS細胞,無菌PBS沖洗后加入含ADR(10 μmol/L)的10%血清RPMI-1640培養液于37 ℃、5% CO2條件下繼續培養24 h,吸棄培養液并用胰蛋白酶消化處理成單細胞懸液,計數后調整細胞濃度為2×105/ml并接種于新的培養瓶(不含ADR的新鮮培養液)。待細胞進入對數生長期,無菌PBS沖洗后加入含ADR(20 μmol/L)培養液繼續培養24 h。重復上述操作,直至U2OS細胞可在含1000 nmol/L ADR的培養液中生長為止。實驗前脫藥1周,U2OS和U2OS/ADR細胞均采用含10%血清RPMI-1640培養液于37 ℃、5% CO2條件下進行培養。
1.3 MTT法測定TPL對U2OS/ADR細胞增殖的影響 取處于對數生長期的U2OS和U2OS/ADR細胞消化后,調整密度為5×104/ml,加入96孔板中(100 μl/孔),于37 ℃、5% CO2條件下培養過夜。耐藥指數實驗時,加入不同濃度梯度的ADR。逆轉倍數實驗時,設置ADR濃度分別為10、20、40、80、160、320 μmol/L,實驗組加入TPL(10 μmol/L),陽性對照組加入VER(10 μmol/L)。繼續培養48 h后,于每孔中加入CCK-8工作液10 μl,混勻后避光孵育30 min,在490 nm處用酶標儀讀取吸光值。逆轉倍數=(U2OS/ADR IC50)/(加逆轉劑后U2OS/ADR IC50)。耐藥指數=(U2OS/ADR IC50)/U2OS IC50。
1.4 流式細胞術檢測U2OS/ADR細胞內Rh123評估P-gp水平 取對數生長期U2OS和U2OS/ADR細胞,每孔中加入TPL(10 μmol/L),繼續于37 ℃、5% CO2條件下培養24 h,然后加入10 μmol/L Rh123染液,1 h后消化收集細胞,用流式細胞儀檢測細胞熒光信號強度(488 nm激發光,560 nm發射光)。Rh123陽性細胞數與P-gp轉運作用呈負相關。
1.5 Western blot檢測U2OS/ADR細胞中p-PI3K、p-AKT、MDR1和肺耐藥相關蛋白(LRP)表達水平 采用 BCA蛋白定量法對樣本總蛋白濃度定量后在樣本中加入適量上樣緩沖液并吹打均勻,然后放入沸水中10 min,使蛋白發生變性,置于冰箱-20 ℃保存備用。制備聚丙烯凝膠,將每孔10 μl樣品電泳分離1.5 h后轉膜2 h,脫脂奶粉封閉2 h。取出封閉的膜,TPBS沖洗3次,然后用PBS沖洗1次;p-PI3K、p-AKT、MDR1、LRP一抗(1∶500)常溫孵育12 h,TPBS沖洗3次,二抗(1∶50000)孵育30 min,TPBS沖洗3次,PBS沖洗1次。洗膜時間均為10 min/次。配置適量顯影液后均勻加于條帶上,凝膠成像系統掃描后使用Image-Pro Plus軟件進行分析。
1.6 qRT-PCR檢測U2OS/ADR細胞中MDR1基因mRNA表達水平 取處于對數生長期的U2OS和U2OS/ADR細胞,每孔中加入TPL(10 μmol/L),37 ℃、5% CO2條件下繼續培養24 h,而后消化并收集細胞。TRIzol法提取樣本總RNA以后逆轉錄得到cDNA。MDR1上游引物序列為5’-AAAAAGATCAACTCGTACCACTC-3’,下游引物序列為5’-GCACA AAATACACCAACAA-3’。94 ℃變性3 min后,按下述條件擴增40個循環:95 ℃ 5 s,65 ℃ 35 s,72 ℃ 60 s。擴增后72 ℃延伸5 min。
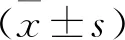
2 結 果
2.1 TPL對U2OS/ADR細胞增殖的影響 CCK-8實驗顯示,TPL濃度為10 μmol/L時,U2OS/ADR細胞的生長速率有所限制,抑制率為(14.9±1.44)%,未超過15%,依然屬于低增殖毒性濃度,故后續研究使用的TPL濃度為10 μmol/L。
2.2 TPL對U2OS/ADR細胞對ADR敏感性的影響 見圖1。與對照組相比,TPL組使ADR對U2OS/ADR細胞生長的抑制作用提高(F=177.5,P<0.05)。ADR對U2OS、U2OS/ADR、TPL+U2OS/ADR、VER+U2OS抑制作用的IC50分別為(40.7±2.17)、(63.4±4.14)、(38.6±3.35)和(47.5±3.13)μmol/L(均P<0.05)。使用前述公式計算,耐藥指數和逆轉倍數分別為1.56和1.64,提示TPL具有逆轉U2OS/ADR細胞MDR的作用。
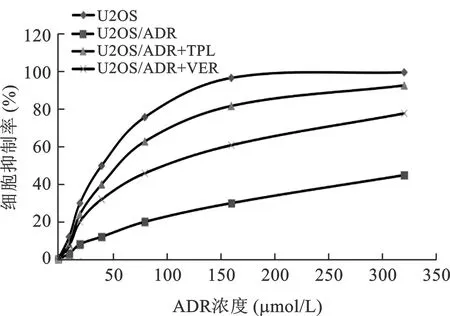
圖1 TPL對U2OS/ADR細胞對ADR敏感性的影響
2.3 TPL對Rh123陽性U2OS/ADR細胞計數的影響 見圖2。TPL組Rh123陽性信號計數與對照組相比提高(F=61.3,P<0.001),相對比為2.12±0.17,提示TPL處理可抑制細胞膜P-gp對Rh123的外排作用。
注:與對照組相比,***P<0.001。空白組:U2OS;
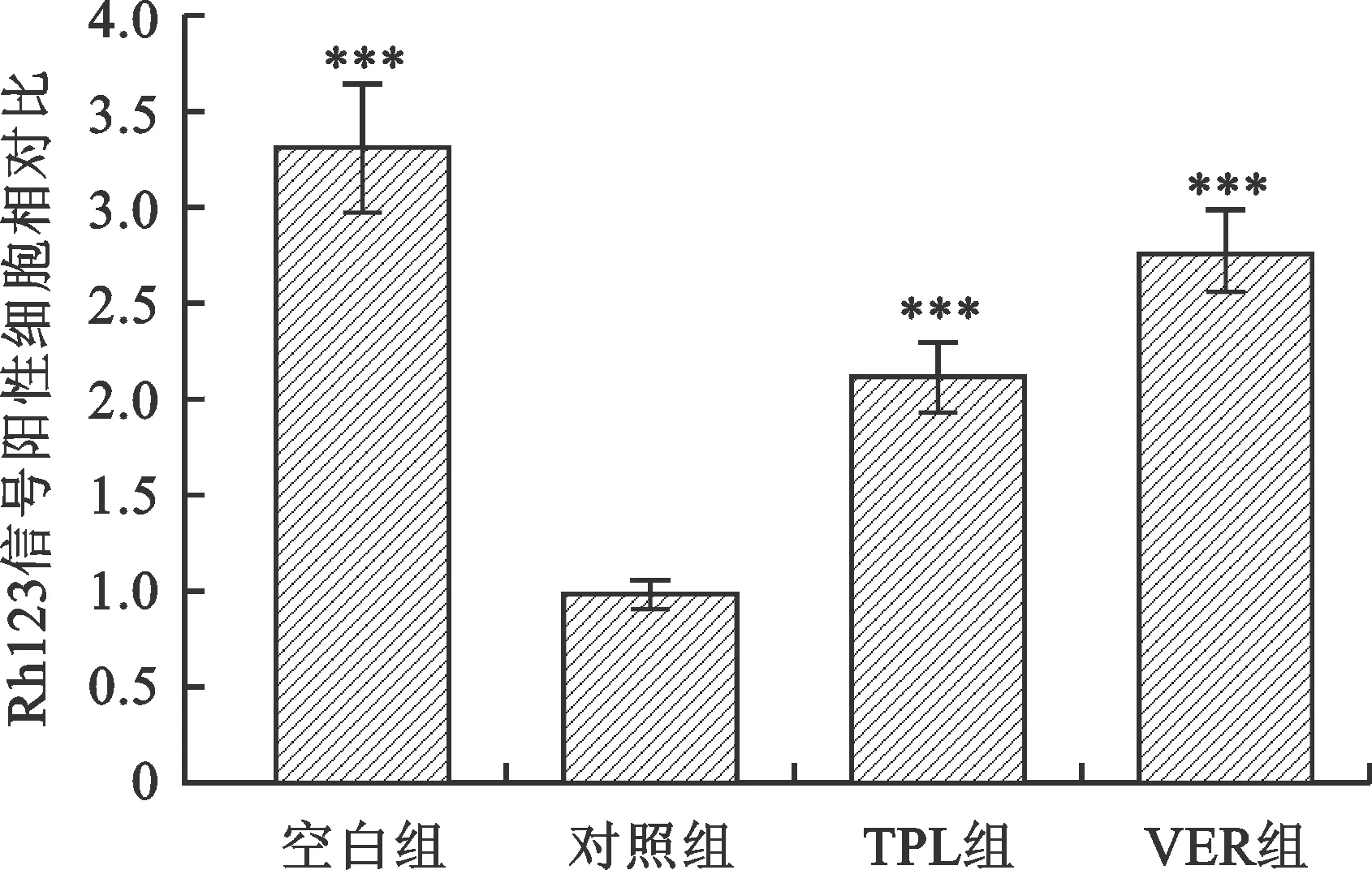
2.4 TPL對U2OS/ADR細胞p-PI3K、p-AKT、MDR1和LRP蛋白表達的影響 見圖3。Western blot結果顯示,經TPL處理后的U2OS/ADR細胞p-PI3K、p-AKT、MDR1和LRP蛋白表達水平與對照組相比均降低(均P<0.05)。
注:與對照組相比,*P<0.05,***P<0.001。空白組:U2OS;對照組:U2OS/ADR;TPL組:U2OS/ADR+TPL10 μmol/L;VER組:U2OS/ADR+VER 10 μmol/L
2.5 TPL對U2OS/ADR細胞MDR1基因mRNA水平的影響 見圖4。經TPL作用后,對照組細胞MDR1基因mRNA水平有所下降(F=72.0,P<0.001);TPL組MDR1基因mRNA熒光強度為對照組的(21.3±1.07)%,組間比較具有統計學差異(t=13.342,P<0.001)。
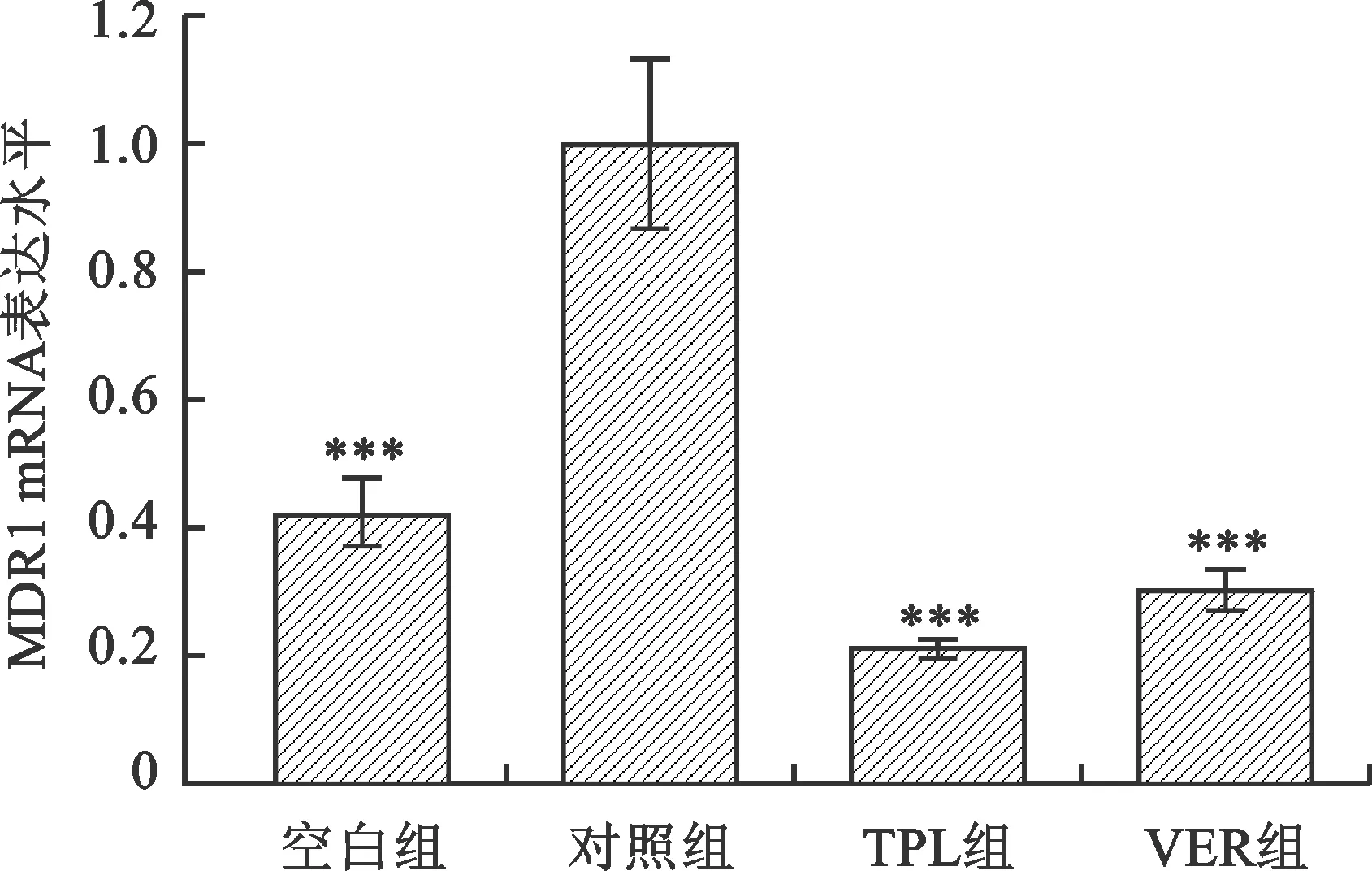
注:與對照組相比,***P<0.001。空白組:U2OS;
3 討 論
骨肉瘤化療耐藥的發生是一個涉及多因素、多水平、多基因的復雜過程,其發生機制主要與膜轉運蛋白、腫瘤干細胞、細胞內解毒系統、細胞凋亡等有關[9]。1976年,Juliano等首次發現腫瘤細胞耐藥的重要機制——跨膜轉運蛋白的藥泵作用,上述機制被稱為“經典的MDR”。ABC轉運蛋白是藥泵作用中最重要的泵蛋白,包括P-gp和多藥耐藥相關蛋白(MRP)等[10]。當這些蛋白質與藥物結合時,會使蛋白質構象發生改變,導致細胞內藥物排出到胞外,從而引起細胞內藥物的有效濃度下降,產生腫瘤細胞耐藥[11]。貴鵬等[12]發現MDR1和P-gp是引起骨肉瘤細胞對化療藥物不敏感的機制之一。Celia等[13]報道MDR1的表達水平與骨肉瘤細胞對化療藥物的敏感性密切相關,MDR1水平越高,細胞對藥物敏的感性越低。本研究結果顯示,與U2OS組細胞相比,U2OS/ADR組細胞中MDR1和P-gp水平明顯升高,說明MDR1和P-gp的過度表達是骨肉瘤細胞MDR的重要機制。因此,抵抗上述骨肉瘤細胞MDR機制的最直接方法是逆轉由P-gp介導的MDR,潛在的干預方案主要有3種,包括抑制MDR1 基因的表達、抑制P-gp 活性以及抑制ATP 酶[14]。研究[15]表明,中藥單體對于逆轉介導的MDR具有毒性低、療效顯著的特點,成為研究的熱點。苦參堿可通過下調耐藥細胞T24/ADM中MDR1表達P-gp 逆轉細胞的耐藥性[16]。Marsousi等[17]研究發現,姜黃素處理結直腸癌細胞Caco-2可顯著下調細胞P-gp mRNA表達水平,減少細胞內羅丹明123外排效率。劉風玲等[18]發現粉防己堿能下調耐藥細胞SKOV3/DDP中MDR1 mRNA 表達,部分逆轉細胞的耐藥性。TPL是一個具有多重生物活性的天然產物,具有抗類風濕、抗氧化和抗癌等功效[5]。前期研究[19-20]也表明,TPL有提高A549/DDP、K562/A02等細胞藥物敏感性的作用。但其作用機制尚不明確,對骨肉瘤細胞耐藥的作用尚未見報道。
本研究證實,TPL可以劑量依賴的方式抑制U2OS/ADR細胞增殖,TPL處理后U2OS細胞對ADR的敏感性提高。流式細胞儀檢測結果顯示U2OS/ADR細胞內Rh123下降,細胞膜表面P-gp表達水平上升,證實本研究采用的細胞模型U2OS抵抗ADR作用與腫瘤藥物外排相關蛋白的表達上調有關。經TPL處理后,U2OS/ADR細胞內Rh123水平升高,膜表面P-gp信號下降,證實TPL具有逆轉MDR現象的作用。Western blot和qRT-PCR結果表明,TPL處理后U2OS/ADR細胞MDR1、LRP、p-PI3K和p-AKT水平下降,證實TPL可以影響PI3K/AKT信號通路,抑制與MDR現象密切相關的蛋白表達。
綜上所述,TPL具有抑制U2OS/ADR細胞生長、提高U2OS對ADR敏感性的作用,其機制可能與抑制PI3K/AKT信號通路活化、下調U2OS/ADR細胞MDR1和LRP基因表達、抑制P-gp對細胞毒物質的外排有關。

