錫林郭勒牧區酸馬奶天然發酵劑中風味物質及微生物多樣性
于佳琦,夏亞男,喬曉宏,靳志敏,李鵬亮,王 茹,王 洋,雙 全,
(1.內蒙古農業大學食品科學與工程學院,內蒙古呼和浩特 010018;2.阿巴嘎旗照富經貿有限責任公司,內蒙古錫林郭勒 011400;3.內蒙古自治區食品檢驗檢測中心,內蒙古呼和浩特 010018;4.呼和浩特市食品檢驗所,內蒙古呼和浩特 010018)
錫林郭勒牧區是蒙古族文化的主要發源地之一,馬匹和酸馬奶是其民族文化的重要組成部分[1]。2019年錫林郭勒地區的馬匹數量超過15萬。母馬的產奶期約73 d,屬于季節性生產[2],不同季節馬奶的售價在30~40元/公斤不等。傳統的酸馬奶是往馬奶中添加天然發酵劑后,在乳酸菌和酵母菌的作用下產酸產氣的輕度酒精飲料。高品質的酸馬奶均勻不分層,具有發酵的香氣以及二氧化碳的刺激感[1]。發酵風味和保存在很大程度上取決于天然發酵劑中的微生物群,因此,優質的天然發酵劑是維系酸馬奶產品品質的關鍵。為了開發工業應用的新產品并保護傳統酸馬奶中的微生物多樣性,對酸馬奶天然發酵劑的自有風味、微生物組成及功能進行詳細的研究是十分有意義的。
Illumina Miseq測序是一種高通量、高精度、省時省力的第二代測序技術[3-4],這一技術可以檢測到很多非培養、低豐度的微生物[5-6],并且彌補了傳統的基于分離培養和生理生化鑒定建立系統發育樹的局限,已廣泛應用于對發酵食品微生態的研究。近年來,較多研究應用分子生物學技術探究酸馬奶的微生物群落結構,發現不同地區以及不同的牧民制作的酸馬奶細菌群落大多由乳桿菌屬、乳球菌屬、鏈球菌屬、醋酸桿菌屬、腸球菌以及部分低豐度細菌屬組成[7-8]。由于傳統的酸馬奶天然發酵劑都是將釀成的酸馬奶取出部分保留而得,因此發現其細菌群落組成與發酵酸馬奶的組成相似[9]。而對酸馬奶及引子中真菌多樣性的探究比較少,本文是首次使用Illumina MiSeq第二代高通量測序技術專門調查酸馬奶天然發酵劑中完整的微生物群落多樣性并預測其中的功能信息。
本研究采用氣相色譜-質譜聯用(GC-MS)及Illumina Miseq第二代測序技術分析錫林郭勒牧區酸馬奶天然發酵劑的主要風味物質及核心微生物群落結構,全面揭示酸馬奶天然發酵劑的風味組成與微生物多樣性,并結合功能預測分析風味相關功能基因,以期為工業化生產酸馬奶的風味調控、品質優化和安全保障提供理論依據。
1 材料與方法
1.1 材料與儀器
酸馬奶天然發酵劑樣本 于2019年6月采自內蒙古自治區錫林郭勒盟阿巴嘎旗的3個平行樣品(命名為YZ_1,YZ_2,YZ_3),在測定總酸度和pH后分裝于采樣管,封口并于干冰中轉移至實驗室,冷凍保存用于后續試驗;3-辛醇(純度≥98%) 上海麥克林生化科技有限公司;E.Z.N.A.?soil DNA kit美國Omega Bio-tek;瓊脂糖 西班牙biowest;FastPfu Polymerase 中國TransGen;AxyPrep DNA Gel Extraction Kit 美國Axygen。
FG2-ELK便攜式pH計 Mettler Toledo;NEVAP-45氮吹儀 美國Organomation;Thermo Trace 1300-ISQ氣相色譜-質譜聯用儀 美國Thermo;DB-Wax(30 m×0.250 mm×0.25 μm)色譜柱 美國Agilent;日立CF16RN冷凍離心機 日本Hitachi;DYY-6C電泳儀 北京市六一儀器廠;GeneAmp?9700型PCR儀 美國ABI;5424R高速臺式冷凍離心機 美國Eppendorf;Miseq PE300測序儀 美國Illumina。
1.2 實驗方法
1.2.1 酸馬奶天然發酵劑pH及總酸度測定 在采樣現場通過便攜式pH計測定pH,滴定酸度參照GB 5009.237-2016《食品pH值的測定》中酚酞指示劑法測定。
1.2.2 風味物質測定方法
1.2.2.1 樣品前處理 參照蘇海榮[10]的方法并稍作改進,取天然發酵劑樣品10 g,加入200 μL質量濃度為310 mg/L的3-辛醇內標物,加入氯化鈉至過飽和(有利于香氣物質的萃取)。取溶液于50 mL離心管中,4 ℃下分別用10和5 mL的乙醚以5500 r/min離心5 min萃取2次,合并上層有機相。氮吹濃縮至約0.2 mL,再以乙醚復融定容至2.0 mL,無水Na2SO4干燥,0.22 μm有機相膜過濾,供GC/MS上機分析。樣品重復測定3次。
1.2.2.2 GC-MS檢測條件 色譜條件:參照洪家麗等[11]方法并稍作改進,進樣口溫度250 ℃;進樣不分流,程序升溫為40 ℃保持5 min,以3 ℃/min升溫至200 ℃,保持5 min,再以2 ℃/min升溫至230 ℃,保持10 min。載氣為氦氣,流速1.0 mL/min。質譜條件:離子化方式:EI;電子能量70 eV;離子源溫度230 ℃;質量掃描范圍40~500 m/z 。
1.2.2.3 定性定量分析 利用Xcalibur工作站NIST譜庫自動檢索各組分質譜數據,并結合保留指數進行定性分析。采用半定量的方法計算各風味化合物的相對含量,根據內標物質(3-辛醇)與各組分峰面積比值計算[12]。
1.2.3 樣品總DNA提取 使用 E.Z.N.A.?soil DNA kit試劑盒進行微生物群落總DNA抽提。提取成功后用1%的瓊脂糖凝膠電泳檢測DNA的提取質量,并使用NanoDrop2000測定DNA濃度和純度。
1.2.4 PCR擴增及MiSeq高通量測序 細菌16S rRNA基因V3~V4可變區:上游引物:338F(5’-ACTCCT ACGGGAGGCAGCAG-3’),下游引物806R(5’-GG ACTACHVGGGTWTCTAAT-3’)。擴增程序:95 ℃預變性3 min,27個循環(95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃穩定延伸10 min,最后在4 ℃進行保存。
真菌ITS區PCR擴增:上游引物:ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3'),下游引物:ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')。擴增程序:95 ℃預變性3 min,27個循環(95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸45 s),然后72 ℃穩定延伸10 min,最后在10 ℃進行保存。
PCR反應體系為:5×TransStart FastPfu緩沖液4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L)0.8 μL,下 游 引 物(5 μmol/L)0.8 μL, TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,補足至20 μL。每個樣本3個重復,將3個重復的PCR產物混合,之后使用2%瓊脂糖凝膠電泳檢測產物[13]。使用AxyPrep DNA Gel Extraction Kit純化PCR產物后用 Quantus? Fluorometer進行檢測定量,按照每個樣本的測序量要求,進行相應比例的混合。寄于上海美吉生物醫藥科技有限公司通過Illumina Miseq PE300平臺進行高通量測序。
1.3 數據處理
使用Trimmomatic軟件原始測序序列進行質控,使用FLASH軟件進行拼接,質控過濾測序質量低、錯配率高和不能進行拼接的序列,得到優質序列進行分析處理。利用上海美吉公司提供的Sanger生物云信息平臺對測序數據進行細菌多樣性分析及微生物功能預測。
2 結果與分析
2.1 酸馬奶天然發酵劑中風味物質分析
采用液液萃取與氣質聯用法(LLE-GC/MS)測定鮮馬奶天然發酵劑中風味化合物,總離子流圖見圖1。
由圖1可以看出,風味化合物分離效果較好,物質種類豐富。在天然發酵劑中共檢測到43種風味物質,包括18種酸類、15種酯類、6種醇類、3種芳香族化合物和1種酮,見表1。酸類物質是主要風味物質,檢測到的種類及含量(891.69±2.69 μg/g)均最高,其中乙酸、L-乳酸、棕櫚酸、月桂酸、癸酸和肉豆蔻酸含量均高于80 μg/g,為酸馬奶天然發酵劑主要酸類物質。酸類物質的產生主要是通過乳酸菌發酵底物中的可發酵糖。酸馬奶天然發酵劑中L-乳酸是含量最高的酸類物質,賦予酸馬奶乳的清香以及爽口的風味[14]。乙酸具有醋酸味,口感刺激,酸而不澀。辛酸和癸酸能賦予乳制品更好的奶香品質,其含量越高,對奶香味的貢獻越大[15]。可見酸類物質為天然發酵劑的刺激口感及奶香味做出了較大貢獻。
酸馬奶天然發酵劑中,酯類物質種類和總含量(477.04±9.45 μg/g)僅次于酸類物質。其中辛酸乙酯、9,12,15-十八碳三烯酸乙酯、乳酸乙酯、月桂酸乙酯、癸酸乙酯和E-11-十六碳烯酸乙酯含量高于40 μg/g,是主要的酯類物質。大多數酯類物質都具有水果和花香味,有研究發現酯類的形成高度依賴于酵母菌的存在,不同的酵母菌株可以提供形成不同的香氣,酯含量的變化也取決于其特定的真菌微生物群落[16]。
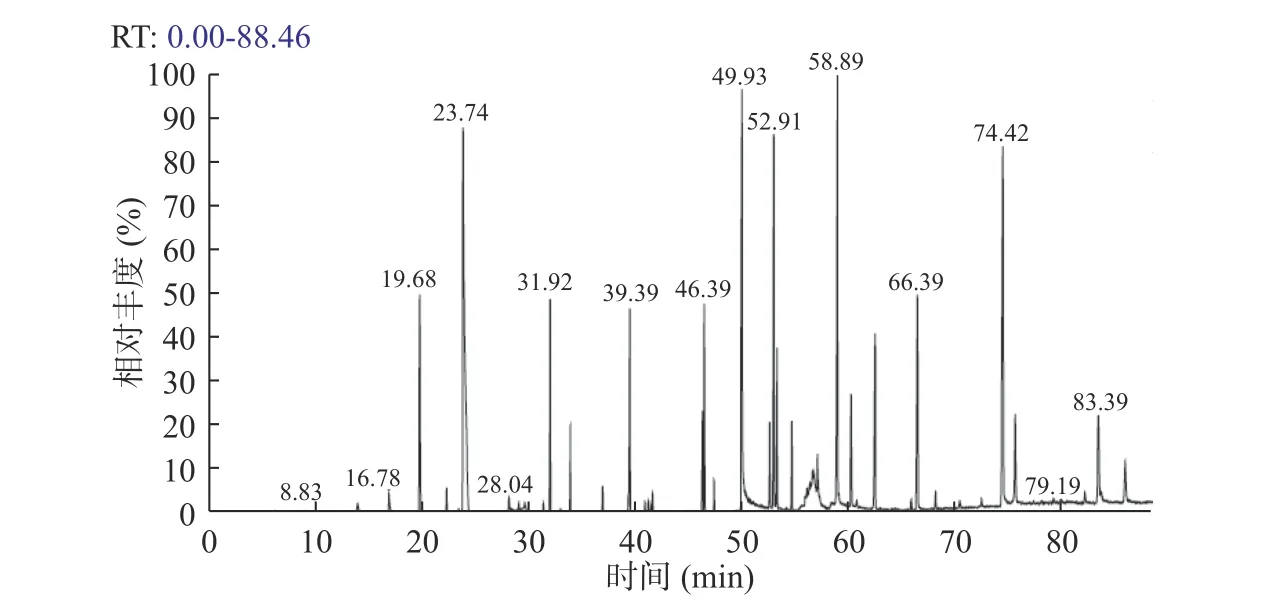
圖1 酸馬奶天然發酵劑風味物質總離子流圖Fig.1 Total ion current diagram of koumiss natural starter flavor substances
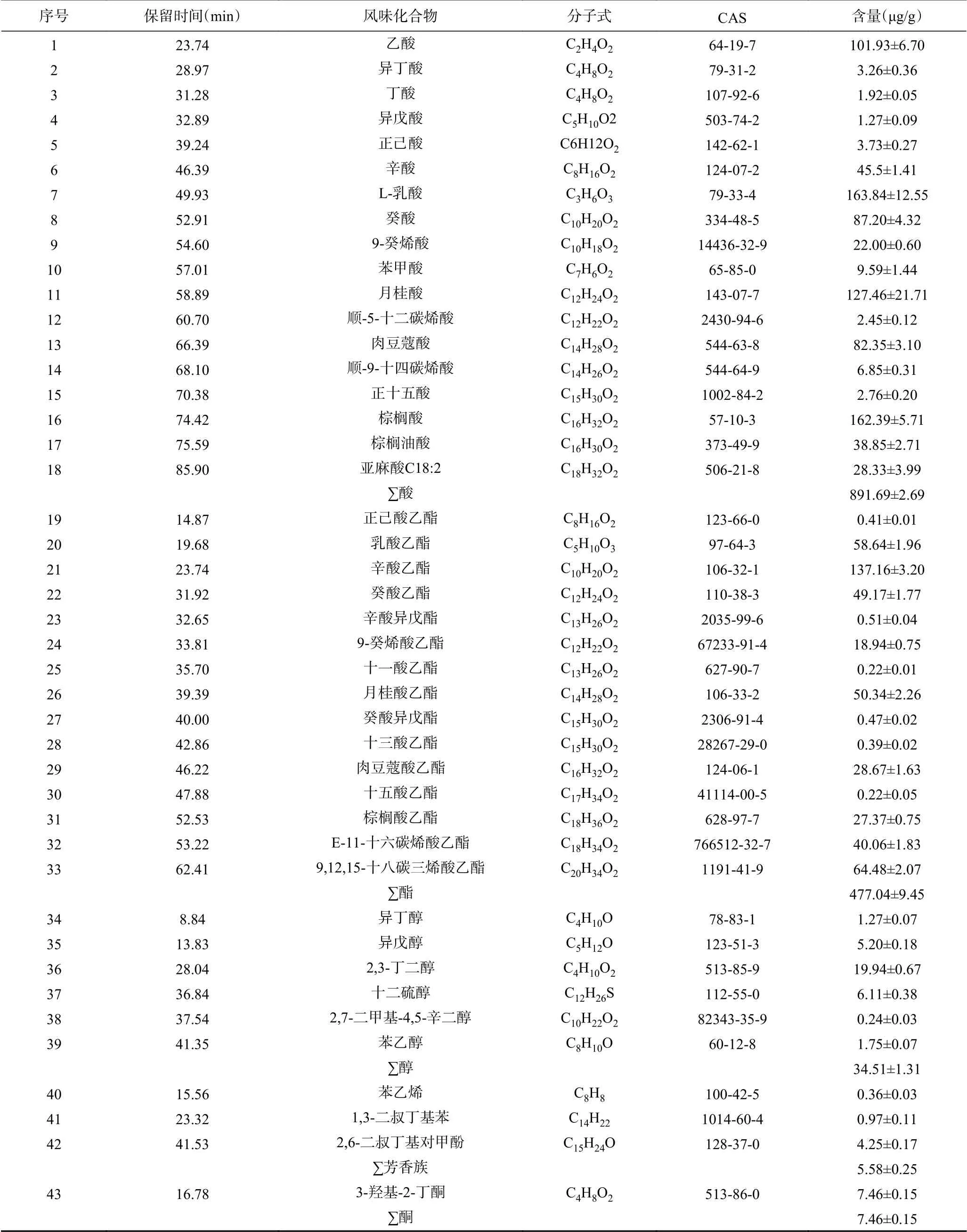
表1 酸馬奶天然發酵劑中風味物質Table 1 Flavor substances in koumiss natural starter
醇類物質是酸馬奶天然發酵劑中不可或缺的風味物質,但其風味閾值較高,因此對發酵乳的風味貢獻度較小[17]。本試驗中共檢測到6種醇類物質,其中2,3-丁二醇、十二硫醇、異戊醇、苯乙醇和異丁醇5種醇類物質含量較高。據報道,異戊醇具有水果香和雜醇味,苯乙醇具有典型的清甜的玫瑰花香[18],可見不同的醇類物質為酸馬奶復雜的風味及口感做出了一定貢獻。此外還檢測到苯乙烯、1,3-二叔丁基苯、2,6-二叔丁基對甲酚3種芳香族類和3-羥基-2-丁酮。3-羥基-2-丁酮又稱乙偶姻,是發酵乳產品中普遍存在的一種對風味有重要貢獻的酮類物質,它能夠賦予發酵乳奶香氣[19],對酸乳奶香味的增加起到決定性作用。
傳統的酸馬奶天然發酵劑大多是發酵后的酸馬奶留存下來的一部分,乳酸菌和酵母菌發酵產生的各種酶通過一系列生化過程將原料乳分解為醇、醛、酯和氨基酸等,從而形成了獨特的風味[20],可見發酵乳的風味品質與其微生物群落密切相關,因此綜合分析酸馬奶天然發酵劑的風味組成及微生物多樣性至關重要。
2.2 酸馬奶天然發酵劑中微生物多樣性分析
2.2.1 細菌和真菌序列的豐度和多樣性 通過Illumina Miseq高通量測序從3個酸馬奶天然發酵劑樣本中共獲得180069條細菌和187397條真菌高質量的優化序列,樣本的平均讀數分別為60023(SD=7028)和62466(SD=8359)。采用RDP classifier貝葉斯算法對97%相似水平下的OTU進行劃分,按最小樣本序列數進行抽平,結果表明,所有樣本細菌序列歸屬于5個門,7個綱,17個目,22個科,33個屬,49個種,52個OTU。所有樣本真菌序列歸屬于4個門,11個綱,18個目,32個科,43個屬,59個種,98個OTU。
表2是關于樣本信息及Alpha多樣性指數表,Alpha多樣性是評價微生物群落豐富性和多樣性的指標。Chao1和Ace指數用來估算測序樣本中所含OTU個數,反映群落豐富度[21]。本試驗中樣本真菌的平均Chao1指數(83.99±23.62)和Ace指數(94.51±30.44)均明顯高于細菌的Chao1指數(49.89±8.56)和Ace指數(52.75±6.59)。Simpson和Shannon指數表征群落多樣性,當Simpson指數值越小,Shannon值越大時,說明群落多樣性越高[22]。結果顯示細菌群落多樣性(Simpson指數0.52±0.06;Shannon指數1.20±0.12)高于真菌群落多樣性(Simpson指數0.84±0.05;Shannon指數0.50±0.13)。以上α多樣性指數表明該批次酸馬奶發酵劑雖然真菌物種豐富度高于細菌,但細菌的微生物群落多樣性更高。
將抽平后的細菌和真菌序列作稀釋性曲線,見圖2,稀釋性曲線趨于平緩,且隨著測序量的增大,實際觀測到的物種數不斷減小,表明測序量的合理性,但真菌稀釋性曲線中第三組樣本的實際觀測到的物種低于其余兩組,說明該組樣本的重復性略差,可能與樣品本身以及測序環境有關。細菌和真菌的Shannon-Wiener曲線趨于平坦,測序趨于飽和,結合表中樣本的Coverage值均大于99.9%,表明該測序結果能充分解釋鮮馬奶發酵劑樣品的微生物群落信息,僅有很少一部分的微生物群落未被覆蓋到。
2.2.2 細菌群落組成多形性分析 將每個OTU代表序列與Silva數據庫進行比對,結果見圖3,所有細菌序列歸屬于5個細菌門,包括厚壁菌門(Firmicutes)、變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、擬桿菌門(Bacteroidetes)和Patescibacteria。天然發酵劑的優勢細菌門為厚壁菌門,平均相對豐度87.78%,其次為變形菌門,平均相對豐度12.00%,兩個細菌門總計占整個酸馬奶引子樣本的99.78%,而其余未提及到的細菌門相對豐度較低,均在1%以下。在屬水平上共鑒定出了33個細菌屬。平均相對豐度大于1%的屬共有五個,包括乳桿菌屬(Lactobacillus)、乳球菌屬(Lactococcus)、醋酸桿菌屬(Acetobacter)、勞特菌屬(Raoultella)和鏈球菌屬(Streptococcus),總計占細菌群落的97.41%。酸馬奶天然發酵劑的群落組成中,乳桿菌屬為優勢菌屬,相對豐度最高(72.26%),其次為乳球菌屬(11.92%),這與前人的研究結果一致[23]。
乳酸桿菌、乳球菌以及鏈球菌被定義為天然發酵乳中的核心微生物群,它們的代謝終產物和酶對發酵乳的質地風味有重要的影響[24],并可以通過產生有機酸和抗生素等物質抑制腐敗菌和病原微生物的生長[25]。趙飛燕等[26]研究發現鮮馬奶中存在腸球菌屬、腸桿菌屬以及芽孢桿菌和氣單胞菌等有害微生物,可能會導致產品的質地,顏色和風味變差,也可能對消費者的健康狀況有所影響,產生嚴重的疾病。本實驗在采樣時測得酸馬奶天然發酵劑pH為3.69±0.03,滴定酸度為169.90±17.36 °T。天然發酵劑的低pH環境、乳酸菌的競爭性保護作用和特有微生物產生的抑菌物質等可以抑制有害微生物生長,提升產品的品質。
傳統乳制品酸馬奶在世界各地已有長時間的消費歷史,經過長期的自然選擇作用,優質的乳酸菌菌種已經流傳下來[27]。生產酸馬奶所添加的天然發酵劑,更是獲得優質乳酸菌的良好來源。
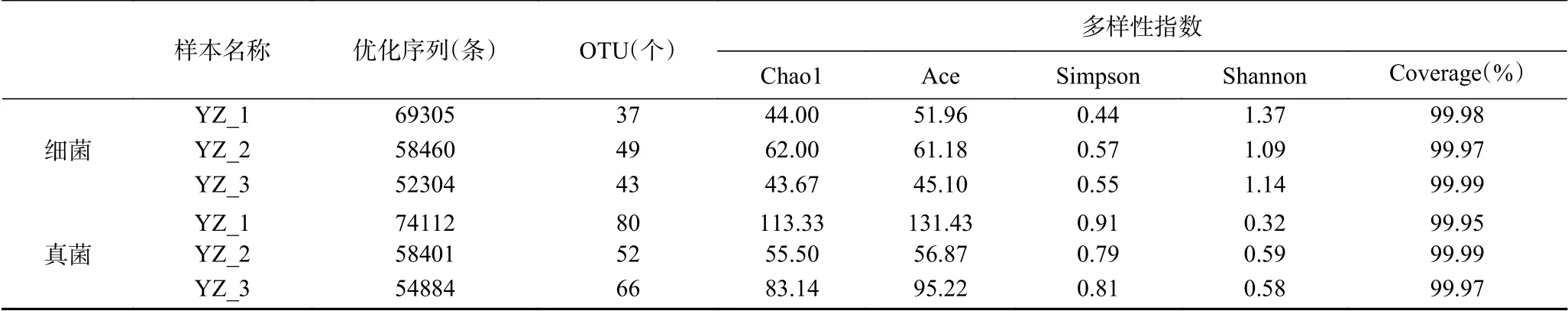
表2 樣本細菌和真菌信息及Alpha多樣性指數Table 2 Sample bacterial and fungal information and Alpha diversity index
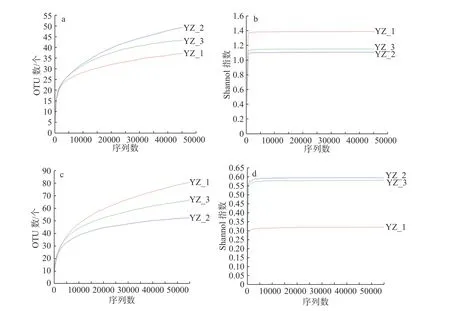
圖2 樣本的稀釋性曲線和Shannon-Wiener曲線Fig.2 Sample dilution curve and Shannon-Wiener curve
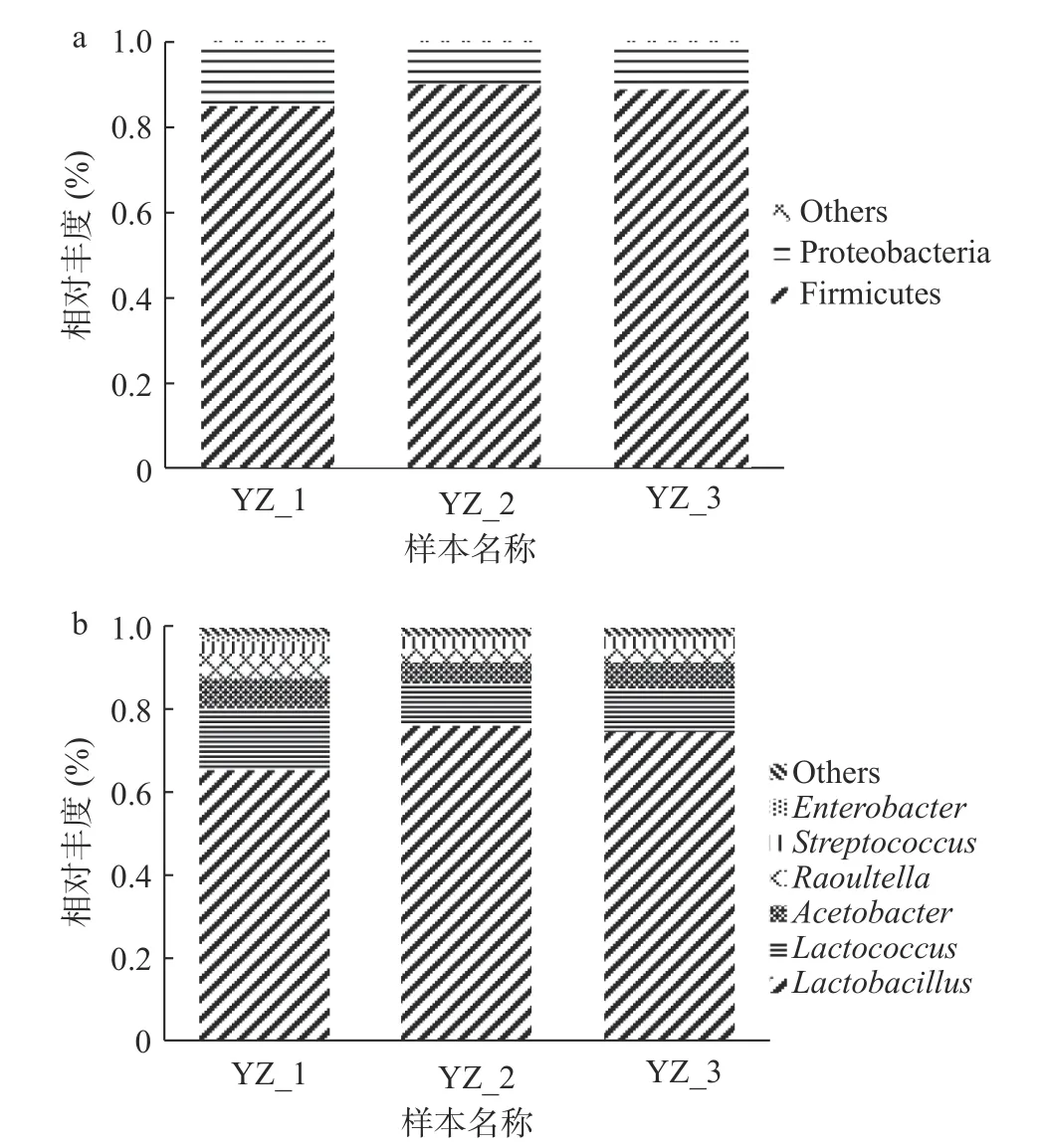
圖3 酸馬奶天然發酵劑基于門水平(a)和屬水平(b)細菌相對豐度柱狀圖Fig.3 Histogram of relative abundance of bacteria in koumiss natural starter based on phylum level (a) and genus level (b)
2.2.3 真菌群落組成多樣性分析 真菌也是酸馬奶天然發酵劑中非常重要的一類微生物區系。通過ITS序列,結果見圖4,絕對的優勢真菌被鑒定為子囊菌門(Ascomycota),相對豐度為99.32%。3個樣本共鑒定出43個真菌屬,數量明顯高于細菌屬,然而樣本平均相對豐度大于1 %的屬有2個,包括德克酵母屬(Dekkera)和克魯維酵母屬(Kluyveromyces),表明酸馬奶天然發酵劑中有很多低豐度存在的真菌微生物。德克酵母屬為優勢真菌屬,相對豐度占94.09%。
酵母菌對酸馬奶的風味、質地和營養價值有著重要的促進作用。酵母菌產生的酶分解形成脂肪酸,并進一步發生酯化反應得到具有芳香味的酯類[28],可以與乳酸菌共同分解蛋白質產生大量的氨基酸[29]等。據調查,克魯維酵母、哈薩克斯坦酵母、假絲酵母屬等是酸馬奶中經常被分離得到的酵母菌[30-32]。本試驗中天然發酵劑的優勢酵母菌種類與其他學者研究存在一定差異,分析原因可能與特定地區的氣候、草場等環境因素,和不同牧民傳統的制作方法以及所接種的發酵劑差異有關。而實際上,德克酵母屬在酸馬奶的真菌組成中也較常見,一些學者在新疆、青海、內蒙古、哈薩克斯坦、吉爾吉斯斯坦等地的酸馬奶中分離得到了德克酵母屬[33-35],只是沒有作為優勢酵母菌被發現。研究發現德克酵母可以產生醋酸氣味[36],釀酒酵母、德克酵母與克魯維酵母等在乳制品發酵過程中對水解蛋白質和脂肪、乳酸代謝、產生酒精和特殊風味有突出貢獻[37-38]。如此看來,天然發酵劑中德克酵母和克魯維酵母的存在可以為發酵酸馬奶形成典型風味起到積極促進作用。
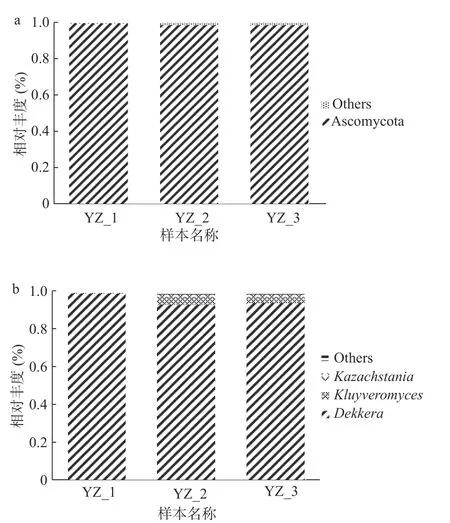
圖4 酸馬奶天然發酵劑基于門水平(a)和屬水平(b)真菌相對豐度柱狀圖Fig.4 Histogram of relative abundance of fungal in koumiss natural starter based on phylum level (a) and genus level (b)
2.3 功能預測分析
采用PICRUSt軟件對天然發酵劑中的細菌群落微生物進行功能預測。結果見表3,通過與KEGG數據庫(Kyoto encyclopedia of genes and genomes)對比,共注釋到6類一級代謝通路,代謝作用(Metabolism)、遺傳信息處理(Genetic Information Processing)和環境信息處理(Environmental Information Processing)是主要代謝通路,平均占比分別為67.97%、14.04%和8.36%。在二級代謝通路中共注釋到42個子功能組成,其中屬于上述3類一級通路且相對豐度>0.1%的子功能見表3。參與新陳代謝的菌群主要富集在碳水化合物代謝(Carbohydrate metabolism,16.24 %)、氨基酸代謝(Amino acid metabolism,8.20%)等。遺傳代謝類通路中主要富集在翻譯(Translation,5.94%)、復制和修復(Replication and repair,5.44%)以及折疊分類和降解(Folding, sorting and degradation,2.30%)。環境信息處理類通路中膜轉運(Membrane transport)和信號傳導(Signal transduction)為主要的子功能。在酸馬奶天然發酵劑中,碳水化合物代謝及氨基酸代謝作用最為突出。具體地,碳水化合物代謝主要包括三羧酸循環、糖酵解和磷酸戊糖途徑等,可產生大量的乙酸、檸檬酸等風味中間代謝產物[39]。氨基酸可以在酶的作用下產生風味成分[40],由此推測天然發酵劑中的主要風味物質來源于碳水化合物代謝和氨基酸代謝途徑。除此之外還有很多的有益功能信息,如核苷酸代謝(Nucleotide metabolism)、輔助因子和維生素代謝(Metabolism of cofactors and vitamins)、聚糖生物合成和代謝(Glycan biosynthesis and metabolism)、萜類化合物和聚酮類化合物的代謝(Metabolism of terpenoids and polyketides)等。
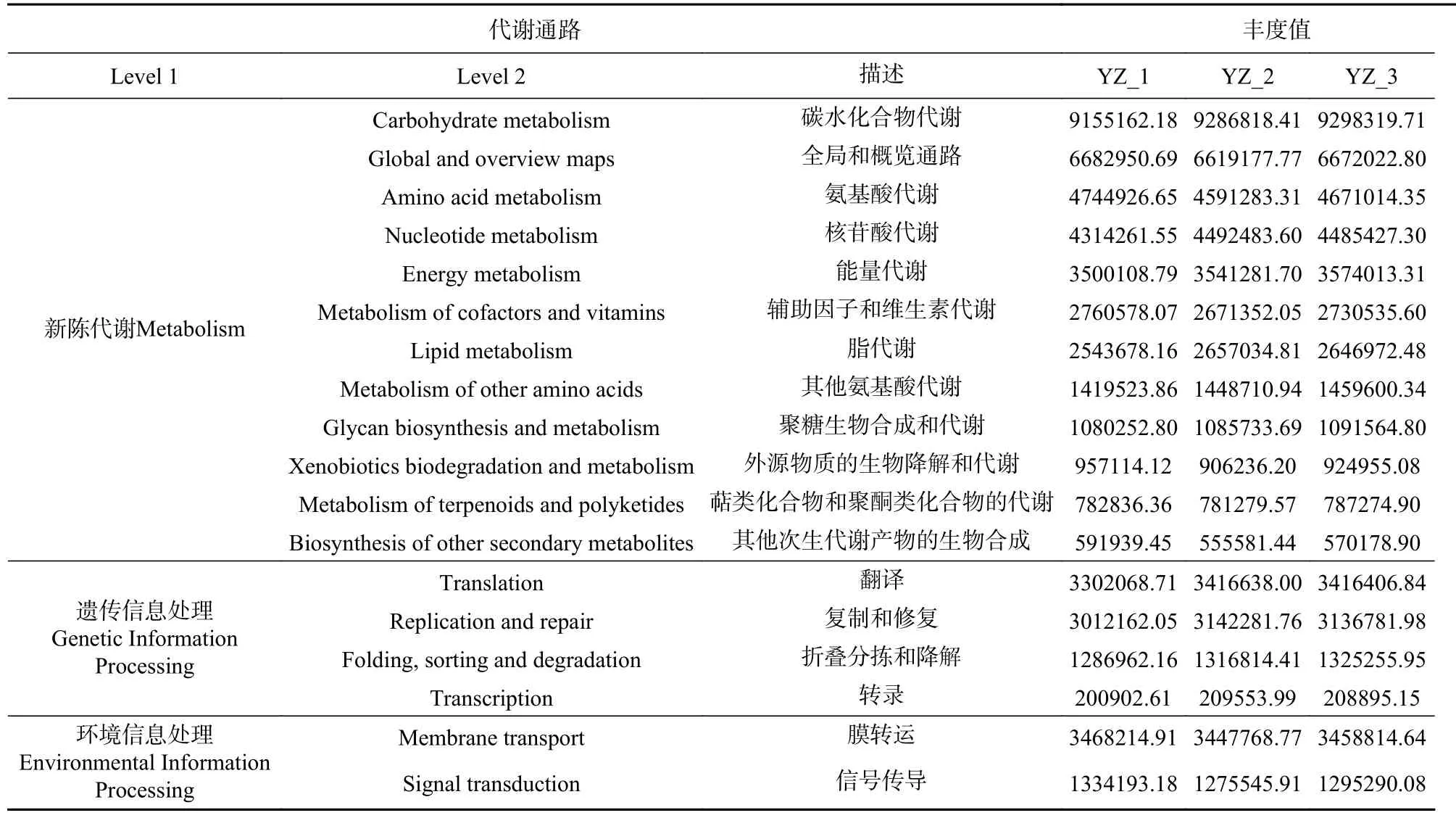
表3 KEGG數據庫主要代謝通路豐度值Table 3 Abundance of main metabolic pathways in KEGG database
經KEGG數據庫分析發現在酸馬奶天然發酵劑細菌群落中預測到1623種酶,真菌群落中預測到847種,細菌群落和真菌群落中共有568種酶相同,表4是細菌真菌中豐度平均值排前50的酶類。從表4中可以看出,除與細菌、真菌生長相關的酶外,與代謝相關的酶中參與碳水化合物代謝和氨基酸代謝的酶廣泛存在。三羧酸循環中關鍵酶琥珀酸脫氫酶(Succinate dehydrogenase)、蘋果酸脫氫酶(Malate dehydrogenase)、丙酮酸脫羧酶(Pyruvate decarboxylase)等均有發現,β-半乳糖苷酶(Betagalactosidase)和α-半乳糖苷酶(Alpha-galactosidase)屬于乳桿菌目的酶,可催化生成低聚半乳糖及半乳糖寡糖,有益于人體的健康[40]。同時,乙醇脫氫酶(Alcohol dehydrogenase)、醛脫氫酶(Aldehyde dehydrogenase)、蛋白酪氨酸磷酸酯酶(Protein-tyrosinephosphatase)、組氨酸激酶(Histidine kinase)等氨基酸代謝相關酶均存在,表明酸馬奶發酵劑中風味物質的很可能主要來源于糖代謝及氨基酸代謝,而乙酰輔酶A羧化酶(Acetyl-CoA carboxylase)、甘油激酶(Glycerol kinase)、醋酸激酶(Acetate kinase)等脂肪酶的存在說明還有一部分風味物質可能源自脂類代謝。
3 結論
本研究對錫林郭勒牧區酸馬奶天然發酵劑中的風味物質和微生物多樣性進行了測定和分析。天然發酵劑中共檢測到43種風味物質,其中L-乳酸、棕櫚酸、月桂酸、乙酸、癸酸和肉豆蔻酸是主要酸類物質,辛酸乙酯、9,12,15-十八碳三烯酸乙酯、乳酸乙酯、月桂酸乙酯、癸酸乙酯和E-11-十六碳烯酸乙酯是主要的酯類物質,2,3-丁二醇、十二硫醇、異戊醇、苯乙醇和異丁醇5種醇相對含量較高,還有少量芳香族類和酮類化合物。微生物多樣性分析表明,細菌群落主要包括乳桿菌屬、醋酸菌屬、乳球菌屬和鏈球菌屬等,其中乳桿菌屬為優勢細菌屬,相對豐度為72.26%。真菌群落主要包括德克酵母屬和克魯維酵母屬,其中德克酵母為優勢真菌屬,相對豐度94.09%。酸馬奶天然發酵劑中真菌的豐富度更高,然而細菌微生物更多樣,表明多數的真菌微生物以低豐度存在。經基因功能預測,發酵劑碳水化合物代謝及氨基酸代謝功能突出,且存在大量代謝通路中的酶基因,為酸馬奶發酵過程風味物質的形成奠定了遺傳基礎。

