長鏈非編碼RNA表達失調在糖尿病腎病發病機制中的研究進展
郭弋凡,趙文景,王夢迪,崔方強,孟元,孫雪艷,劉志強,王玉鋒,王亞偉,沈曉瓊,董晉舟
(首都醫科大學附屬北京中醫醫院腎病科,北京100010)
糖尿病腎病(diabetic nephropathy,DN)是糖尿病代謝異常引發的腎小球硬化癥,是糖尿病最常見的微血管并發癥之一,是終末期腎病的主要病因,也是導致其死亡的重要原因[1]。據報道,30%~40%的糖尿病患者逐漸發展為DN,其中約50%的DN患者進一步發展為終末期腎病,需要透析或腎移植,給患者家庭和社會帶來沉重負擔[2-3]。DN發病機制復雜,與炎癥反應、氧化應激、血流動力學改變、糖代謝紊亂、環境因素、表觀遺傳等因素有關[4-5]。目前,現代醫學對其治療主要為降壓、降糖、降脂及有效地生活調控以減少蛋白尿和延緩疾病進展,雖然血管緊張素轉換酶抑制劑和血管緊張素Ⅱ受體阻滯劑均能有效降低患者的高血壓和微量白蛋白尿,但不能有效預防蛋白尿發生,無法逆轉甚至阻止其進展為終末期腎病[6]。近年來,新型降糖藥胰高血糖素樣肽-1受體激動劑和鈉-葡萄糖協同轉運蛋白2抑制劑已在大規模隨機對照試驗中顯示出良好療效,但僅限于降低蛋白尿發生率,對腎功能保護作用有限[7-8]。因此,迫切需要尋找干預DN發生和進展的新靶點。研究表明,DNA甲基化、組蛋白翻譯后修飾、微RNA(microRNA,miRNA)和長鏈非編碼RNA(long non-coding RNA,lncRNA)等表觀遺傳因素均參與了DN的發生[9],且lncRNA異常表達通過炎癥反應、氧化應激、細胞增殖、細胞凋亡和自噬等途徑促進DN的發展,其表達異常對疾病的早期診斷和靶向治療具有重要意義,已成為近年DN領域的研究熱點[10-14]。現就lncRNA表達失調在DN發病機制中的研究進展予以綜述,以期為DN的治療和預防提供新思路。
1 lncRNA
LncRNA是一類長度超過200個核苷酸,但不具有蛋白質編碼能力的RNA,可直接與多個RNA分子或蛋白質相互作用,參與調控表觀遺傳、轉錄和轉錄后水平的基因表達[15]。LncRNA占整個哺乳動物基因組轉錄的80%[16],根據其在基因組上相對于蛋白編碼基因的位置差異可分為5類:反義lncRNA、內含子lncRNA、增強子lncRNA、雙向lncRNA及基因間lncRNA[17]。越來越多的證據表明,lncRNA是疾病狀態下各種生理和病理過程的關鍵調節因子,包括細胞增殖、凋亡和自噬[18-19];同時能參與誘導多能干細胞活化和染色質修飾[20]。此外,lncRNA亦可通過DNA甲基化、信使RNA轉錄、選擇性剪接、翻譯控制、表觀神經調節、基因組印跡和染色質修飾等方式參與不同的生物學過程[21-22]。隨著基因組學的進步,高通量測序、原位雜交技術等的不斷成熟,lncRNA已被證實在腫瘤、神經和代謝性疾病中表達失調[23-25]。雖然其在DN領域研究相對較晚,但已有諸多文獻報道lncRNA母系表達基因3(maternally expressed gene 3,MEG3)、lncRNA肺腺癌轉移相關轉錄子1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)、lncRNA生長阻滯特異性轉錄本5(growth arrest-specific transcript 5,GAS5)等異常表達參與DN的進展[10,15-16]。因此,lncRNA可能會成為未來干預DN進展的潛在靶點。
2 lncRNA異常表達參與DN的發病機制
有證據表明,lncRNA在DN病理生理過程中起重要作用。如有基因芯片發現,野生型小鼠與2型糖尿病模型小鼠中有1 746個lncRNA差異表達[26],且它們有潛在的順式作用。另有RNA序列分析顯示,與對照小鼠相比,db/db-DN小鼠中有88個lncRNA上調和68個lncRNA下調,且其中10個在羅格列酮治療后恢復了正常表達,為DN藥物開發提供了新的分子調控途徑[27]。事實上,lncRNA異常表達參與DN發生發展的各個病理過程。現對40個lncRNA在DN中的異常表達及其可能機制進行闡述,其中27個lncRNA表達上調,11個表達下調,2個(MEG3、尿路上皮癌相關基因1)表達仍有爭議,見圖1。
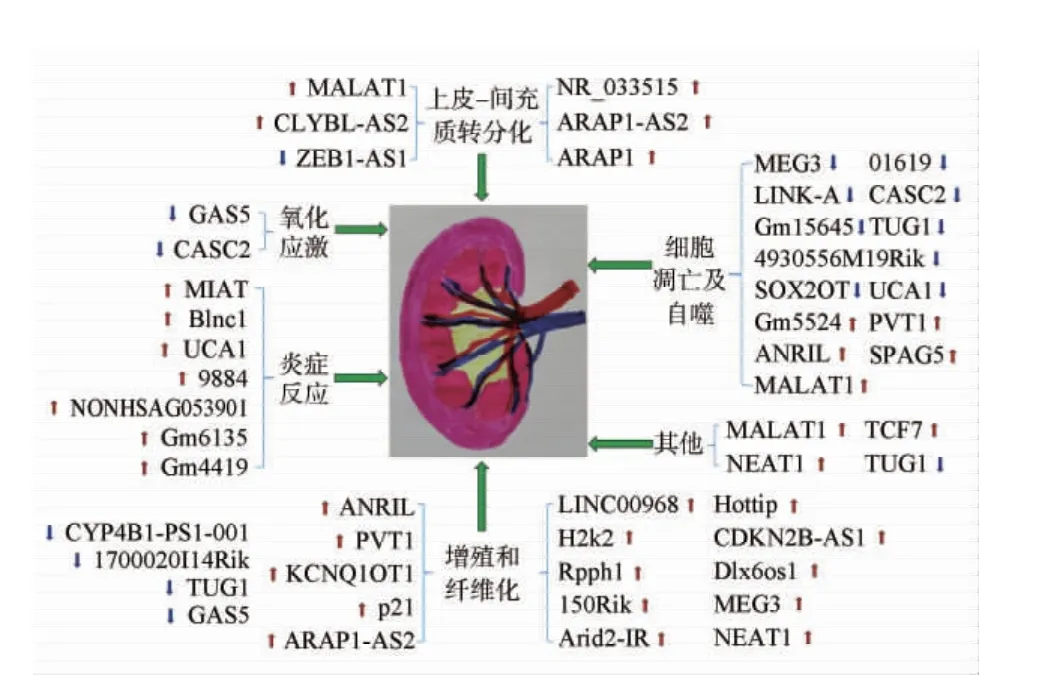
圖1 lncRNA在DN中異常表達及其參與的機制
2.1 促進DN炎癥反應的發生 炎癥反應在DN發生和進展中起重要作用,單核細胞趨化蛋白、腫瘤壞死因子-α、白細胞介素(interleukin,IL)-1β和IL-6等炎癥因子已被證實在體內外參與DN發病過程[28]。研究發現,lncRNA Blnc1水平在DN患者血清和模型大鼠中升高,抑制其表達可介導紅系衍生的核轉錄相關因子/血紅素加氧酶1和核因子κB通路顯著減輕腎臟的炎癥反應、氧化應激和纖維化[29]。Shi等[30]證實抑制lncRNA尿路上皮癌相關基因1表達可降低腫瘤壞死因子-α和IL-6的水平,減輕DN大鼠腎臟病理損傷及炎癥反應,其機制可能與抑制磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)通路有關。Zhang等[31]表明,lncRNA 9884在db/db-DN小鼠中高表達,而特異性沉默其表達可降低單核細胞趨化蛋白-1水平,抑制巨噬細胞浸潤,減輕腎臟炎癥反應。Peng等[32]研究發現,lncRNA NONHSAG053901在DN小鼠和體外系膜細胞中過表達可刺激早期生長反應因子-1(early growth response factor-1,Egr-1)/轉化生長因子-β(transforming growth factor-β,TGF-β)通路促進炎癥因子產生,介導體內外炎癥反應、纖維化和增殖的發生。此外,Ji等[33]研究證實lncRNA Gm6135作為競爭內源性RNA負調控miR-203,進而刺激Toll樣受體4表達參與DN炎癥反應。Yi等[34]研究發現,lncRNA Gm4419高表達通過核因子κB/核苷酸結合寡聚化結構域樣受體蛋白3通路參與高糖狀態下腎臟系膜細胞炎癥、增殖和纖維化。Zhang等[35]研究表明,lncRNA心肌梗死相關轉錄本在高糖誘導的足細胞中顯著表達,缺乏心肌梗死相關轉錄本可通過miR-130a-3p/Toll樣受體4誘導炎癥介質(腫瘤壞死因子-α、IL-1β和IL-6)釋放減少,從而減輕高糖誘發的足細胞炎癥反應。
以上結果表明,參與炎癥反應的lncRNA均在DN患者或小鼠中高表達,其通過誘導核因子κB、PI3K/Akt、TGF-β等通路或競爭性結合miRNA調節下游炎癥因子的表達,進而加速DN進展,因此抑制這些lncRNA表達可為DN治療提供新線索。
2.2 促進DN氧化應激 氧化應激是體內活性氧化物產生多于清除、氧化系統和抗氧化系統失衡的病理狀態,在DN過程中起重要作用[36]。已有研究表明,lncRNA GAS5在高糖誘導的人腎皮質近曲小管上皮細胞(HK-2細胞)中表達下調,其過表達可靶向miR-452-5p,進而降低腫瘤壞死因子-α、IL-6、單核細胞趨化蛋白-1及活性氧類水平,抑制HK-2細胞氧化應激和炎癥反應,為DN治療提供新思路[37]。近年研究發現,lncRNA癌易感性候選基因2在DN患者血清和高糖誘導的系膜細胞中表達減少,上調其表達可通過miR-133b/叉頭框轉錄因子O1軸抑制氧化應激、系膜細胞增殖和細胞外基質(extracellular matrix,ECM)積累,為DN的發生發展提供新機制[11]。目前,參與氧化應激的lncRNA報道較少,未來需進一步探索更多有效的調控靶點。
2.3 參與DN上皮-間充質轉化(epithelial mesenchymal transition,EMT)的發生 EMT是上皮細胞在各種理化因素作用下失去其表型特征向間充質細胞轉化的現象,是足細胞損傷的早期事件,也是DN重要的特征之一[38]。已有研究發現,在高糖條件下,lncRNA ARAP1(ArfGAP with RhoGAP domain,ankyrin repeat and PH domain 1)和lncRNA ARAP1-AS2(antisense RNA 2)在HK-2細胞中表達增加,且lncRNA ARAP1-AS2過表達加快了EMT進程,而ARAP1基因敲除可減少高糖誘導的HK-2細胞EMT和纖維化發生[39]。Gao等[40]發現,lncRNA NR_033515在DN患者血清中表達增加能降低上皮細胞標志物上皮鈣黏附分子抗體、升高間充質細胞標志物波形蛋白的表達水平,且NR_033515通過靶向miR-743b-5p調節p38、凋亡信號調節激酶1、纖維連接蛋白、α-平滑肌肌動蛋白的表達,促進細胞增殖、纖維化和EMT過程。此外,高糖可上調lncRNA MALAT1表達并激活Wnt/β聯蛋白(β-catenin)通路誘導HK-2細胞EMT[41],且能通過競爭性結合miR-145促進靶基因鋅指E盒結合蛋白(zinc finger E-box binding homeobox,ZEB)2表達誘導EMT和纖維化發生[42]。Cai等[43]研究表明,lncRNA CLYBL-AS2在DN中表達增加且與疾病嚴重程度相關,而中藥黃連可通過miR-204-5p-SNAI1軸抑制CLYBL-AS2表達,從而改善HK-2細胞EMT和纖維化。Meng等[44]證實,lncRNA ZEB1-AS1在高糖處理的HK-2細胞中表達減少,其過表達可通過調節miR-216a-5p/骨形成蛋白7軸抑制高糖誘導的EMT和纖維化。可見,EMT在DN發病機制中起關鍵作用,而lncRNA異常表達通過靶向下游信號分子的表達參與EMT發生,為DN的防治提供新思路。
2.4 通過多種通路誘導DN細胞增殖和纖維化腎小球系膜病變是DN突出的病理改變之一,在疾病早期就存在系膜細胞增殖和纖維化、ECM增多的特征[45]。Li等[14]研究發現,lncRNA LINC00968在db/db-DN小鼠腎組織和高糖誘導的系膜細胞中高表達,且通過募集Zeste同源物增強子2基因抑制p21蛋白表達,進而加速系膜細胞增殖和纖維化。Chen等[46]研究認為,lncRNA H2K2(histocompatibility 2 K region locus 2)過表達可通過miR-449a(b)/Trim11/促分裂原活化的蛋白激酶通路促進系膜細胞增殖,加速DN進展。Zhang等[47]表明,lncRNA Rpph1(ribonuclease P RNA component H1)在DN小鼠腎組織和人腎小球系膜細胞中過表達,其通過抗人半乳糖凝集素-3/促分裂原活化的蛋白激酶/胞外信號調節激酶通路促進系膜細胞增殖和炎癥反應。Zhu等[48]研究表明,lncRNA HOXA末端轉錄本反義RNA在db/db-DN小鼠和高糖處理的系膜細胞中表達上調,而HOXA末端轉錄本反義RNA基因敲除可靶向miR-455-3p/Wnt2B軸抑制系膜細胞增殖和ECM積聚。Zhang等[49]發現,lncRNA 150Rik在db/db-DN小鼠腎組織和高糖培養的系膜細胞中高表達且通過miR-451/胰島素樣生長因子1受體/p38促分裂原活化的蛋白激酶通路促進系膜細胞增殖。Yang等[50]證實,lncRNA Arid2-IR在DN小鼠腎臟中高表達,且Egr-1與基因啟動子結合上調Arid2-IR表達可促進ECM產生和腎纖維化。Li等[51]發現,DN患者血清及腎小球系膜細胞中lncRNA細胞周期蛋白依賴性激酶抑制因子2B-反義RNA表達上調,沉默其表達可通過miR-424-5p/高遷移率族蛋白2軸抑制系膜細胞增殖和ECM積累。Cheng等[52]表明高糖條件下,lncRNA Dlx6os1(distal-less homeobox 6-opposite strand 1)在小鼠系膜細胞中表達增加,抑制其表達可減少系膜細胞增殖和纖維化,增加細胞凋亡。Fang等[53]研究發現,lncRNA細胞周期激酶抑制因子4基因座中反義非編碼RNA(antisense non-coding RNA in the inhibitor of CDK4 locus,ANRIL)在DN小鼠系膜細胞中過表達,敲除ANRIL通過調節Wnt/β-catenin和分裂原活化抑制劑/胞外信號調節激酶途徑抑制DN小鼠系膜細胞增殖、纖維化。Li等[54]發現,lncRNA漿細胞瘤多樣異位基因1(plasma cytoma variant translocation gene 1,PVT1)在DN腎組織和高糖誘導的小鼠系膜細胞中高表達,沉默PVT1通過上調miR-93-5p阻斷PI3K/Akt/哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路抑制系膜細胞增殖、遷移侵襲和纖維化,促進細胞凋亡。Li等[55]研究表明,lncRNA鉀電壓門控通道亞家族Q成員1反向轉錄物1在高糖誘導的人系膜細胞中表達增加,而鉀電壓門控通道亞家族Q成員1反向轉錄物1敲除可通過調節miR-18b/高遷移率蛋白A2軸減輕系膜細胞增殖、氧化應激和ECM積累。以上研究表明,參與DN系膜細胞增殖和纖維化的lncRNA表達上調,且沉默其表達或基因敲除可抑制DN進展。
另有研究發現,lncRNA核富集轉錄體1在DN系膜細胞中高表達可靶向miR-27b-3p、多克隆抗體ZEB1及Akt/mTOR信號通路促進EMT過程,而下調其表達可抑制系膜細胞增殖、纖維化和炎癥,促進細胞凋亡[56-58]。Zhang等[59]研究認為,lncRNA-p21高表達可促進體外培養的小鼠系膜細胞增殖及ECM積累,且能通過靶向miR-18b發揮促纖維化作用。此外,lncRNA MEG3在高糖條件下過表達可靶向miR-145誘導系膜細胞增殖、纖維化和凋亡[60],又可通過miR-181a/Egr-1/Toll樣受體4軸促進系膜細胞纖維化和氧化應激[10],證實同樣的lncRNA通過不同通路參與疾病進展的可能性,為DN發病機制和潛在治療靶點提供了新見解。除參與系膜細胞增殖外,尚有研究表明lncRNA ARAP1-AS2在高糖誘導的HK-2細胞中表達顯著上調,且通過表皮生長因子受體/TGF-β/Smad3信號調節HK-2細胞增殖和纖維化,促進高糖誘導的近端小管細胞損傷[61],證實異常表達的lncRNA在腎小球系膜細胞和腎小管上皮細胞損傷中均起重要作用。
LncRNA除在高糖條件下表達上調參與細胞增殖和纖維化進程外,另有研究表明lncRNA 1700020I14Rik在系膜細胞中表達減少,其過表達通過激活miR-34a-5p/沉默信息調節因子1/缺氧誘導因子-1通路抑制系膜細胞增殖和纖維化[62]。LncRNA CYP4B1-PS1-001在DN早期顯著下調,刺激其表達可通過E3泛素連接酶Trim2調節重組人核仁蛋白泛素化和降解而抑制系膜細胞增殖和纖維化[63]。在糖尿病大鼠系膜細胞中,lncRNA牛磺酸上調基因1(taurine upregulated gene 1,TUG1)表達下調,過表達TUG1一方面通過抑制PI3K/Akt通路減少系膜細胞增殖和ECM積累減輕腎臟纖維化,另一方面通過拮抗miR-377對其靶基因過氧化物酶體增殖物激活受體γ的下調作用,抑制高糖條件下ECM積累[64-65]起到腎保護作用。LncRNA GAS5在DN患者中表達明顯減少且與DN相關并發癥的嚴重程度呈負相關,其過表達通過靶向miR-221上調沉默信息調節因子1的表達,抑制系膜細胞增殖和纖維化[66]。綜上可知,lncRNA異常表達在轉錄和轉錄后水平調節基因表達,通過不同的通路靶向下游分子蛋白誘導參與細胞增殖和纖維化,為DN發病提供新的可能機制,亦可作為疾病預后的生物標志物和治療靶點。
2.5 參與DN細胞凋亡及自噬過程 自噬和凋亡是細胞的基本過程,對維持正常組織穩態至關重要。足細胞凋亡及自噬功能障礙可導致足細胞丟失及大量蛋白尿產生,被認為是DN進展的關鍵因素[67-68]。已有研究表明,lncRNA MEG3在糖尿病小鼠中表達減少,其過表達可抑制Wnt/β-catenin通路減輕足細胞損傷[69],而MALAT1敲除亦可通過與β-catenin相互作用參與上述過程[16]。此外,Bai等[70]證實lncRNA 01619下調可介導miR-27a/叉頭框轉錄因子O1軸誘導的DN足細胞損傷和內質網應激。Yang等[12]研究發現,lncRNA LINK-A在DN患者和無并發癥的糖尿病患者中均下調,其高表達可激活缺氧誘導因子-1α而抑制小鼠足細胞凋亡。Liu等[71]發現,lncRNA PVT1在DN患者足細胞中高表達并抑制叉頭框轉錄因子O1,從而誘導足細胞損傷和凋亡。Feng等[2]證實,lncRNA Gm5524敲除和lncRNA Gm15645過表達通過調節Bcl-2/Bcl-2相關X蛋白和微管相關蛋白輕鏈3/自噬相關蛋白通路誘導DN小鼠足細胞凋亡。Yang等[72]發現,lncRNA癌易感性候選基因2在高糖處理的小鼠足細胞及DN患者血清中表達顯著降低,其過表達可能通過抑制c-Jun氨基端激酶減輕足細胞凋亡改善DN。Fan等[73]認為,lncRNA 4930556M19Rik在高糖刺激的足細胞中水平降低,其過表達通過下調miR-27a-3p、上調基質金屬蛋白酶3逆轉足細胞凋亡、纖維化和炎癥發生。
另有研究表明,在高糖處理的小鼠足細胞中lncRNA TUG1表達下調并通過介導內質網應激-C/EBP同源蛋白-過氧化物酶體增殖物激活受體共激活因子1α信號通路促進足細胞凋亡,而中藥提取物黃芪甲苷可通過上調TUG1抑制腫瘤壞死因子受體相關因子5的水平減輕足細胞損傷[74-75]。作為近年來的研究熱點之一,自噬已被證實廣泛參與DN足細胞損傷的進程。其中,lncRNA SOX2重疊轉錄本在DN小鼠和高糖誘導的人足細胞中顯著下調,其過表達通過miR-9/沉默信息調節因子1誘導足細胞自噬,減輕腎臟損傷[76]。而lncRNA精子相關抗原5在高糖處理的人足細胞中表達上調,其沉默可介導Akt/mTOR信號通路逆轉足細胞凋亡和自噬障礙,減輕足細胞損傷[13]。總之,足細胞作為人體終末分化的細胞,不具有再生能力,大多數lncRNA通過靶向各通路及其下游分子蛋白調控足細胞損傷的過程,進而干預DN進展,目前已成為研究熱點。
LncRNA異常表達除參與足細胞凋亡和自噬外,在腎小管上皮細胞及系膜細胞的凋亡過程中亦發揮重要作用。研究表明,高糖可顯著上調lncRNA ANRIL的表達并抑制miR-let-7a,從而激活TGF-β1/Smad信號通路誘導人系膜細胞凋亡[77]。而lncRNA尿路上皮癌相關基因1在高糖誘導的HK-2細胞中表達明顯減少,其過表達通過靶向miR-206抑制DN腎小管上皮細胞凋亡,可作為DN的潛在治療靶點[78]。
2.6 其他可能的機制 除通過以上機制參與DN外,lncRNA對內質網應激、線粒體功能及腎小球內皮細胞損傷、細胞焦亡等也有調控作用。研究表明,DN患者lncRNA TCF7表達上調且通過與miR-200c結合促進內質網應激加速疾病進展[79]。MALAT1可誘導甲基轉移酶G9a下游組蛋白H3第9位賴氨酸組蛋白甲基化并抑制Klotho蛋白表達,從而介導高糖誘導的腎小球內皮細胞損傷[80]。TUG1在DN小鼠足細胞中表達下調,其過表達刺激過氧化物酶體增殖物激活受體γ共激活因子α轉錄增強,進而增加線粒體含量和細胞ATP水平,使足細胞活性增加[81]。核富集轉錄體1在DN大鼠系膜細胞中顯著增加能靶向miR-34c增強炎癥小體的激活及胱天蛋白酶1依賴性細胞焦亡,并減少小鼠巨噬細胞的炎癥反應[82]。但目前參與這些機制的lncRNA尚不多見,相關研究仍處于探索階段,需反復證實并不斷揭示更多可能參與的lncRNA,從而為進一步防治DN提供可靠依據。
3 小 結
DN是嚴重的代謝紊亂過程,一旦發展至終末期腎臟病,往往較其他腎臟疾病更難治療。隨著糖尿病發病率逐年上升,預計到2045年中國糖尿病患者將達到1.19億,由此引發的DN將成為重大公共衛生問題[83]。雖然目前在新藥、先進治療策略、個體化護理等方面已取得了許多進展,但DN仍是世界范圍內腎衰竭的主要原因,也是糖尿病患者死亡率最高的并發癥之一[84]。近年來,許多研究發現lncRNA異常表達在DN發生發展中起重要作用,并在多個環節調控疾病進程[28,37,44,47,71]。在以往研究中,lncRNA通過分子間相互作用、介導信號通路和靶向miRNA表達影響DN進展,這些分子靶點的研究為疾病治療和預防提供了重要思路。然而,由于收集人體腎活檢標本困難,目前對lncRNA的研究多局限于小鼠或大鼠,且樣本量較小,今后需進行大樣本量的研究進一步驗證。此外,很多研究主要報道其中一種lncRNA表達異常的影響,未發現更多有關聯lncRNA相互作用對疾病的意義,未來需深入研究。

