全基因組關聯研究在多囊卵巢綜合征中的研究進展
馬麗娜,馬紅麗,高敬書,吳效科,張多加,王瓏
(1.黑龍江中醫藥大學,哈爾濱150040;2.黑龍江中醫藥大學附屬第一醫院a.婦科,b.針灸科,哈爾濱150040)
多囊卵巢綜合征(polycystic ovary syndrome,PCOS)是一種復雜的生殖內分泌紊亂疾病,影響全球6%~10%女性的健康[1],以亞洲和歐洲人群更常見[2]。PCOS病因復雜、分子發生機制不明。多數研究認為,遺傳和環境因素協同作用是導致PCOS發生發展的主要原因[3-6]。因此,尋找PCOS發病的遺傳和環境機制是近年的研究熱點。家系研究和雙胞胎研究均指出,PCOS具有遺傳傾向,大量的候選基因研究也證實了200余個PCOS易感基因[7-8],提示PCOS遺傳背景的復雜性。但由于PCOS復雜的病理生理過程涉及多種路徑和蛋白質,以上單一的基因診斷試驗無法闡明其遺傳病因及發病機制,故需要尋找一種更全面高效、客觀性強的遺傳學研究方法。全基因組關聯研究(genome-wide association study,GWAS)通過連鎖不平衡分析捕獲大部分基因組變異,然后利用一組具有代表性的單核苷酸多態性(single nucleotide ploymorphism,SNP)評估全基因組變異,這為復雜疾病的遺傳學研究提供了更全面、客觀的分析策略。GWAS在卵巢癌、子宮內膜異位癥、宮頸癌、子宮肌瘤等女性生殖系統損害性疾病的易感基因座識別上取得了突破性進展[9-12]。近年GWAS已被用于不同種族人群的PCOS致病基因研究。現就GWAS在PCOS中的研究進展予以綜述,以期為PCOS的遺傳生物學機制研究、精準治療提供新的見解和方向。
1 PCOS的遺傳學研究基礎
臨床上,PCOS發病呈家族聚集性,被認為具有一定的遺傳學基礎。一項PCOS家系研究的薈萃分析發現,與正常對照女性的一級親屬(父母、兄弟姐妹)相比,PCOS患者的一級親屬(父母、兄弟姐妹)出現代謝綜合征、高血壓和血脂異常的風險顯著增加[13]。另一項針對3 100多對雙胞胎進行的大規模調查問卷結果顯示[14],PCOS患病率為2.97%(92/3 100),其中單卵雙胎的PCOS患病率是雙卵雙胎的2倍,提示遺傳因素在PCOS發生中起重要作用。以上研究表明,遺傳因素與PCOS發病關系密切,但基于復雜疾病的固有特點及PCOS本身的特點家系連鎖分析等遺傳學方法作用受限,故研究者開始采用GWAS探索PCOS致病基因,即從家系、雙生子研究逐步過渡到候選基因關聯研究。
PCOS候選基因關聯研究主要是選擇可能與PCOS病理、生理相關的基因進行關聯性分析。至今,研究者已對200余個PCOS的候選基因進行了關聯研究[7-8],包括雄激素生物合成、儲備及作用相關基因(17α-羥化酶基因、雄激素受體基因、性激素結合球蛋白基因等)、性腺功能失調相關基因(黃體生成素/人絨毛膜促性腺激素受體基因、卵泡刺激素受體基因等)、代謝相關基因(胰島素基因、胰島素受體底物基因、胰島素受體基因、體脂含量和肥胖相關基因等)及慢性炎癥相關基因(白細胞介素-6基因、腫瘤壞死因子-α基因等)。由于研究的樣本量偏小(受試者少于300名)以及僅評估基因中個別變異的影響,并非調查整個基因的變異等不足和局限,大多數功能候選基因關聯性結果缺乏一致的復制。因此,對PCOS致病基因的探索不能僅局限于單基因篩查研究模式。
2 GWAS識別PCOS常見基因多態性
GWAS以應用基因組中的SNP作為分子遺傳標記,進行全基因組水平上的對照或相關性分析,并通過比較發現影響復雜性狀的基因變異、確定疾病遺傳風險因素的一種新策略。GWAS可用于2型糖尿病、肥胖、哮喘、精神疾病等具有復雜性狀疾病的研究[15-17],并可用于易感基因座的確定。目前,通過GWAS對包括中國漢族女性、韓國人和歐洲血統人群PCOS患者進行檢測的8項相關實驗檢測出20個PCOS易感位點,易感區域相關基因主要參與卵泡成熟和排卵(LHCGR、FSHR、FSHB、MAPRE1、ERBB4、SOD2)、高雄激素相關(DENND1A、ZBTB16)、胰島素信號通路(INSR、PLGRKT)、1型糖尿病(RAB5B)、2型糖尿病(THADA和HMGA2)、男性勃起功能障礙(C9orf3)、器官大小和細胞增殖控制(YAP1和SUMO1P1)、染色質重組(TOX3)、細胞周期調控(KHDRBS3)、免疫和炎癥反應(GATA4/NEIL2)、胚胎發育(KRR1)。
GWAS發現的20個易感基因中,許多在PCOS既往遺傳學研究中并未受到關注,如DENND1A、KHDRBS3、YAP1基因。DENND1A基因含有22個外顯子和DENND1A.V1、DENND1A.V2兩個轉錄體,編碼一種含DENND結構域和clathrin結合結構域的蛋白——Connecdenn1蛋白,可作為Rab35的鳥嘌呤交換因子,與clathrin及適應蛋白2結合,介導細胞內吞,參與調控蛋白質和脂質代謝。有研究表明,PCOS女性卵巢卵泡膜細胞中DENND1A.V2基因過表達,導致17α-羥化酶基因啟動子活性改變,促進雄激素合成和分泌,進而介導PCOS患者的高雄表型[18],故推測DENND1A基因對PCOS女性雄激素升高有重要影響。因此,了解上述基因及大量遺傳位點SNP的生物學功能對PCOS分子機制的研究具有重要意義,同時也是未來GWAS研究的重點。
3 基于不同種族人群的PCOS-GWAS
3.1 基于漢族人群隊列的PCOS-GWAS Chen等[19]首次將GWAS應用于PCOS遺傳學研究開展了第一個基于中國漢族女性的PCOS-GWAS,發現了3個與PCOS發病相關的易感區域:2p16.3、2p21和9q33.3,相應位點附近的風險候選基因有LHCGR、THADA和DENND1A,此研究被認為是PCOS遺傳學研究領域里程碑式的發現,且相關位點在隨后研究中亦得到了證實。一項對2 082例PCOS患者基因型-表型的研究發現,THADA、DENND1A基因區SNP可能通過代謝紊亂相關途徑在PCOS發生發展中起作用[20]。Dallel等[21]在突尼斯婦女中發現DENND1A基因rs10818854位點和rs10986105位點與PCOS發病相關。此外,Zou等[22]通過薈萃分析進一步證實,LHCGR基因變異與PCOS特異相關,推測LHCGR可用作預測PCOS風險的潛在生物標志物。
為進一步完善對PCOS遺傳因素的認識,Shi等[23]擴大樣本量開展了第二個基于漢族人群的PCOS-GWAS。此次研究在證實了第一個GWAS識別的3個位點外,又發現8個新的PCOS的易感區域,即2p16.3(FSHR基因)、9q22.32、11q22.1、12q13.2、12q14.3、16q12.1、19p13.3和20q3.2。上述研究結果為探索PCOS的遺傳因素(致病基因)提供了線索,引起學術界的廣泛關注,隨后該研究方法不斷被應用于相關研究,但并非GWAS發現的所有SNP均得到了證實。在歐洲、沙特和印度人群中已經驗證2p21(THADA)、12q14.3(HMGA2)、2p16.3(LHCGR)和9q33.3(DENND1A)與PCOS發病相關[24-26]。
3.2 基于韓國人群隊列的PCOS-GWAS 另一項基于亞洲血統的PCOS-GWAS在韓國女性中開展。Hwang等[27]的研究顯示,并未識別達到GWAS顯著性(P<10-8)的易感位點。分析原因可能是該研究樣本量相對較小,且健康對照組女性并非完全健康,其中10.5%的女性伴高雄激素血癥,導致研究結果與中國PCOSGWAS[19,23]研究結果存在差異。隨后,Lee等[28]擴大樣本量再次進行了基于韓國女性的PCOS-GWAS,結果發現了1個新的PCOS易感位點8q24.2(rs10505648,OR=0.52,P=5.46×10-8),其他微相關易感區域位于4q35.2、16p13.3、4p12、3q26.33、9q21.32、11p13和1p22[P=(5.72~6.43)×10-5]上。rs10505648位于含KH的RNA結合結構域信號轉導相關分子3(KH domain containing,RNA binding,signal transduction associated 3,KHDRBS3)基因上游,KHDRBS3基因與端粒酶活性密切相關。端粒酶是一種維持端粒長度的酶,其長度與PCOS發病、臨床表現密切相關[29-30]。故推測,KHDRBS3基因可能通過影響端粒酶活性調控端粒酶長度,進而導致PCOS發生及臨床表現的異質性。但之前基于中國PCOS人群[19,23]發現的一些位點并未在Lee等[28]研究中得到驗證,其原因可能與中國和韓國的PCOS-GWAS使用的基因分型芯片(中國研究:Affymetrix SNP 6.0芯片,韓國研究:Illumina HumanOmni1-Quar v1陣列)不同有關。
3.3 基于高加索/白種人血統人群隊列的PCOS-GWAS
為探求既往被識別的與PCOS發病相關位點[19,23,27-28]能否在歐洲人群中得到驗證,并試圖發現新的位點,歐洲學者在高加索人群和白種人中展開了PCOS-GWAS。Hayes等[31]在歐洲后裔女性中進行了大型的三階段GWAS發現并確定了與PCOS相關的3個易感基因區域:8p32.1、11p14.1(FSHB)以及9q22.32,其中,8p32.1和11p14.1(FSHB)兩個位點為新發現的位點。隨后,Hong等[32]在韓國人群隊列研究中驗證了位于FSHB基因上的SNP與PCOS發生發展密切相關,該研究進一步證實作為FSHR基因補充的FSH信號配體——FSHB基因與PCOS的發病機制相關,且與種族無關。配體(FSHB基因)和受體(FSHR基因)均增加了PCOS的患病風險,體現了神經內分泌在PCOS發病機制中的重要性。
Day等[33]基于歐洲白人鑒定了6個PCOS的易感位點,包括ERBB4/HER4、YAP1、THADA、FSHB、RAD50和KRR1,其中YAP1和THADA在既往GWAS[19,23]中已有報道;FSHB在Hayes等[31]的GWAS中也有報道,并在韓國人群[32]中得到驗證;而ERBB4/HER4、RAD50、KRR1三個位點是基于歐洲人群新發現的與PCOS發病相關的易感位點。隨后,有學者在中國漢族人群中驗證ERBB4(rs1351592)與PCOS發病的相關性,結果證實ERBB4基因與中國漢族女性PCOS發生發展密切相關[34]。故可推測,不同種族PCOS女性可能具有相似的基因結構。
3.4 其他PCOS-GWAS 一項基于歐洲血統隊列PCOS-GWAS國際薈萃分析[35],鑒定出3個新的與PCOS發病相關位點(靠近PLGRKT、ZBTB16和MAPRE1)基因。新位點變異可能參與PCOS女性胰島素信號通路、高雄激素相關和脂肪代謝及卵泡發育過程,但這3個新位點尚需在其他不同種族人群中進一步重復和驗證。以上在亞洲和歐洲女性中進行的大規模GWAS[19,23,27-28,31,33,35]已經確定了19個基因座與PCOS相關,但研究使用了不同的診斷標準及自我報告信息。雖然大多數易感位點在不同種族間得到證實,但不同研究中的病例選擇偏差和異質性客觀存在,為減少這種偏差和異質性,Zhang等[36]通過鹿特丹準則算法對電子健康記錄識別的PCOS患者和健康對照女性進行GWAS發現了1個新的PCOS發病相關位點——SOD2 rs17186366。另有研究顯示,SOD2中的A16V(rs4880)與中國漢族女性的PCOS、黃體生成素水平以及黃體生成素/卵泡刺激素比值相關[37]。SOD2基因功能及作用機制還有待進一步探索,目前通過PCOS-GWAS已發現至少20個與PCOS發生發展相關的位點,其中11個位點已在不同種族間得到了反復證實和復制,見表1。
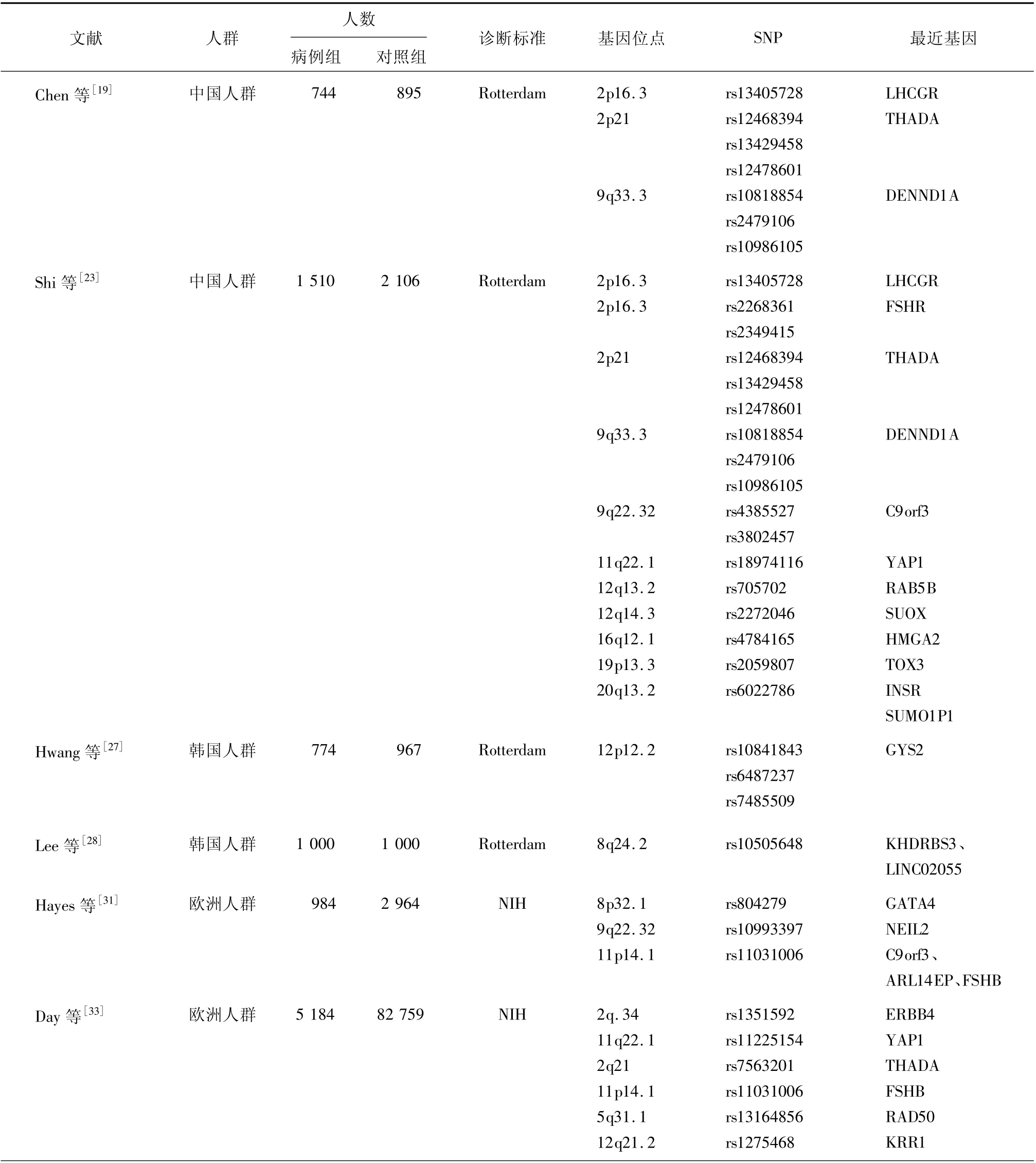
表1 PCOS-GWAS鑒定的SNP
4 GWAS的局限性
GWAS運用基因芯片技術篩選出了新的風險位點,為PCOS的生物學機制研究提供了新的方向,但仍存在一定的局限性:①GWAS發現的是易感區域(易感位點),并非致病基因,且多數易感位點并不位于已知基因的開放閱讀框,而是位于非編碼區或內含子上,給研究帶來一定困難。②GWAS能識別大量與PCOS發病相關的常見變異,但常見變異只能解釋復雜性疾病的小部分遺傳信息,并不能完全解釋疾病,進一步探討罕見變異對疾病的影響十分必要。③目前GWAS過度依賴統計學分析,較容易出現假陽性及假陰性結果,這也是不同種族隊列研究結果出現不一致或相反結論的原因之一。所以,識別致病變異和基因并了解它們在PCOS病理機制中的作用是PCOS的GWAS面臨的困難之一,即易感基因精細定位和基因功能研究,可能有助于提高人們對PCOS病因和病理機制的認識。

續表1
5 小 結
PCOS是常見的育齡女性生殖內分泌紊亂性疾病,影響人體多個系統和組織。但其確切病因、病理機制尚不清楚,嚴重影響了PCOS的診斷和精準治療。家系研究和雙胞胎研究明確了PCOS具有遺傳基礎,且大量候選基因的關聯研究也證實了200余個PCOS發病相關的易感基因,提示了PCOS遺傳背景的復雜性。GWAS運用基因芯片技術篩選出新的風險位點,至今已有20個與PCOS患病相關的易感區域被識別,為PCOS易感基因的研究奠定了基礎,極大地推動了PCOS的遺傳學研究。然而,目前有限的信息和證據尚無法全面闡釋PCOS確切的遺傳方式和分子機制。相信隨著生物技術的進步及研究的深入,PCOS病因、病理機制將逐漸清晰,從而為PCOS的精準治療提供幫助。

