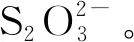海洋硫氧化菌Thiomicrorhabdus sp.B2-1的分離鑒定及氧化特性研究
陳小紅,許貽斌,鄭盛華,鄭惠東,陳月忠,陳財珍
(1.福建省水產研究所,福建 廈門 361013; 2.福建省海洋生物增養殖與高值化利用重點實驗室,福建 廈門 361013)
在近海養殖過程中,水動力條件的改變、大量餌料的投放以及強烈的生物沉降導致底質生境有機污染嚴重。在此過程中,含硫蛋白質降解和硫酸鹽異化還原導致硫化物大量產生,對養殖區生態系統的結構和功能造成嚴重危害,成為制約海水養殖業健康發展的關鍵問題之一[1-2]。因此,研究控制海水養殖環境硫化物的技術顯得尤為迫切,硫化物的生物控制具有環保、高效、持久的優點,是一種較有前景的控制技術[3]。

1 材料與方法
1.1 樣品
從福建省湄洲灣近海養殖區采集沉積物樣品,用于菌種分離。
1.2 培養基
選擇性培養基:蒸餾水1 L,121℃滅菌15 min,加入過濾除菌的Na2S·5H2O(終濃度1 g/L)。
基礎培養基[14]:MgSO4·7H2O 0.1 g、Na2S2O3·5H2O 5 g(由于Na2S·5H2O極易被氧化,影響實驗準確,故選擇Na2S2O3·5H2O替代)、K2HPO42 g、(NH4)2SO40.1 g、CaCl2·2H2O 0.1 g、FeSO4·7H2O 0.02 g、陳海水1 L,121℃滅菌15 min,用1 mol/L無菌HCl/NaOH調節pH至8.0。固體培養基在基礎培養基基礎上加15 g瓊脂粉。
1.3 硫氧化菌的分離與純化
取50 g沉積物樣品于500 mL無菌三角瓶中,加入滅菌陳海水100 mL,在28℃、150 r/min進行搖瓶富集培養,每隔2天加1 mL選擇性培養基到三角瓶中。20 d后將富集液按不同稀釋梯度涂布于固體基礎培養基上,28℃培養4 d。挑選優勢菌落連續平板劃線分離,純化培養優勢菌株,菌種保藏于4℃冰箱中備用。
1.4 菌株形態學與生理生化鑒定
將分離得到的菌株在固體基礎培養基上培養,觀察菌落形態。細菌革蘭氏染色和生理生化特性實驗參照北京陸橋生化試劑盒說明書進行。細菌的細胞形態及大小通過日本電子JEM-123透射電鏡觀測。
1.5 菌株分子生物學鑒定
將篩選得到的菌株保存平板送交生工生物工程(上海)股份有限公司進行16S rRNA基因序列分析鑒定。前端引物和后端引物分別為27F(5’-AGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)。25.0 μL擴增體系:基因組DNA 0.5 μL、10×Buffer 2.5 μL、Taq聚合酶0.2 μL、dNTP 1.0 μL、27F引物0.5 μL、1492R引物0.5 μL,加dd H2O 至25.0 μL。反應條件:94℃4 min,94℃45 s,55℃ 45 s,72℃ 60 s,共30個循環;72℃10 min。使用測序儀ABI3730XL進行DNA測序。
將測定所得到的序列提交到GenBank,并利用NCBI 的BLAST軟件進行同源性比對。使用MEGA 7.0軟件,運用Kimura 2-parameter Distance模型,將比對所得序列與相關菌株序列構建Neighbor-Joining系統發育樹[15]。
1.6 氧化特性
1.6.1 種子液的制備
將菌種接種于盛有150 mL基礎培養基的三角瓶中,于28℃、150 r/min搖床培養48 h,此時培養液pH降至6左右,作為種子液備用。
1.6.2 不同初始pH對菌株B2-1氧化硫代硫酸鹽的影響
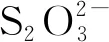
1.6.3 不同溫度對菌株B2-1氧化硫代硫酸鹽的影響
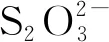
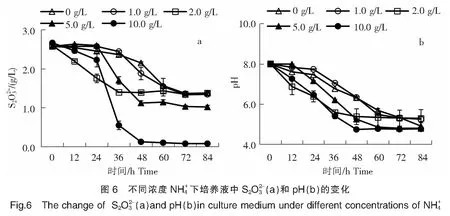
1.6.4 不同濃度Mg2+對菌株B2-1氧化硫代硫酸鹽的影響
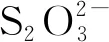
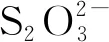
1.7 分析方法
pH值采用Multi 3430多參數分析儀測定。
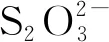
數據分析:應用Excel軟件及SPSS 22軟件對所得數據進行單因素方差分析(One-way ANOVA)和多重比較(LSD)。
2 結果
2.1 優勢硫氧化菌的分離及其形態特征
將富集液稀釋、涂布于基礎培養基平板,28℃培養4 d后觀察到平板菌落形態一致,均為白色圓形菌落。同時觀察到菌落周圍出現透明溶解圈,說明菌株具有氧化硫代硫酸鹽并導致培養基酸化的能力。隨機挑取一株作為優勢菌并命名為B2-1。在固體基礎培養基上,菌株B2-1菌落呈圓形、直徑約1 mm、乳白色、中間凸起、濕潤易挑取(圖1-a)。
透射電鏡照片(圖1-b)顯示,菌株B2-1是短桿狀細菌,菌體大小為0.92 μm×2.03 μm,帶極生鞭毛。生理生化實驗結果(表1),菌株B2-1為革蘭氏陰性,不能利用葡萄糖、乳糖、蔗糖、甘露醇等有機物進行異養生長。同時預實驗表明,菌株不能在有機培養基上生長,在基礎培養基中添加不同碳源(如葡萄糖、蛋白胨、酵母提取物等)也不能促進菌株的生長,推測該菌株為化能無機自養型。

注:a.菌株B2-1菌落圖;b.單細胞TEM圖(Bar,1 μm)。

表1 菌株B2-1生理生化實驗結果
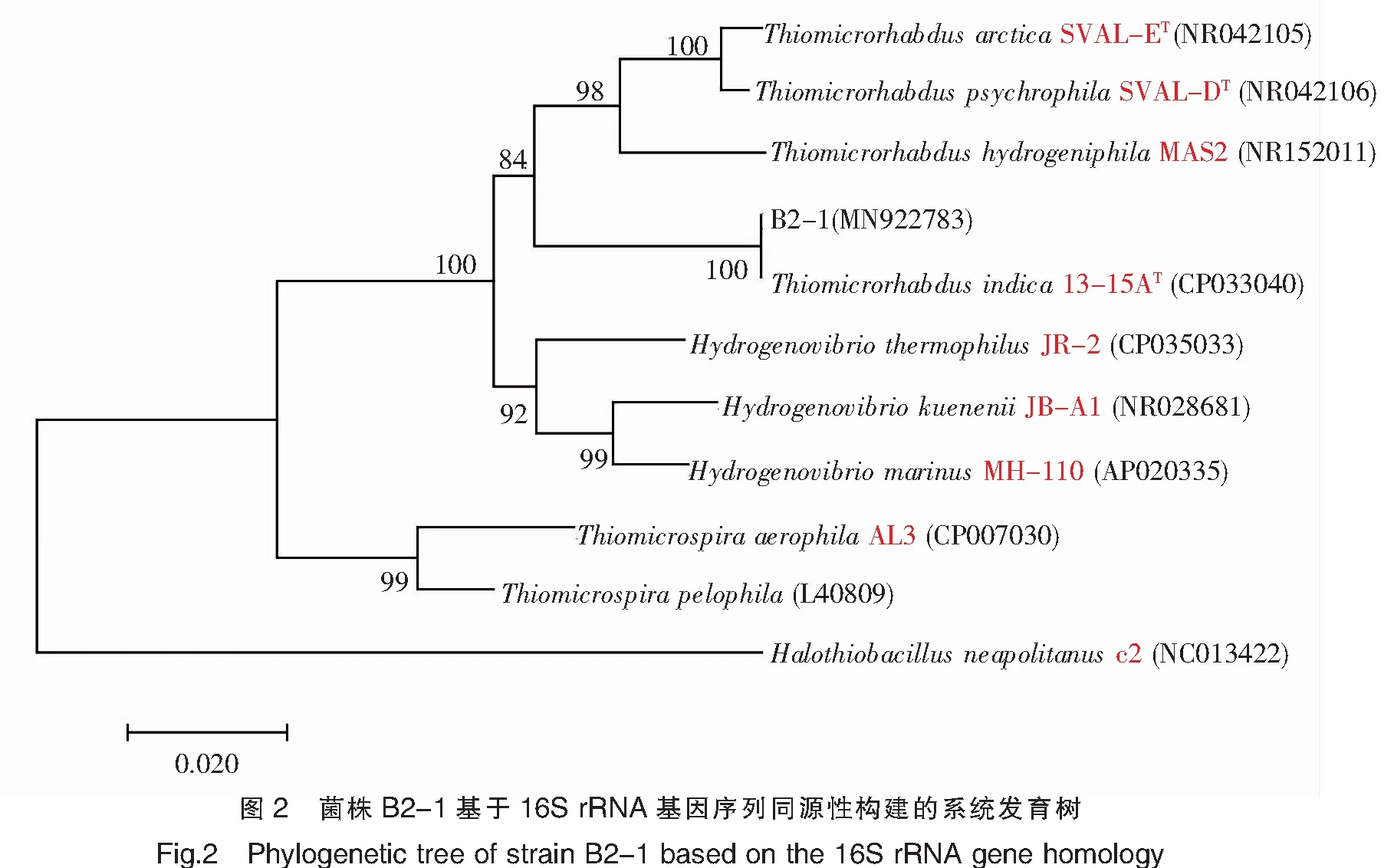
2.2 菌株16S rRNA序列分析及其系統發育樹建立
對菌株B2-1的16S rRNA基因(1 475 bp)進行測序,在GenBank中獲得序列登錄號為MN922783。經過序列比對發現,菌株B2-1與最相似的菌株Thiomicrorhabdusindica13-15AT(CP033040)同源性為100%,且系統發育樹顯示這兩株菌聚類在同一枝上,與硫微桿菌屬(Thiomicrorhabdus)的其他種在同一個大的分枝(圖2)。結合菌株的形態學特征,將菌株B2-1鑒定為Thiomicrorhabdussp.B2-1。
2.3 氧化特性
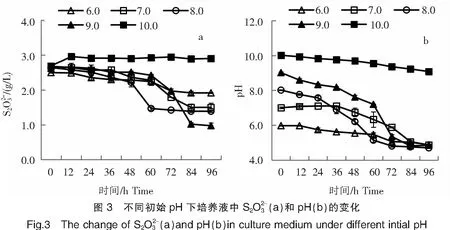
2.3.1 不同初始pH對菌株B2-1氧化硫代硫酸鹽的影響
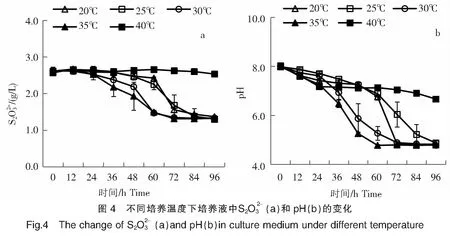
2.3.2 不同溫度對菌株B2-1氧化硫代硫酸鹽的影響
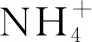
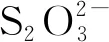
2.3.3 不同濃度Mg2+對菌株B2-1氧化硫代硫酸鹽的影響
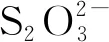
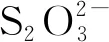

3 討論
菌株B2-1在形態學特征上與伯杰氏細菌鑒定手冊(第九版)中硫微螺菌屬的特征描述較為相似,并且實驗過程中發現,菌株B2-1存活期較短,在4°C保存2周以上,會因培養基酸化出現不可逆的生長抑制。Boden R等[20]在2017年將硫微螺菌屬重新分類,提出硫微桿菌屬(Thiomicrorhabdus),并列出該屬包含5個正式發表的種,分別為T.frisia、T.chilensis、T.arctica、T.psychrophila、T.hydrogeniphila。近兩年陸續有發現硫微桿菌屬新種的研究報道,如2019年Kojima H等[21]從日本湖泊水分離得到一株硫氧化菌,命名為Thiomicrorhabdusaquaedulcis;2020年Liu X W等[22]從印度洋深海熱液區分離得到一株專性化能自養型的硫氧化菌,命名為Thiomicrorhabdusindica13-15AT。本實驗得到的菌株B2-1和Thiomicrorhabdusindica13-15AT同源性達100%,同時結合其形態特征及生理生化特征,初步鑒定該菌為Thiomicrorhabdussp.B2-1。
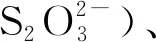
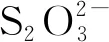
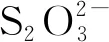
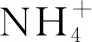
通過合理調節硫氧化菌與環境因子之間的作用關系,不但可以持續控制沉積物中硫化物的產生,還有益于生態系統的健康發展,是受損生境生態修復法的重要研究方向[28]。因此,在應用硫氧化菌進行海洋養殖環境修復之前,仍需獲得更多的菌株資源,并對其氧化特性、氧化機制、固定化技術等方面進行深入的研究探索。
4 結論
1)從近海養殖區沉積物中分離篩選得到一株硫氧化菌Thiomicrorhabdussp.B2-1。