瑞格列奈滴丸制備及體內外評價
王苗苗章一吳桐李海鷹楊文智
(1.保定市第一中心醫院 藥劑科,河北 保定 071000;2.河北大學 藥學院,河北 保定 071002)
滴丸采用固體分散技術,將藥物與基質熔融后,滴入與之無相互作用和不相混溶的冷凝液中,收縮冷凝而成的球狀固體制劑[1],具有服用劑量少、崩解快、溶出迅速的特點,可用于制備小劑量難溶藥物的劑型[2].滴丸基質對藥物起到潤濕、增溶、防止聚集和抑制結晶的作用,藥物以分子、微晶或膠體狀態存在于基質中使藥物分散的總表面積增大,改善難溶性藥物的溶解度、溶出度和吸收速率,從而提高藥物的生物利用度[3].例如,以聚乙二醇6000(PEG-6000)為基質,制備番茄紅素滴丸,可提高番茄紅素的生物利用度[4];利用固體分散技術制備復方丹參滴丸,可降低冰片的用量,提高藥物生物利用度并減輕冰片對患者的胃腸刺激[5].水飛薊素滴丸劑,不僅改善水飛薊素溶解度,還促使多種中藥成分同步釋放[6].此外,文獻采用固體分散技術,制備對乙酰氨基酚-聚乙二醇6000基質栓劑,同樣使得難溶藥物獲得良好的體內生物利用度[7].近年,隨著固體分散技術、滴丸制備工藝與新輔料的發展,滴丸劑開發日益受到研究者的重視[8].本研究采用自制瑞格列奈-精氨酸(RPG-Arg)復合物凍干粉,制備了RPG-Arg復合物滴丸并對照瑞格列奈原藥滴丸,通過滴丸的物理表征、藥物體外溶出和大鼠體內藥代動力學評價,探討瑞格列奈滴丸劑型制備的可行性.
1 實驗部分
1.1 儀器與試劑
LGJ-18冷凍干燥機(北京松源華興發展有限公司);FTIR-8400s傅里葉變換紅外分光光度計(日本島津儀器公司);T6 型紫外可見分光光度計(北京普析通用儀器有限公司);X 線粉末衍射儀(D8ADVACE)(Bruker/Switzerland);LC3000型高效液相色譜儀(北京創新通恒科技有限公司).
瑞格列奈(湖北康寶泰精細化工有限公司);精氨酸(國藥集團化學試劑有限公司);PEG-4000和PEG-6000(天津市科密歐化學試劑有限公司);RPG-Arg復合物粉末(實驗室自制);液體石蠟(天津市科密歐化學試劑有限公司);其余試劑均為分析純.
Wistar大鼠(150~200 g),由河北省實驗動物中心提供.
1.2 實驗方法
1.2.1 RPG-Arg復合物凍干粉的制備
按物質的量比為2∶3分別稱取瑞格列奈與精氨酸,混合于20 m L蒸餾水中,將溶液的p H 調至8,40℃水浴加熱攪拌30 min,直至混合物完全溶解.將復合物溶液置于4℃過夜保存,在(-58±1)℃和5 Pa的壓力下冷凍干燥24 h,得到RPG-Arg 復合物凍干粉.
1.2.2 滴丸基質的篩選
初步擬定瑞格列奈滴丸的規格為1 mg/丸,每丸質量30 mg,確定藥物與基質質量比為1∶29.選用水溶性基質PEG-4000、PEG-6000和二者的混合物[m(PEG-4000)∶m(PEG-6000)為4∶1、4∶2、4∶3、1∶1、4∶5、4∶6]制備滴丸.參照《中華人民共和國藥典》(2015版)中滴丸項下規定方法,以滴丸的溶散時間、丸質量差異、某一時間點的累計釋放度為評價指標,優選制備處方.
1.2.3 滴丸的制備
按處方稱取PEG-4000和PEG-6000適量,熔融混均后分別加入瑞格列奈和RPG-Arg復合物粉末,攪拌混勻,保持藥液溫度為80℃,控制滴距4 cm,滴入冷卻高度為40 cm,4℃的石蠟冷凝液中,靜置30 min取出滴丸,濾紙濾干,即得.
1.2.4 滴丸表征
DSC分析:分別稱取瑞格列奈原料藥、精氨酸、處方比例物理混合物、滴丸空白基質、粉碎后的自制瑞格列奈滴丸以及RPG-Arg復合物滴丸適量,稱取3~5 mg樣品置于鋁鍋中,在50 m L/min的氮氣流保護,40~300℃的溫度掃描條件下,以10℃/min的速率加熱樣品,得到各樣品的DSC圖譜.
FTIR 分析:測定瑞格列奈、精氨酸、滴丸空白基質(PEG-4000,PEG-6000)、滴丸制備比例的物理混合物、瑞格列奈原藥滴丸、RPG-Arg復合物滴丸的紅外光譜,分別稱取各樣品2 mg至研缽中,與溴化鉀混合均勻,研磨,壓片,在400~4 000 cm-1處檢測并記錄圖譜.
1.2.5 體外溶出度實驗
采用《中華人民共和國藥典》(2015版)溶出度測定法中第三法(小杯法)進行滴丸的體外溶出實驗.選擇200 m L的磷酸鹽緩沖液為溶出介質,調節轉速至100 r/min,精密稱取原料藥滴丸和RPG-Arg復合物滴丸適量于杯中,分別在5、10、15和30 min后取樣10 mL,同時補充同等條件的空白緩沖液10 m L,0.45μm 微孔濾膜過濾,采用UV測定2種滴丸中藥物的質量濃度,檢測波長282 nm,基質不干擾藥物測定,瑞格列奈標準曲線為y=0.009 5x-0.001 7(R=0.999),線性為0.1~10μg/mL,按照公式(1)計算藥物的累積釋放率(Q).

ρn為第n次取樣時樣品中的藥物質量濃度,μg/m L;V為釋放介質總體積,m L;Vi為每次取樣的緩沖介質體積,m L;ρi為 每次取樣時的藥物質量濃度,μg/m L;W0為滴丸中藥物的質量濃度,μg/m L.
1.2.6 鼠體內藥代動力學評價
用肝素處理過的EP管收集大鼠眼眶血,12 000 r/min離心10 min,取血漿,備用.移取大鼠空白血漿180μL分別置于8個EP管中,分別加入500、250、100、50、10、1、0.1μg/m L的瑞格列奈藥物溶液20μL,不加藥物的為空白血樣.渦旋震蕩2 min,使藥物與血漿充分混合.加入有機相0.5 m L[V(三氯甲烷)∶V(甲醇)=4∶1]渦旋震蕩5 min,使之充分萃取瑞格列奈藥物,將樣品12 000 r/min離心10 min,取下層澄清的萃取液,并通過0.22μm 的微孔濾膜進行過濾,室溫氮氣吹干,取100μL 甲醇復溶,3 000 r/min 離心5 min,取20μL樣品HPLC進樣檢測瑞格列奈的血藥質量濃度.采用Hypersil BDS C18色譜柱(46 mm×250 mm,5μm),流動相V(CH3OH)∶V(0.02 mol/L NH4H2PO4)=7∶3,調p H至2.5,1 m L/min流速,檢測波長282 nm.峰面積(y)對血漿藥物質量濃度(x,μg·m L-1)進行線性回歸,標準曲線方程為y=8 768x-1.32×104(n=7,R=0.997),0.01~50μg/m L內線性關系良好.取已禁食12 h,自由飲水的健康Wistar大鼠6只,隨機分成2組,按10 mg/kg藥物劑量給2組大鼠分別口服灌胃原料藥滴丸和RPG-Arg復合物滴丸組.于0.083、0.25、0.5、1,2、4,6、8、12、24、36、48 h大鼠眼眶取血0.5 m L,置于含有肝素鈉的EP管中,離心,-20℃凍存,按照上述方法處理樣品后,采用HPLC法測定藥物質量濃度,繪制藥時曲線.
2 結果與討論
2.1 滴丸處方的篩選
在滴丸制備過程中,由單一的PEG-4000或PEG-6000為基質制備的滴丸過軟或過硬,滴制藥液黏稠,不易成形,所以選擇混合一定比例的PEG-4000和PEG-6000基質進行考察,滴丸的溶散時限和質量差異結果見表1.由表1可知:各組滴丸均在10 min內溶散完全,每組滴丸的質量變異系數均小于±5%,均符合《中華人民共和國藥典》(2015版)相關規定,其中m(PEG-4000)∶m(PEG-6000)=4∶1時,制備的滴丸評價效果較好.
不同基質比例的RPG-Arg復合物滴丸的溶出曲線如圖1所示,所有滴丸均在30 min內溶出.當滴丸基質質量比4∶1時,藥物溶出速度最快,累積釋放最佳,在10 min累積釋放80%,而其他比例滴丸僅釋放60%~70%.因此選擇m(PEG-4000)∶m(PEG-6000)=4∶1為制備滴丸的質量比例.

表1 不同基質質量比的滴丸溶散時限和質量差異Tab.1 Dissolution time and weight difference of dropping pills with different matrix ratios
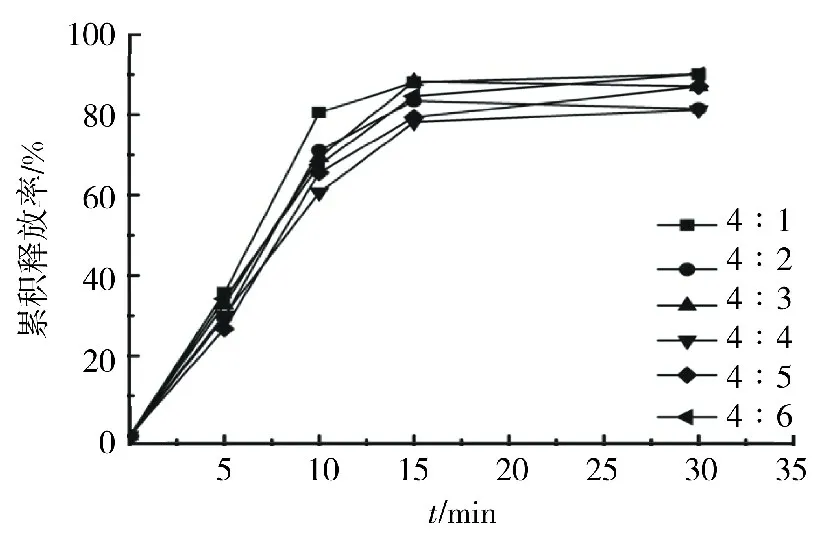
圖1 不同基質質量比RPG-Arg復合物滴丸的體外溶出曲線Fig.1 Dissolution profiles of RPG-Arg complex dropping pills with different matrix ratios in vitro
2.2 滴丸的物理表征
RPG-Arg和RPG 2種不同滴丸的DSC曲線見圖2.瑞格列奈(圖2a)在135℃處出現吸熱熔融峰[9],藥物與PEG 基質的物理混合物(圖2c),在71℃出現與PEG 基質(圖2b)相同吸收峰.而瑞格列奈滴丸DSC曲線中(圖2d),熔融峰偏移至75℃,且瑞格列奈的晶體特征峰消失,推測滴丸中藥物轉化為非晶型,以無定型態存在.在RPG-Arg復合物滴丸DSC 圖譜中,精氨酸(圖2e)在225℃和243℃處出現其晶體的特征熔融峰,物理混合物(圖2f)樣品與RPG-Arg復合物滴丸(圖2g)獲得相似的DSC圖譜,推測RPG-Arg凍干粉質量在滴丸質量中占比小,故瑞格列奈藥物和精氨酸的DSC特征峰極弱,DSC圖譜中藥物和精氨酸熔融峰均消失.相比71℃PEG 基質DSC 特征吸熱峰,物理混合樣品(圖2f)和RPG-Arg復合物滴丸(圖2g)的DSC圖譜的吸熱峰偏移至67℃,推測藥物與富含羥基的PEG 基質或富含氨基的精氨酸混合,利于分子間氫鍵的生成,促使藥物結晶態改變,利于轉化為無定型態.綜上,瑞格列奈滴丸和RPG-Arg復合物滴丸,藥物與PEG 基質均可形成氫鍵,利于其固體分散體形式的滴丸劑制備[10].
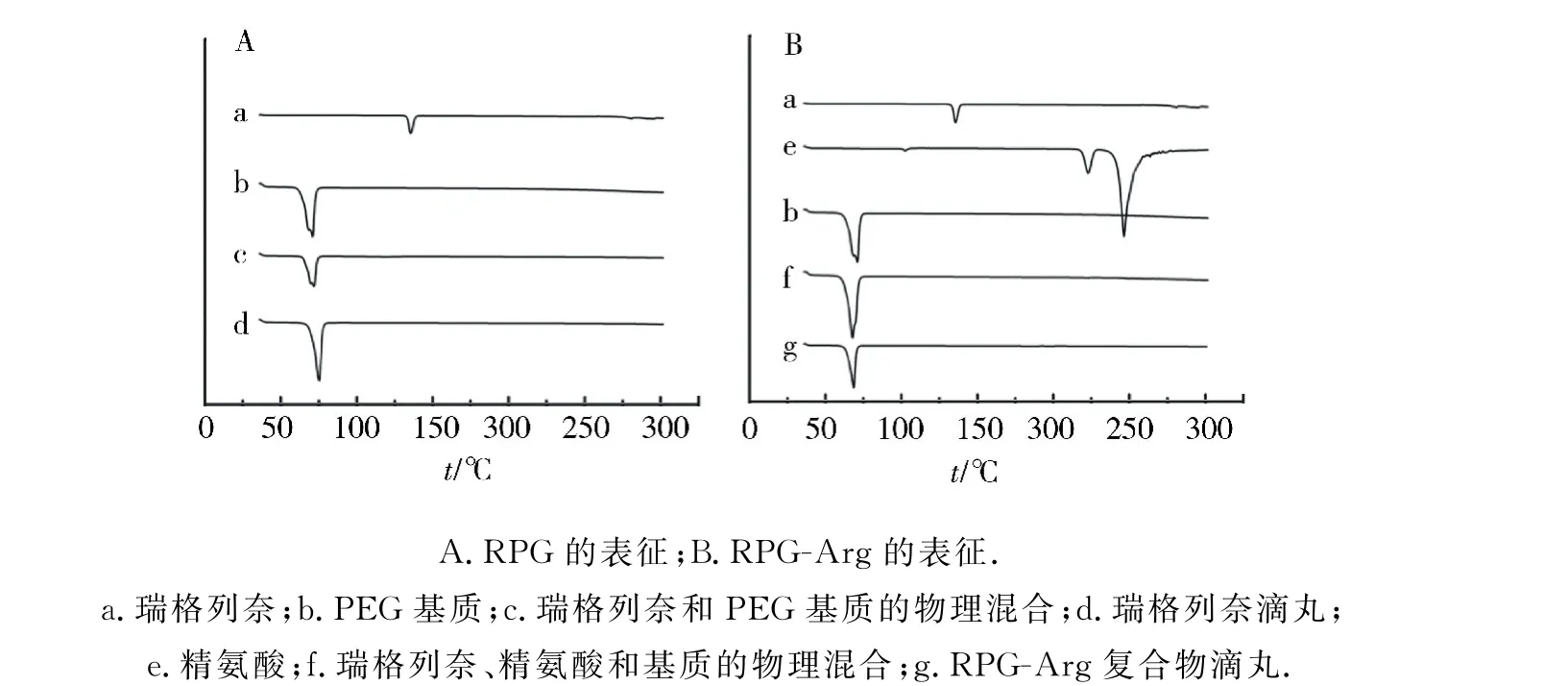
圖2 滴丸的DSC圖譜Fig.2 DSC thermograms of dropping pills
2種不同滴丸制劑的FTIR 圖譜如圖3所示.瑞格列奈(圖3a)在3 308 cm-1和1 687 cm-1處為其分子上氨基和羰基的特征吸收峰[11].對比空白基質(圖3b),瑞格列奈和空白基質的物理混合(圖3c)圖譜中,藥物氨基和羰基與富含羥基的PEG 基質相互作用,特征峰發生紅移.而在瑞格列奈滴丸(圖3d)紅外圖譜中藥物氨基和羰基特征峰強度明顯減弱,藥物分子與PEG 分子間氫鍵作用,抑制瑞格列奈晶體形成,推測藥物以無定型狀態存在.在RPG-Arg復合物滴丸表征譜圖中,精氨酸(圖3e)在3 296 cm-1和3 072 cm-1處的特征吸收峰為分子中氨基和羧基,形成分子內氫鍵,而1 685 cm-1處是羰基的特征吸收峰.相比空白PEG 基質(圖3b),物理混合(圖3f)和RPG-Arg復合物滴丸(圖3g)圖譜中精氨酸分子內氫鍵特征峰消失,瑞格列奈(圖3a)的3 308 cm-1氨基吸收峰變寬且發生遷移,而1 687 cm-1羰基特征峰消失,即藥物與精氨酸的特征峰基本消失,說明RPG-Arg復合物滴丸中藥物、精氨酸和基質間存在強氫鍵作用,促使藥物在PEG 基質中以無定型態均勻分散.而RPG-Arg復合物制備,可使藥物與精氨酸先充分形成無定型態,與PEG 基質熔融混均,驟冷后成丸,此工藝比簡單物理混合(圖3f),更利于藥物以無定型態分散.紅外測試的結果與DSC結果相一致.
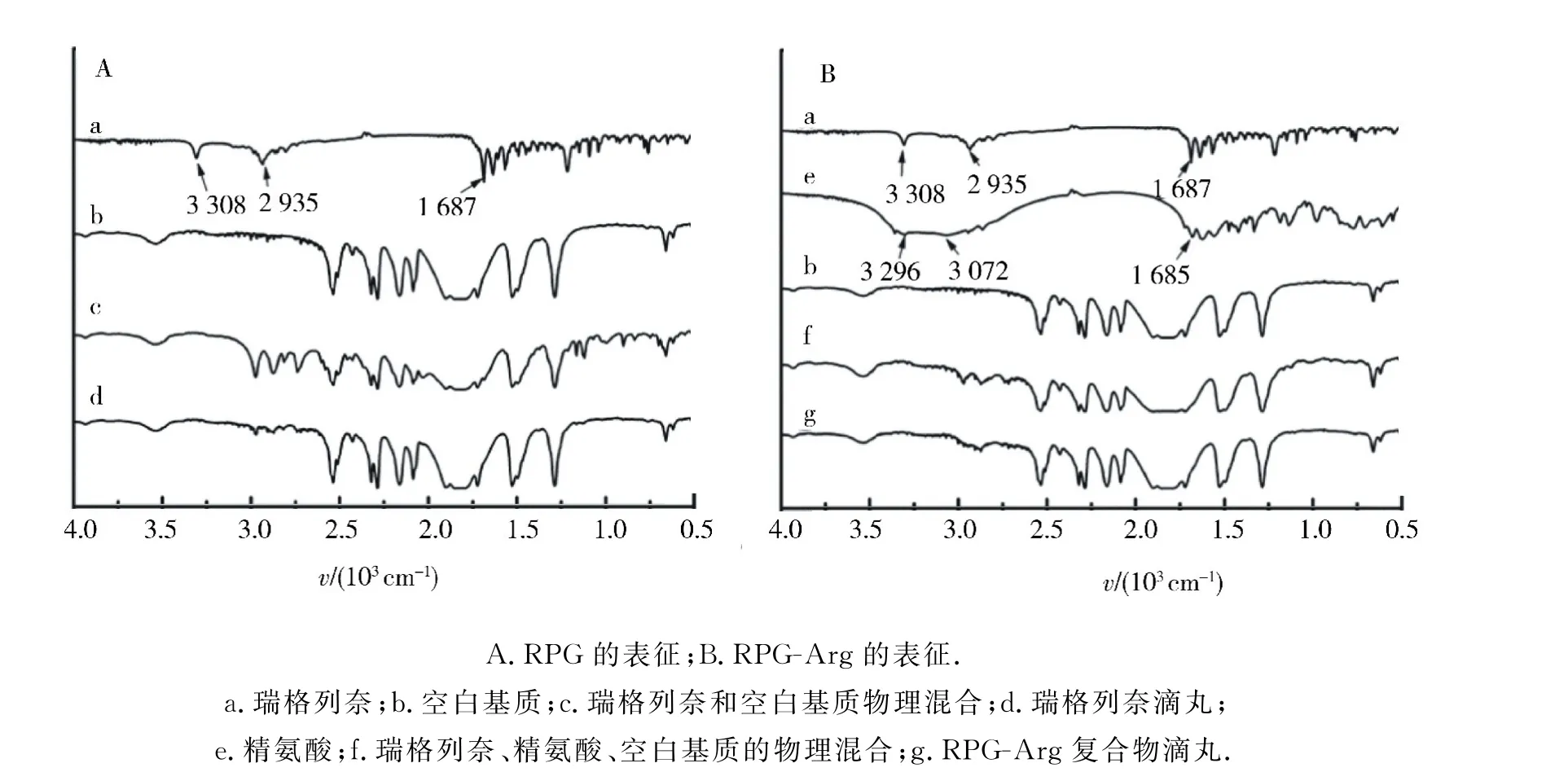
圖3 滴丸的紅外光譜Fig.3 FTIR spectra of dropping pills
2.3 體外釋放實驗
瑞格列奈滴丸和RPG-Arg復合物滴丸在p H 7.4的PBS緩沖體系中藥物溶出曲線見圖4.RPG-Arg復合物滴丸釋放藥物速度顯著優于原藥滴丸,10 min累積釋藥率達80%;而原藥滴丸達到此累積釋放率,需要30 min;故RPG-Arg復合物滴丸中存在精氨酸可加速藥物溶出.RPG-Arg復合物滴丸體外釋放優于原料藥滴丸的原因,其一、采用助溶聯合固體分散技術制備RPG-Arg凍干粉,RPG 分子通過氫鍵等作用,使得藥物分子分散于精氨酸分子中,此分散可抑制藥物和精氨酸晶態,獲得藥物的無定形態,利于藥物溶出;其二、藥物載體采用一定比例的PEG-4000和PEG-6000混合的親水高分子,起到增大難溶藥物的親水性、分散性和潤濕性,可促進難溶藥物溶出.
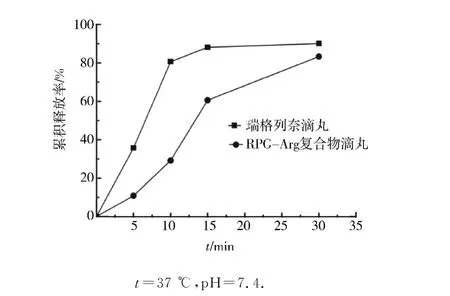
圖4 瑞格列奈滴丸和RPG-Arg復合物滴丸溶出曲線Fig.4 Drug release from RPG-Arg dropping pills and RPG dropping pills in PBS buffer
2.4 瑞格列奈滴丸的大鼠體內藥代動力學研究
圖5為瑞格列奈滴丸和RPG-Arg復合物滴丸的大鼠體內藥-時曲線.采用DAS 2.0軟件處理藥代數據,獲得表2中2種自制滴丸大鼠口服給藥后的藥代動力學參數,兩滴丸的大鼠藥-時曲線均符合二室模型.由圖5可知,相比瑞格列奈滴丸,大鼠口服RPG-Arg復合物滴丸的藥物吸收速度更快,藥物達峰時間(tmax)提前了3 h,可達到速效降糖的效果.RPG-Arg復合物滴丸的達峰濃度(ρmax)約為RPG 滴丸的2倍.此外,RPG-Arg復合物滴丸的藥時曲線下面積(AUC0-t)更大.根據公式(2)可計算復合物滴丸相對生物利用度為1.9.結果表明:RPG-Arg復合物滴丸能夠改善藥物溶解度和生物利用度.

其中,AUC代表血藥濃度-時間曲線下面積,下標RGP-Arg和RGP分別代表復合物滴丸制劑和瑞格列奈原料藥滴丸參比制劑,Dose代表給藥劑量.

圖5 口服10 mg/kg劑量瑞格列奈藥物的大鼠藥-時曲線(n=3)Fig.5 Average plasma concentration-time curves after oral administration of RPG drop pills and RPG-Arg dropping pills at a dose of 10 mg/kg in wistar rats(n=3)

表2 RPG 滴丸和RPG-Arg復合物滴丸大鼠口服給藥后體內藥代動力學參數Tab.2 PK parameters after oral administration of the RPG and RPG-Arg dropping pills
3 結論
本文選擇PEG-4000和PEG-6000混合基質,成功自制瑞格列奈和RPG-Arg復合物滴丸.FTIR和DSC結果顯示,2種滴丸中瑞格列奈以無定形態分散,體外釋放顯示自制RPG-Arg復合物滴丸更利于藥物溶出.大鼠口服滴丸的體內藥代動力學參數顯示,RPG-Arg復合物滴丸體內吸收優于原藥滴丸.實驗顯示,采用助溶聯合固體分散技術制備RPG-Arg復合物后再次固體分散其于親水高分子載體PEG-4000和PEG-6000混合基質中,可充分保證RPG無定形態的存在,促進藥物溶出,改善難溶藥物體內生物利用度.此實驗結果可為瑞格列奈滴丸劑型的開發提供必要實驗數據支持.

