利用IL-1A-eGFP慢病毒載體構建SASP細胞監測模型的研究
彭健愉,孫明軒,姚 琳,袁 源,劉肖雨,趙 威,林紫均,嚴詠恩,陳維春,劉新光,6,孫雪榮*
(1廣東醫科大學衰老研究所,東莞 523808;2廣東省醫學分子診斷重點實驗室;3廣東醫科大學醫學技術學院;4廣東醫科大學第二臨床醫學院;5廣東醫科大學藥學院;6廣東醫科大學生物化學與分子生物學研究所;*通訊作者,E-mail:xuerongsun@126.com)
細胞衰老(senescence)是機體衰老的重要基礎,與多種老年性疾病密切關聯。衰老相關分泌表型(senescence-associated secretory phenotype,SASP)指衰老細胞出現分泌功能亢進,可分泌許多生物活性分子,包括細胞因子、趨化因子、生長因子及蛋白酶等,參與多種生理和病理過程,這些分泌因子統稱為SASP因子。體內衰老細胞如未能及時清除,可導致SASP因子蓄積,從而引起慢性炎癥,導致或加劇許多慢性疾病的發生。因此,尋找能調節SASP表達的藥物,特別是SASP抑制劑,是目前衰老領域研究的熱點之一。
建立熒光標記的SASP監測模型,將為篩選SASP抑制劑提供便利。Kang等[1]構建了一種監測細胞衰老的模型,該模型將綠色熒光蛋白(green fluorescent protein,GFP)的編碼序列與細胞衰老相關基因miR-146a的啟動子融合,并將其包裝成慢病毒,感染人胚肺成纖維細胞IMR-90,從而通過綠色熒光監測細胞衰老,但此模型只能用于判斷IMR-90細胞是否衰老,不能反映SASP的情況,且該細胞不能無限增殖,不適合大規模使用。因此,建立可無限增殖的SASP細胞監測模型,仍十分必要。
本課題組前期研究發現,黑色素瘤細胞受到順鉑處理后,可出現細胞衰老,并且表達多種典型的SASP因子[2]。與文獻報道的SASP機制相符的是,在衰老的黑色素瘤中,白細胞介素1A(Interleukin 1A,IL-1A)既是SASP因子之一,同時又是SASP發生的上游調節者,可促進其他SASP因子的表達[2-4],因此,利用IL-1A建立SASP檢測模型,能更好地反映細胞整體SASP狀態。為此,本研究構建了IL-1A-eGFP表達的慢病毒載體,并利用該病毒感染黑色素瘤M14細胞,建立了可有效監測SASP強度的細胞模型,為后續篩選SASP抑制劑等研究提供便利。
1 材料與方法
1.1 試劑和細胞系
人黑色素瘤M14細胞購自賽百慷(上海)生物技術股份有限公司。高糖DMEM、0.25% EDTA胰酶、Optimem、胎牛血清、嘌呤霉素(Puromycin)、熒光染料PowerUpTMSYBR Green Master Mix購自美國Gibco公司。Trizol購自美國Life Technologies公司。順鉑(Cisplain,CDDP)購自美國Sigma-Aldrich公司。慢病毒顆粒(CS-HPRM30539-LvPF02-01)依托廣州易錦生物技術公司(GeneCopoeia,Inc.)構建,經測序及酶切驗證,慢病毒顆粒分裝為每管50 μl,-80 ℃保存。包裝質粒、293Ta細胞、Lenti-PacTMHIV慢病毒包裝試劑盒、Lenti-PacTM慢病毒顆粒濃縮試劑由廣州易錦生物技術公司提供。細胞衰老β-半乳糖苷酶染色試劑盒購自上海碧云天生物技術有限公司。反轉錄試劑HiScript Ⅲ RT SuperMix for qPCR(+gDNA wiper)購自南京諾唯贊生物科技有限公司。
1.2 構建慢病毒載體并制備DNA-EndoFectin轉染復合物
委托公司利用pEZX-LvPF02質粒構建慢病毒IL-1A-eGFP表達載體后,用限制性內切酶NcoⅠ和SalⅠ進行酶切鑒定及測序鑒定。
為了感染包裝細胞,先制備DNA-EndoFectin轉染復合物,取一無菌Ep管(A管)加入慢病毒載體的表達質粒50 μg、Lenti-PacTM混合包裝質粒100 μl(0.5 μg/μl),再添加Optimem補齊至4 ml;取另一無菌Ep管(B管),加入轉染試劑300 μl,添加Optimem補齊至4 ml。一邊輕柔渦旋A管,一邊往A管滴加B管的溶液,直到B管溶液全部滴加完畢。溶液混合后,室溫放置15 min。
1.3 準備和感染包裝細胞
用293Ta細胞作為慢病毒包裝細胞,在進行轉染前,將1.4×106個293Ta細胞接種到10 cm培養皿,加入10% FBS DMEM在37 ℃、5% CO2培養箱中培養至細胞密度達到70%-80%時開始轉染。將鋪板培養的293Ta細胞從培養箱取出,將DNA-Endo-Fectin轉染復合物均勻滴加至細胞培養皿,以8字形水平輕柔晃動細胞板,使轉染復合物均勻分散,在37 ℃、5% CO2的條件下培養12 h。轉染12 h后,棄去含有轉染復合物的舊培養液,PBS洗一次,用10% FBS DMEM繼續培養,準備收獲慢病毒顆粒。
1.4 收獲慢病毒顆粒
轉染操作的48 h后收集細胞培養液,以2 000g離心10 min去除細胞碎片,獲得慢病毒的粗病毒液。粗病毒液經快速濃縮操作(使用Lenti-PacTM慢病毒顆粒濃縮試劑)后獲得高濃度慢病毒液,按Lenti-PacTMHIV慢病毒包裝試劑盒說明書進行慢病毒滴度檢驗。
1.5 慢病毒感染黑色素瘤M14細胞
消化M14細胞,取1×104個細胞到12孔板中,待細胞貼壁后,按感染復數(multiplicity of infection,MOI)=20的比例,每孔先加入484 μl 10% FBS DMEM,再加入16 μl慢病毒原液,37 ℃、5% CO2培養12 h后,棄含病毒的舊培養液,PBS洗2次,用1 ml 10% FBS DMEM繼續培養至72 h。棄舊培養液,用PBS洗2次,加入1 ml新培養液和1 μmol/L嘌呤霉素,37 ℃、5% CO2培養72 h;棄舊培養液,用PBS洗2次,加入1 ml新培養液和6 μmol/L嘌呤霉素,37 ℃、5% CO2培養72 h,獲得抗嘌呤霉素的M14細胞株。
1.6 單克隆挑取并用CDDP進行功能篩選
為了獲得基因型均一的細胞株,將500個嘌呤霉素篩選后的M14細胞種于10 cm培養皿進行單克隆培養,待克隆形成后挑選單克隆進行培養。取0.5 μl胰酶作用于單克隆細胞,待細胞變圓后用1 μl含10% FBS DMEM終止消化,吸取并重懸細胞,進行種板和初步擴增。
為鑒定挑取的單克隆細胞衰老后能否表達綠色熒光,將擴增后的單克隆細胞重新種板,并分成兩組,一組接種至24孔板,第2天用2 μmol/L CDDP處理24 h,用PBS洗2次,換成10% FBS DMEM液繼續培養至第5天,期間用EVOS FL Auto全自動活細胞顯微成像系統(美國Life Technologies公司)連續觀察熒光產生情況;另一組常規培養,用于進一步擴增和凍存。將能產生熒光的單克隆細胞進行擴增、凍存,經復蘇和傳代后,用CDDP重新檢測,發現依然能產生熒光,將此穩轉M14-IL-1A-eGFP細胞株用于后續實驗。
1.7 衰老相關β-半乳糖苷酶(β-gal)活性染色
采用上述方法,用CDDP誘導M14-IL-1A-eGFP細胞衰老后(用溶劑為陰性對照),參照細胞衰老β-半乳糖苷酶染色試劑盒說明書步驟進行染色。棄舊培養基,用PBS洗1次,加固定液室溫固定15 min,棄固定液,用PBS洗3次,每次3 min,加入配好的染色工作液,37 ℃孵育48 h后,在倒置顯微鏡(Nikon ECLIPSE TS100)下觀察及拍照。
1.8 熒光定量RT-PCR檢測IL-1A、IL-1B及IL-8表達水平
取CDDP或溶劑處理后的M14-IL-1A-eGFP細胞,使用Trizol法提RNA,按HiScript Ⅲ RT SuperMix for qPCR(+gDNA wiper)試劑說明書逆轉錄獲得cDNA。熒光定量PCR采用10 μl反應體系,其中cDNA模板為0.75 μl,上下游引物共1 μl,SYBR Green染料為5 μl,高壓滅菌超純水3.25 μl。反應程序按SYBR Green Master Mix設置。以GAPDH為內參基因,引物序列見表1。

表1 引物序列Table 1 The primer sequences
1.9 統計分析
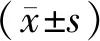
2 結果
2.1 慢病毒表達載體的鑒定
所構建的IL-1A-eGFP慢病毒表達載體,經NcoⅠ和SalⅠ分別進行酶切鑒定,再經測序鑒定,結果符合預期(見圖1)。濃縮后的慢病毒滴度約為1.69×108TU/ml(1 TU/ml=100 copies/ml)。
2.2 SASP細胞模型的建立及鑒定
用IL-1A-eGFP慢病毒感染黑色素瘤M14細胞后,經過嘌呤霉素篩選,挑取單克隆培養后,獲得形態均勻,生長狀態良好的M14-IL-1A-eGFP細胞。將該細胞在10%FBS DMEM中培養,細胞生長迅速,狀態良好,邊界清楚,形態與常規培養的M14細胞形態無明顯差異。
常規培養條件下,在藍色激發光下,僅少數M14-IL-1A-eGFP細胞有較弱的綠色熒光,可能與M14細胞有一定的IL-1A基礎表達量有關。加入CDDP后,M14-IL-1A-eGFP細胞形態明顯變大,增殖明顯減慢,約24-48 h后可以觀察到明亮的綠色熒光,繼續培養到第5天,熒光進一步增強(見圖2A)。衰老相關β-gal染色結果顯示,加入CDDP后第5天,細胞呈明顯藍染,而溶劑處理組無明顯染色(見圖2B)。RT-PCR進一步證實,CDDP處理后的第5天,SASP相關基因包括IL-1A、IL-1B和IL-8,表達明顯增強(見圖2C),這說明CDDP誘導M14-IL-1A-eGFP細胞出現了衰老和SASP,同時也證明綠色熒光可有效監測SASP的發生。另外,M14-IL-1A-eGFP細胞經復蘇及多次傳代后,表型穩定,說明該細胞為穩轉株。

M1.DNA Ladder 6000;1.病毒載體;2.病毒載體經NcoⅠ酶切后的產物;3.病毒載體經SalⅠ酶切后的產物;M2.DNA Ladder 100;M3.DNA Ladder 15 000圖1 IL-1A-eGFP慢病毒表達載體驗證Figure 1 Verification of IL-1A-eGFP Lentiviral Expression Vector

圖2 誘導M14-IL-1A-eGFP細胞衰老并鑒定熒光和SASP因子表達Figure 2 Induction of senescence and detection of fluorescence and SASP expression in M14-IL-1A-eGFP cells
3 討論
SASP因子分泌后進入微環境或體循環中,可發揮多種生物學功能。SASP因子既可通過自分泌途徑加強衰老細胞的衰老狀態,也可通過旁分泌途徑誘導相鄰細胞衰老[5-7]。SASP還參與胚胎發育和成型,可激活免疫系統,促進傷口愈合、修復或重塑組織等。但SASP因子過多或存在時間過長,會形成炎性微環境,從而促進癌癥和衰老相關疾病的發生和發展[8-11]。SASP因子發揮的生物學作用取決于分泌因子的種類、數量和局部微環境等。
關于SASP的發生機制,已有較多研究。SASP的產生和調節主要與DNA損傷[12-14]、NF-κB信號通路[15,16]、p38MAPK信號通路[17,18]、mTOR信號轉導[19,20]、NLRP3炎性小體[5,21]、微小RNA(microRNAs,miRNA)[22,23]等有關,近年還發現,cGAS-STING通路[24,25],及GATA4[1,26]、IFI16[27]基因也參與調節SASP。盡管如此,仍有很多未知的SASP調節機制有待闡明,本研究提供的SASP模型將有助于探究SASP發生及調節機制。
隨著年齡的增長,衰老細胞逐漸累積,衰老人群免疫力低下,導致衰老細胞不完全清除和SASP因子堆積。文獻報道,清除體內衰老細胞,可以延緩機體衰老,改善多種老年相關性疾病的癥狀,機制與減少SASP因子產生有關[28]。因此,利用SASP抑制劑減少SASP因子產生,有望在衰老相關慢性病的防治中發揮重要作用。目前已報道的SASP抑制劑有地塞米松[29]、雷帕霉素[3,19]、二甲雙胍[30]、UBX0101[31]等,但這些藥物大多有其他生物效應,容易產生副作用。因此,尋找更特異的SASP抑制劑,尤為重要。建立熒光標記的SASP細胞模型,將可為大規模篩查特異SASP抑制劑提供方便。
已有不少研究者通過構建“啟動子-熒光蛋白”來監測某些分子的激活[1,32,33],但用于監測SASP的相關質粒或細胞,鮮見報道。IL-1A既是SASP成分之一,也是SASP上游調節因子,可調節下游SASP因子如IL-6、IL-8等表達[2-4,34]。故選擇IL-1A啟動子驅動的綠色熒光蛋白作為SASP發生的標志,比其他SASP因子更具有代表性,有望更好地反映整體SASP狀態。
本課題組已報道[2],黑色素瘤細胞(如A375、M14等)受到DNA損傷時,可出現典型的衰老形態和SASP表型,適用于進行細胞衰老及SASP相關研究。本文以黑色素瘤細胞為基礎建立的SASP細胞監測模型,可無限擴增,從而能保證數量充足。
綜上所述,本研究通過慢病毒將IL-1A-eGFP轉入黑色素瘤細胞,誘導細胞衰老后,IL-1A表達上調而驅動綠色熒光蛋白表達,可用熒光顯微鏡觀測,從而了解SASP發生與否及程度。本SASP模型的優點在于,可反映SASP整體狀態,可無限擴增,凍存方便,有望為SASP相關研究提供便利。

