歐李再生和遺傳轉化體系的研究進展
郎紹裕 任靜 王迪 笈小龍 宋興舜
摘要:? 通過總結近年來對歐李再生體系和遺傳轉化體系的研究結果發現:1.帶有芽點的莖段是構建無性系的主要材料;2.葉片更適合誘導愈傷組織產生;3.培養基中添加細胞分裂素和生長素的比例接近時有利于誘導愈傷組織產生,比例升高時會促進愈傷組織的分化;4.單獨添加生長素可以誘導生根;5.歐李遺傳轉化的方法是農桿菌介導法。同時總結和討論了影響歐李再生率、轉化率的主要因素。
關鍵詞:? 歐李;? 組織培養;? 植株再生;? 遺傳轉化;? 外植體
中圖分類號:? ?S 662. 5? ? ? ? ? ? ? ?文獻標識碼:? ?A? ? ? ? ? ? ? ? 文章編號:1001 - 9499(2021)03 - 0033- 05
歐李(Cerasus humilis (Bge.) Sok.)是我國特有的一種薔薇科櫻屬多年生小灌木,也是實施“退耕還林”的重要樹種之一,具有重要的生態價值。歐李適應性強,耐干旱、耐貧瘠、耐鹽堿,對生長環境要求較低,具有短期內速生繁殖等優點[ 1 ]。其果實顏色鮮艷,含有豐富的天然活性鈣,是一種具有代表性的藥食兩用水果[ 2 ]。同時其種仁中藥稱之為郁李仁,具有潤腸通便,下氣利水的功效[ 3 ]。現階段對于歐李幼苗栽培,果實加工,新品種培育的研究已經取得了極大的成果,但是對其抗逆機理等分子生物學問題深入研究較少,主要還是因為當前歐李的再生和遺傳轉化體系構建不夠完善,可重復性較差。基于此,本文對近年來相關研究進行歸納和總結,以期為當前歐李再生和遺傳轉化時遇到的再生率、轉化率低下等問題提供一些參考,旨在為建立歐李快速、高效的再生和遺傳轉化體系提供理論依據。
1 歐李再生體系和遺傳轉化體系研究進展
近年來,已有較多歐李品種的再生體系和遺傳轉化體系的研究。本文將從建立無性系、愈傷組織誘導、誘導不定芽產生和增殖、生根、馴化移栽、遺傳轉化等方面對當前的研究進行總結。
1. 1 建立無性系
1. 1. 1 外植體消毒條件
不同歐李品種、不同外植體的消毒條件大致相同。主要步驟是用清水沖洗外植體(可以加入洗衣粉或洗潔精),用0.05%~2%NaClO 或0.1%HgCl2(有時也加入吐溫)、75%的酒精進行消毒,用無菌水涮洗干凈,最后用無菌濾紙吸干水分備用[ 4 - 8 ]。
1. 1. 2 培養條件
再生體系建立的培養條件就是給外植體提供光照、溫度和濕度適宜的環境以促進外植體的生長。培養條件為:溫度(25±2)℃,光照強度1 000~? ? 3 000 lx,光照時間12~16 h/d,空氣相對濕度60%左右 [ 9 - 12 ]。
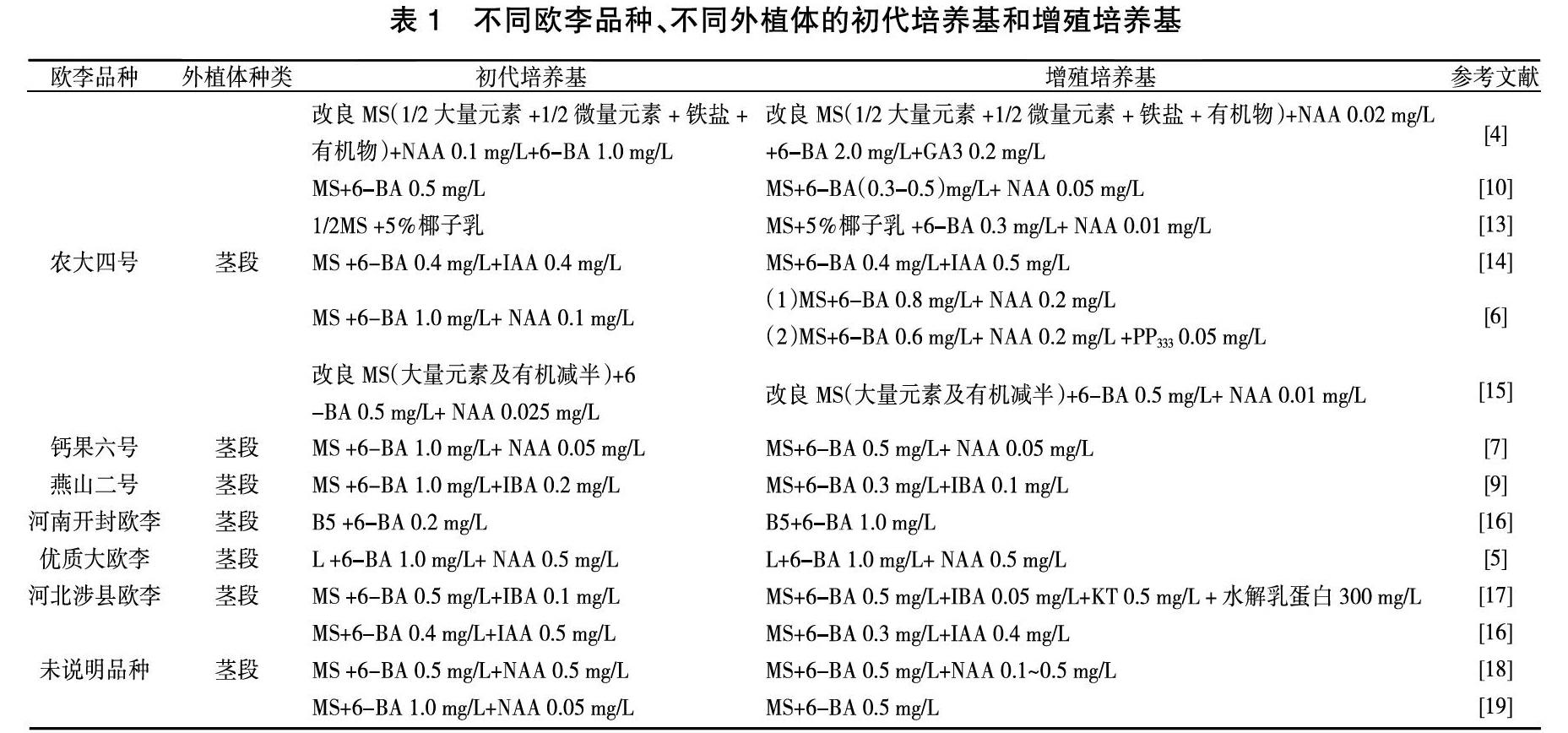
1. 1. 3 初代培養基和增殖培養基
初代培養基也稱啟動培養基,是外植體消毒后第一次接種的培養基,用來篩選無菌苗。將初代培養基篩選后得到的第一批無菌苗轉入增殖培養基中擴繁,建立無性系,可以為之后的實驗提供足夠的無菌材料。近年來研究結果中初代培養基和增殖培養基的配方總結如表1所示,培養基中添加的蔗糖量為20~40 g/L、瓊脂量為5~8 g/L,pH為5.6~
6.0,繼代周期為1個月左右。
1. 2 愈傷組織誘導
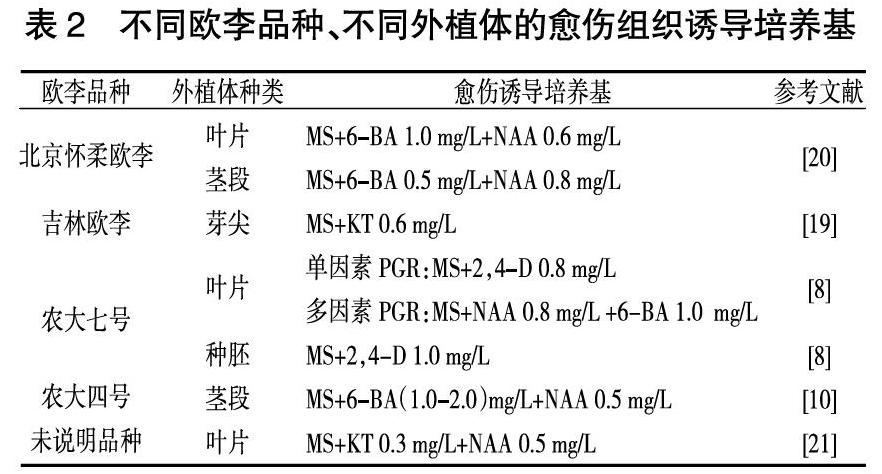
將無菌外植體接入愈傷誘導培養基中誘導其中的活細胞恢復全能性,轉變為分生細胞,分生細胞分化為薄壁組織最終形成愈傷組織。誘導產生愈傷組織是分化生成完整植株的前提。由表2可知,不同歐李品種用來誘導愈傷的外植體各有不同,但是利用葉片誘導愈傷組織,誘導率可達95%以上,培養基中添加的蔗糖量為20~40 g/L、瓊脂量為5~8 g/L,pH為5.6~6.0。
1. 3 不定芽的誘導和增殖
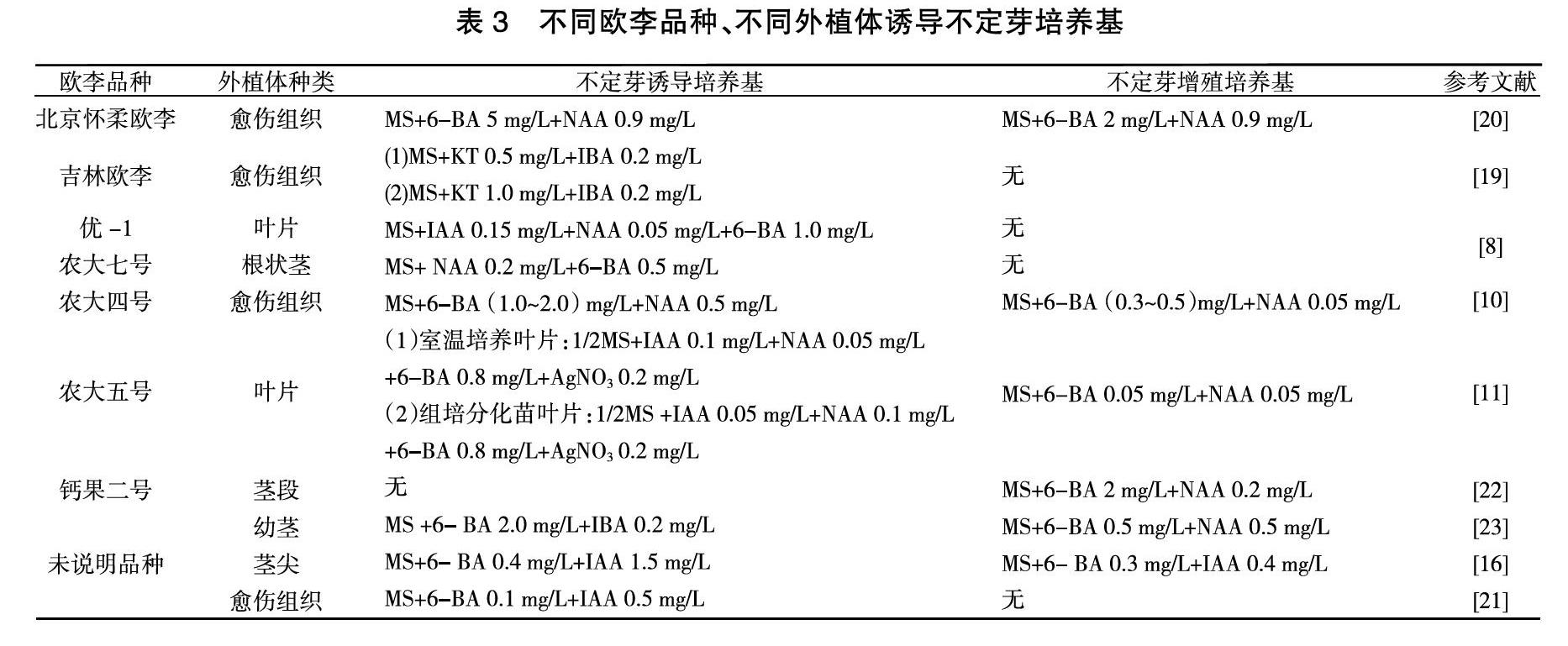
不定芽就是從通常不形成芽的組織或者器官上生出芽,這些部位如:愈傷組織、葉、根等。由于在選取植物的器官或組織離體培養時,難以形成定芽,這時就需要誘導產生不定芽來發育成為一個完整的植株。通過誘導產生的不定芽,往往是單個或者少數幾個,這時就需要對不定芽進行增殖培養,形成不定芽叢來為后續研究提供足夠的材料。由表3可知,利用愈傷組織分化產生不定芽是不定芽獲取的常規手段,愈傷組織分化穩定,且分化率高。培養基中添加的蔗糖量為20~40 g/L、瓊脂量為5~8 g/L,pH為5.6~6.0。
1. 4 誘導生根
無菌苗能否順利馴化移栽,建成再生體系,無菌苗是否生根起著決定性作用。無菌苗生根以后,汲取養分會更快,植株的生長也會加快,繼代培養的苗也會更加強壯。
莊麗娟[ 5 ]使用L培養基為基本培養基對“優質大歐李”的無菌苗進行生根誘導,單獨添加了不同濃度的IAA、NAA、IBA和6-BA來誘導植株生根,通過統計和觀察生根情況,找出誘導歐李生根的最適培養基。結果發現在添加了IAA、NAA和IBA的L培養基中無菌苗均可以生根,IAA和NAA隨著濃度的提高生根率也有所提高,但IBA的生根效果不是很好。雖然NAA的生根率最高,但是會在莖基部形成愈傷組織,生出短而粗的根,且植株生長緩慢,葉片發黃;當IAA的濃度達到1.0 mg/L時也會在莖基部出現愈傷組織,但是IAA濃度降低為0.5 mg/L時,莖基部很少再出現愈傷組織,生根率也可以達到83.3%,且可生出側根,植株長勢較好。在加入6-BA的培養基中,沒有生根苗的出現,但是植株長勢良好,驗證了細胞分裂素在歐李生根時不起作用,但有益于植株的營養生長。綜合考慮選用添加了0.5 mg/L IAA來誘導繼代培養的組培苗生根。陳書明等[ 6 ]以1/2MS培養基為基本培養基對“唐山歐李”和“九渡河歐李”進行生根誘導時發現,在添加生長素之后,再加入0.05 mg/L PP333(多效唑),生根率明顯提高,同時高濃度的IBA會導致分化幼苗變黃,從而無法生根;張建英[ 9 ]以“燕山二號”歐李為材料,在誘導生根時發現把幼苗接入生根培養基培養4~6天后,再轉接入不含激素的1/2MS培養基中培養,可減少愈傷組織的產生,有利于植株的生長;周金梅等[ 24 ]以“吉林歐李”為材料摸索出的最適生根培養基為1/2MS+0.2mg/L NAA,通過觀察發現1周左右的生根時間對于歐李后期生長最為有利;Mu等[ 25 ]以“99-02”歐李為材料摸索出的最適生根培養基為1/2MS+0.8mg/L IAA;孫新政等[ 4 ]、范小峰等[ 10 ]、徐萍等[ 13 ]、王正德等[ 16]以“農大4號”歐李為材料,1/2MS為基本培養基加入生長素來誘導無菌苗生根,孫新政除此之外還添加了0.02mg/L KT、徐萍還添加了1%的椰子乳來促進無菌苗生根。
綜上所述,誘導無菌苗生根的最適條件為:以1/2MS培養基為基礎培養基,單獨添加生長素,其中培養基中添加的蔗糖量為20~40g/L、瓊脂量為5~8g/L,pH為5.6~6.0。
1. 5 馴化移栽
歐李再生體系建立的最后一步就是馴化移栽組培的幼苗。馴化移栽的步驟主要是先對組培幼苗進行馴化鍛煉、基質培養,逐步恢復其自養功能,然后移栽到自然環境中幼苗可以自養成活。
韓向峰等[ 11 ]利用光培煉苗、閉瓶煉苗和開瓶煉苗的方法對植株復壯,瓶內煉苗后將生根苗移至用1 000倍多菌靈液清洗消毒后的基質(深層土+泥炭+河沙+珍珠巖)上完成馴化;最后當苗在基質上長至5~8 cm,基部開始半木質化,根系變為褐色,有大量毛細根產生時,將幼苗移栽到營養杯;經過30天的生長后,去掉營養杯帶土坨移栽到大田中,成活率為77.5%。趙昌亮等[ 26 ]將苗置于太陽光下照射3~7天,然后開蓋培養3~5天,洗去根部培養基,將試管苗在15~20 ppm 的多菌靈稀液中浸蘸 3~5 s ,然后移入營養缽基質中培養90~120天,最后定植于大田中,成活率達85%以上。曹琴等[ 27 ]在光培煉苗過程中,閉瓶煉苗10天、開瓶煉苗3天,光照強度為0.6~0.9 wlx;移栽的生根幼苗采用0.1%多菌靈藥液浸泡10 min,移栽基質采用pH 7.29~7.39,Ec值為0.30×103~0.36×103 mS/cm的混合基質和原生土基質;移栽基質用0.2%的五氯硝基苯滅菌或 125 ℃高溫滅菌;基質煉苗45~50天后進行營養缽移栽。劉春穎等[ 23 ]在幼苗達到3葉以上時進行移栽,先閉瓶進行強光鍛煉,把三角瓶移至光照強度20~35 klx下,繼續培養10天左右,然后將組培苗去蓋移至通風陰涼處,開瓶煉苗2~5 天,在表面出現大量雜菌前取出小苗,洗凈根部培養基,移栽到溫室裝有蛭石、珍珠巖和草炭基質(比例為1∶1∶1)的穴盤中,扣上塑料薄膜保溫,加扣遮陰網;溫度控制在22~25 ℃,保持空氣相對濕度90%左右,7~8天后逐漸通風,再煉苗5天后,可完全放開;10天澆1次營養液,保證此期間的養分供應,成活率為85%以上。當穴盤內幼苗長到5 cm左右時,移至裝有營養土的營養缽(8 cm×8 cm)內,營養土的構成為大田土、腐熟農家肥、腐殖土各占1/3,并拌入防病菌的藥劑,加扣遮陰網,澆透水,保持空氣濕度 80%左右。當營養缽內幼苗長至15~20 cm左右時,定植到生產田。
1. 6 遺傳轉化
通過對薔薇科果樹離體再生于遺傳轉化研究進展的總結發現[ 28 ],薔薇科果樹通過轉基因改善的性狀主要集中在抗性方面,而且運用的都是農桿菌介導的遺傳轉化體系。山西農業大學杜俊杰教授課題組于2016年發表了農桿菌介導的歐李遺傳轉化體系,選取組培苗腋芽生長出的1~2 cm葉子,用作外植體再生和轉化實驗;將構建好的載體用電穿孔法轉入LBA4404農桿菌中;確定葉片對于卡那霉素的耐受性為15 mg/L;將葉片浸于農桿菌菌液(OD600=0.6)7 min后用無菌濾紙吸干菌液;然后在25 ℃的黑暗環境下共培養3天;將共培養的外植體進行脫菌處理移入M4培養基中進行抗性的篩選和芽系的誘導;采用GUS分析和PCR分析進行轉基因的驗證;最終對確定轉基因的幼苗進行生根誘導,最終獲得轉基因株系[ 25 ]。
2 討 論
2. 1 影響再生率的原因
歐李再生體系建立在當前來看并不完善,體系的可重復性差。總結影響再生率的原因可能有以下幾點:
(1)基因型與外植體
歐李廣泛分布在我國多個省市自治區,具有多個不同的野生品種和培育品種,且不同品種的基因型不同,生長習性不同,種間差異明顯,所以組織培養的條件也不相同。葉片、莖段、子葉、胚軸等多種外植體在薔薇科果樹離體再生中均有應用[ 28 ]。例如秦偉[ 29 ]研究了新疆蘋果以不同器官為外植體的愈傷組織誘導率,其幼莖的誘導率高于葉、子葉,而誘導根則無愈傷組織形成;范小峰等[ 10 ]利用鈣果四號的莖段進行愈傷組織誘導;而武莎莎[ 8 ]則是利用農大七號的葉片來進行愈傷組織誘導。
(2)植物生長調節劑
基本培養基是保證外植體生存與生理活動的最基本物質,而細胞分裂的啟動、培養物的形態建成、芽的分化和跟的形成則離不開植物激素的誘導調節[ 30 , 31 ]。在植物組織培養的過程中,細胞分裂素和生長素是常用的植物生長調節劑,通過控制二者的配比來達到定向誘導植物組織形成和發育的目的。單獨使用IBA對于植物生根有一定的幫助[ 14 , 21 ]。2. 2 影響轉化率的原因
關于歐李遺傳轉化體系的報道較少,現階段取得一定成果的是山西農業大學杜俊杰教授的團隊。其他研究人員對于歐李基因功能的研究還是在轉化異源植物,重要的原因就是自己開發的體系轉化效率低下無法達到實驗要求,這是所有薔薇科植物面臨的共同問題。影響轉化率的原因有以下幾點:
(1)外植體類型
孫華軍等[ 32 ]認為外植體類型是轉化的主要影響因素。不同來源和發育狀態的受體都會對農桿菌的侵染產生較大影響。
(2)農桿菌菌株類型、濃度和浸染時間
通過查閱文獻發現,當前薔薇科植物的遺傳轉化方式大多都是由農桿菌介導的。用于遺傳轉化的農桿菌菌株有多種,不同菌株的侵染能力不同,并因果樹種類而異。薔薇科果樹遺傳轉化時農桿菌菌液濃度多為A600=0.2~1.0,侵染時間因菌株和果樹種類不同而異[ 28 ]。Oosumi等[ 33 ]在草莓的遺傳轉化過程中分別使用了GV3101和LBA4404兩個菌種侵染外植體,兩個菌種浸染時間分別為20 min和24 h。
(3)篩選劑的種類和濃度
與其他植物類似,薔薇科果樹轉基因研究常用的標記基因是NptⅡ,對應的抗性篩選劑為卡那霉素[ 28 ]。不同品種、不同外植體和不同生長時期的植物對抗生素的敏感程度不同,因此要根據實際情況選擇篩選劑的濃度。
(4)共培養條件
共培養就是將處于對數生長期的菌液和受體在同一環境中培養,利用細菌侵染受體,從而達到將T-DNA整合到受體基因組中的目的。除了常用方法以外,共培養時可以加一些酚類物質和滲透保護劑來提高轉化效率。薔薇科果樹遺傳轉化通常也在外植體與農桿菌共培養時,加入或提前加入乙酰丁香酮(As)于菌液中[ 28 ]。
3 展 望
歐李作為潛在價值巨大的藥食兩用植物,近些年對其幼苗栽培、果實加工、新品種培育的研究已經取得了極大的成果,但是深入的分子生物學研究還處于起步階段。究其根本,轉化率和再生率低下仍是歐李相關產業發展所面臨的瓶頸問題。建立歐李快速、高效的再生和遺傳轉化體系,在歐李品種改良、了解其抗逆機制發揮其更大的生態價值以及基因功能研究中起著重要作用。相信隨著再生體系和遺傳轉化體系的深入研究和發展,同時借鑒成熟的薔薇科植物遺傳轉化體系的研究成果,瓶頸終將被打破,歐李相關產業也會得到長足的進步和發展。
參考文獻
[1] 張東為, 賈天會, 舒喬生. 水保優良樹種歐李的研究進展及今后研究方向[J]. 中國水土保持, 2012(1): 45-47.
[2] Fan S, Wu P, Xing G. Nutritional Composition and Development of Chinese Dwarf Cherry (Cerasus Humilis (Bge.) Sok.)[J]. International Journal of Nutrition and Food Sciences, 2019, 8(2): 49-52.
[3] 孫萌. 歐李果實不同發育階段糖酸動態變化及其種仁藥材品質評價研究[D]. 北京: 北京中醫藥大學, 2017.
[4] 孫新政, 申順先, 李慶偉, 等. 鈣果4號歐李組織培養技術研究[J]. 果樹學報, 2007(1): 80-83.
[5] 莊麗娟. 歐李快速繁殖技術體系研究[D]. 呼和浩特: 內蒙古農業大學, 2005.
[6] 陳書明, 姜英淑, 王秋玉. 歐李組培快速繁殖體系的建立[J]. 林業科技, 2008(2): 59-62.
[7] 李琳琳. 鈣果6號組織培養技術研究[J]. 林業實用技術, 2010(5): 29-30.
[8] 武莎莎. 歐李愈傷組織誘導及不定芽再生體系的優化[D]. 太原: 山西農業大學,2018.
[9] 張建英. 燕山2號歐李組織快繁技術研究[J]. 河北林業科技, 2011(5): 12-13.
[10] 范小峰, 田興旺. 鈣果4號愈傷組織的誘導和植株再生[J]. 林業實用技術, 2008(6): 8-10.
[11] 韓向峰, 李志芳, 曹琴, 等. 農大5號鈣果葉片芽誘導及其植株再生研究[J]. 廣東農業科學, 2018, 45(8): 37-42+32.
[12] 薛麗萍, 趙昌亮, 馬顥玲, 等. 鈣果組培育苗技術研究[J]. 山西水土保持科技, 2005(4): 21-22.
[13] 徐萍, 譚劍鋒. 鈣果苗木組培技術初探[J]. 林業科技開發, 2008(5): 78-80.
[14] 賈明仁, 張明偉. 鈣果組織培養育苗技術研究[J]. 北方果樹, 2008(6): 11-13.
[15] 郭勁鵬. 歐李組織培養快繁技術[J]. 中國林副特產, 2012(5): 83-84.
[16] 王正德, 王大鐘. 歐李幼莖組織培養的初步研究[J]. 河南大學學報(自然科學版), 2006(2): 71-72.
[17] 梁偉玲, 陳翠果, 孟繁祎, 等. 歐李優系組培快繁技術研究[J]. 湖北農業科學, 2019, 58(6): 136-139.
[18] 鐘士傳, 杜啟蘭. 鈣果的組織培養技術[J]. 農業科技通訊, 2004(8): 18.
[19] 胡延生, 姜繼發, 建德鋒. 歐李愈傷組織誘導及分化研究[J]. 吉林農業科學, 2015, 40(6): 98-100.
[20] Wang R F, Huang F L, Zhang J, et al. Establishment of a high-frequency regeneration system in Cerasus humilis, an important economic shrub[J]. Journal of Forest Research, 2016,
21(5): 244-250.
[21] 杜研, 李毅, 王婭麗, 等. 鈣果愈傷組織誘導和植株再生的研究[J]. 西北農業學報, 2007(5): 222-226.
[22] 徐立, 李志英. 鈣果不定芽生根誘導研究[J]. 安徽農業科學, 2008(29): 12 585-12 586.
[23] 劉春穎, 孫伯錚, 冉學忠. 歐李的組培快繁與移栽技術研究[J]. 現代農業科技, 2008(8): 11+13.
[24] 周金梅, 呂忠仁, 建德鋒. 歐李組培苗的擴繁與生根出瓶移栽技術研究[J]. 吉林農業科學, 2012, 37(6): 51-52+55.
[25] Mu X P, Liu M, Wang P F, et al. Agrobacterium-mediated transformation and plant regeneration in Chinese dwarf cherry [Cerasus humilis(Bge.) Sok][J]. Journal of Horticultural Science & Biotechnology, 2016, 91(1): 71-78.
[26] 趙昌亮, 薛麗萍, 馬顥玲, 等. 鈣果組培苗煉苗與移栽研究[J]. 山西水土保持科技, 2005(4): 23-24.
[27] 曹琴, 杜俊杰. 歐李組培苗移栽成活影響因子的研究[J]. 山西農業大學學報(自然科學版), 2009, 29(3): 238-242.
[28] 李坤坤, 徐昌杰. 薔薇科果樹離體再生與遺傳轉化研究進展[J]. 園藝學報, 2017, 44(9): 1 633-1 644.
[29] 秦偉. 新疆野蘋果繁育特性及種質資源親緣關系研究[D]. 烏魯木齊: 新疆農業大學, 2010.
[30] 吳靜妍, 葛新新, 李海英, 等. 薔薇科果樹組織培養研究進展[J]. 安徽農業科學, 2020, 48(21): 10-12.
[31] Buzkan N, In-Mendi Y, Terlizzi B. CLONAL PROPAGATION OF DISEASE-FREE ROOTSTOCKS FOR SOUR AND SWEET CHERRY BY MERISTEM CULTURE[J]. Acta Horticulturae, 1997(441): 329-332.
[32] 孫華軍, 李國瑞, 陳永勝, 等. 農桿菌介導的植物遺傳轉化影響因素研究進展[J]. 安徽農業科學, 2015, 43(24): 26-27+77.
[33] Oosumi T, Gruszewski H A, Blischak L A, et al. High-? ? efficiency transformation of the diploid strawberry (Fragaria vesca) for functional genomics[J]. Planta, 2006, 223(6): 1 219-? ? 1 230.
第1作者簡介:? 郎紹裕(1995-),? 男,? 在讀碩士研究生,? 主要研究方向為歐李遺傳轉化體系的構建。
通訊作者:? 宋興舜(1978-),? 男,? 教授,? 博士生導師,? 主要研究方向為植物逆境生理與分子生物學。
收稿日期: 2020 - 10 -? 28
(責任編輯:? ?張亞楠)

