多重剪接RNA結合蛋白RBPMS在結腸炎相關結腸癌中的表達及作用
趙新華 馬怡茗 賀龍梅 汪紅英
RNA選擇性剪切是調控蛋白多樣性的重要機制,在腫瘤發生與發展過程中發揮著重要的作用。伴隨著深度測序技術在腫瘤研究中的應用,RNA選擇性剪切(Alternative splicing,AS)在腫瘤發生與發展過程中的作用引發研究者的重視[1-3]。RBPMS(RNA-binding protein with multiple splicing)屬于RNA結合蛋白家族,編碼蛋白的N端有一個保守的RRM(RNA recognition motif)區域[4]。其在軸突導向[5]、平滑肌可塑性[6]以及癌細胞增殖和遷移[7]的調控過程中發揮作用,但是在結腸癌發生與發展中的作用還是未知。
氧化偶氮甲烷(azoxymethane,AOM)-葡聚糖硫酸鈉(dextran sulfate sodium,DSS)模型是比較成熟的結腸炎相關結腸癌動物模型,可在3個月內模擬急性炎癥修復期、輕度不典型增生、腺瘤到腺癌的結腸炎相關結腸癌發生與發展動態過程。本研究將初步探索RBPMS小鼠和人結腸癌中的變化,并檢測其在結腸癌細胞增殖中的作用。
材料與方法
一、結腸炎相關結腸癌模型的構建
將小鼠隨機分為對照組和給藥組,對照組不做任何處理。給藥組在實驗第1天單劑量腹腔注射AOM(12.5 mg/kg),1周后給予含2.5%DSS的飲用水5天,停藥2周,作為1個DSS周期;共給予4個周期的DSS。每組各5只小鼠。
二、動物樣本采集
分別在第1、2、3、4個DSS周期結束時,處死給藥組小鼠,相應的命名為AD1(急性炎癥修復期)、AD2(輕度不典型增生)、AD3(腺瘤)和AD4(腺癌)組,對照組小鼠命名為Con組。小鼠解剖后取遠端結腸(結腸一半至肛門),結腸剖開,用生理鹽水清洗干凈,置于液氮中速凍,并存放于-80度冰箱中長期保存。
三、細胞培養與轉染
HCT116細胞使用RPMI-1640(含10%FBS和1%青鏈霉素)常規培養,當融合度高于90%時,使用0.25%胰酶消化傳代。細胞轉染使用lipofectamineTM2000將小干擾RNA及其對照分別轉入HCT116細胞系。
RBPMS特異性小干擾RNA序列:
siRBPMS#1:
5′-GGAGGUCCGGACCCUAUUUTTAAAUAGG
GUCCGGACCUCCTT-3′;
siRBPMS#2:
5′-CCGCUUCGAUCCUGAAAUUTTAAUUUCA
GGAUCGAAGCGGTT-3′;
siRBPMS#3:
5′-GCUUUCACCUAUCCCGCUUTTAAGCGG
GAUAGGUGAAAGCTT-3′。
RBPMS的引物序列:
RBPMS-F:TATGAGCTCACAGTGCCTGC;
RBPMS-R:GCTAACTCCGCTGGGTACAG。
四、總RNA的提取和質量檢測
使用Trizol法提取小鼠結腸組織的總RNA。使用NanoDrop K5600檢測提取的總RNA的濃度和純度。
五、全基因組表達譜芯片的檢測
按照Agilent mRNA表達譜芯片的說明書操作,應用檢測合格的總RNA熒光擴增后進行芯片雜交,掃描芯片獲取圖像,記錄數據。
六、組織固定、包埋與免疫組織化學染色
使用10%福爾馬林對AD4組小鼠結腸組織固定24 h,石蠟包埋后切取4 μm厚組織切片。60℃烘烤過夜后,經二甲苯和濃度梯度酒精脫蠟。于95℃的0.01 M(pH 6.0)檸檬酸鹽緩沖液中熱修復15 min,自然冷卻至室溫。滴加3%雙氧水阻斷內源性過氧化物酶,利用兔源性RBPMS抗體(1∶100)于4℃孵育過夜。滴加酶標抗兔二抗試劑孵育30分鐘,二氨基聯苯胺顯色,蘇木素復染,經梯度酒精和二甲苯脫水后,使用中性樹脂封片。
七、蛋白質提取
使用RIPA(添加蛋白酶抑制劑和磷酸酶抑制劑)裂解液提取細胞總蛋白質,使用NE-PER?Nuclear and Cytoplasmic Extraction Reagents(Thermo Fisher Scientific)提取細胞核蛋白和胞漿蛋白。使用BCA法檢測蛋白含量。
八、Western blot法檢測蛋白表達
取50 μg蛋白質,使用十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離,380 mA橫定電流轉膜1 h;5%脫脂奶粉室溫封閉1 h;加入一抗4度過夜;使用TTBS洗膜5 min×3次;加入二抗室溫孵育1 h,使用TTBS洗膜5 min×3次;加入ECL發光液,使用Amersham Imager 6000化學發光成像儀記錄結果。
九、四甲基偶氮唑藍法(MTT)檢測細胞增殖
細胞常規消化、計數后接種于96孔板,每孔接種3 000個細胞,每組設5個復孔。于接種1天、3天和5天后,每孔加入20 μL MTT(5 mg/mL),繼續培養4 h。棄上清后,每孔加入200 μL二甲基亞砜(DMSO),振蕩1 min后,檢測OD490 nm處的吸光度值。
十、克隆形成實驗
細胞常規消化、計數后接種于24孔板,每孔接種500個細胞,每組設3個復孔。于接種7天后,棄上清,每孔加入100 μL結晶紫染料,5 min后,沖洗孔板并拍照計數。
十一、流式細胞術檢測細胞周期
細胞常規消化后,75%乙醇固定過夜。離心后采用細胞周期染色液室溫孵育15分鐘,使用流式細胞儀檢測周期。
十二、統計學方法
采用Graph Pad Prism 7.0軟件進行統計學分析。計量資料如果呈正態分布,比較采用單因素或兩因素方差分析,組間兩兩比較采用LSD方法。檢驗水準為α=0.05。
結 果
一、RBPMS在小鼠結腸炎相關結腸癌模型中表達升高
AOM-DSS模型能夠有效模擬人的結腸炎相關結腸癌病程。小鼠模型不同時期結腸全基因組芯片數據顯示,RBPMS的表達水平在結腸炎相關結腸癌發生與發展過程中逐漸升高(t=7.165,P<0.01)(圖1)。提示RBPMS可能與結腸炎相關結腸癌的發生與發展有關。進一步通過免疫組織化學染色法檢測小鼠結腸癌組織中RBPMS蛋白的表達,結果顯示腫瘤組織中該蛋白的表達顯著高于癌旁組織(圖2)。
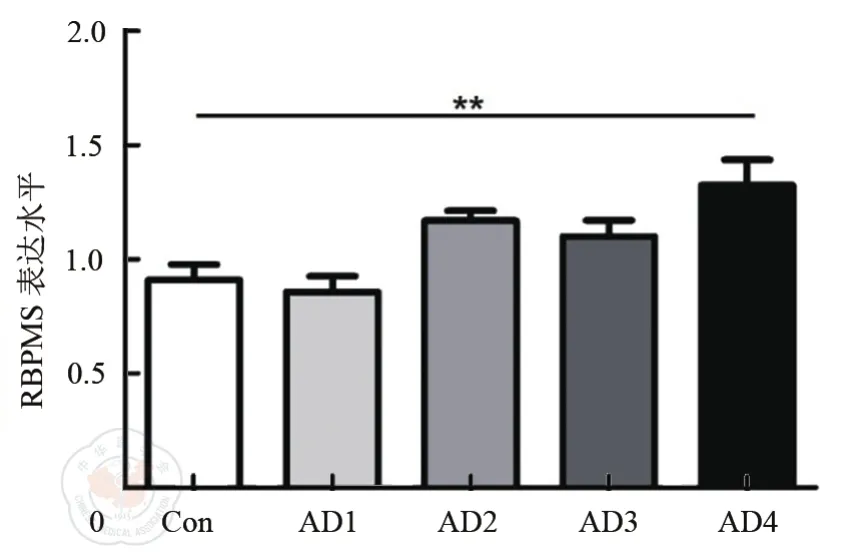
圖1 AOM/DSS小鼠結腸炎相關結腸癌模型中RBPMS表達水平的芯片檢測結果。AD1:急性炎癥恢復期;AD2:輕度不典型增生;AD3:腺瘤;AD4:腺癌。**P<0.01。
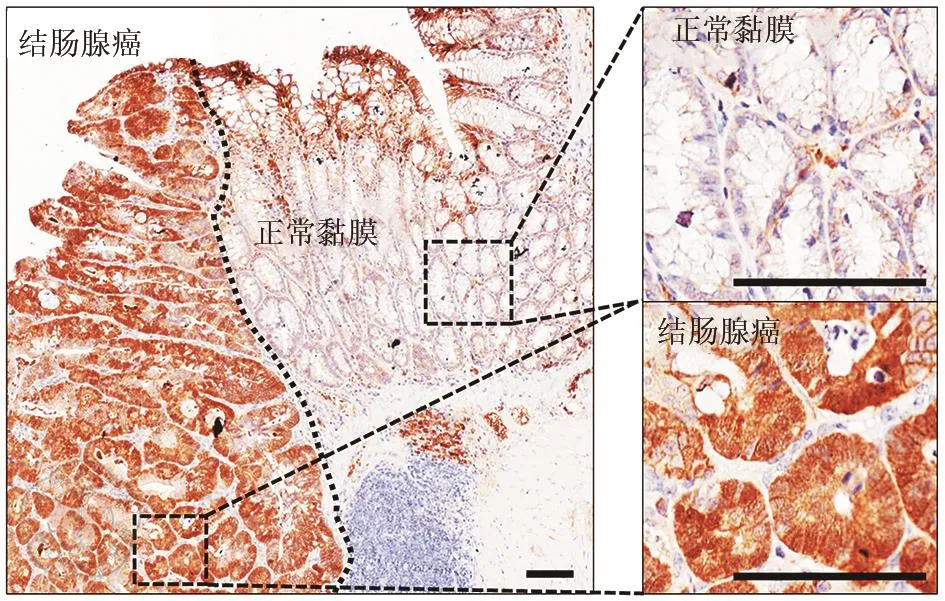
圖2 免疫組織化學染色檢測AOM/DSS小鼠結腸炎相關結腸癌模型中RBPMS表達。(標尺:100 μm)
二、RBPMS特異性小干擾RNA效率檢測
將小干擾RNA瞬時轉染HCT116細胞,72 h后收集細胞總蛋白質,Western blot檢測RBPMS的表達。Western blot檢測顯示si-RBPMS#2和si-RBPMS#3能夠顯著降低RBPMS的表達水平(圖3)。
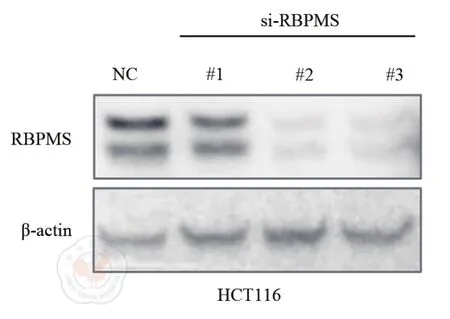
圖3 Western blot檢測RBPMS特異性小干擾RNA的敲降效率
三、敲降RBPMS抑制結腸癌細胞增殖和克隆形成能力
隨后,進一步檢測敲降RBPMS對結腸癌細胞增殖和克隆形成的影響。結果顯示,敲降RBPMS能夠顯著抑制HCT116細胞的增殖能力(圖4)。對照組細胞的克隆形成數為(226±25)個。敲降RBPMS組的細胞克隆形成能力顯著降低,克隆形成數分別為(167.7±12.5)個(t=3.615,P<0.05),(103.3±8.6)個 (t=8.034, P<0.01)和 (82.6±10.7)個(t=9.13,P<0.001)(圖5)。
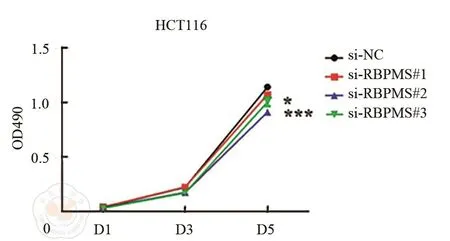
圖4 MTT法檢測敲降RBPMS對細胞增殖的影響。*P<0.05,***P<0.001

圖5 敲降RBPMS對細胞克隆形成能力的影響。5A:克隆形成實驗結晶紫染色代表性結果圖片;5B:各組克隆形成數量統計結果。*P<0.05,**P<0.01,***P<0.001
四、敲降RBPMS影響結腸癌細胞細胞周期
通過流式細胞術檢測敲降RBPMS對結腸癌細胞細胞周期的影響。結果顯示,使用siRNA敲降RBPMS,處于G1期的細胞比例由(79.65±1.17)%上升為(88.61±1.21)%(t=4.564,P<0.05),(83.65±2.49)%(t=2.784,P<0.05)和(83.52±1.34)%(t=3.763,P<0.05);而處于S期的細胞比例由(10.43±0.48)%下降為(5.73±1.2)%(t=3.634,P<0.05),(6.17±0.83)%(t=4.044, P<0.05) 和 (5.47±1.16)% (t=3.952,P<0.05)。敲降RBPMS能夠造成HCT116細胞G0/G1期阻滯,且S期細胞比例顯著降低(圖6)。
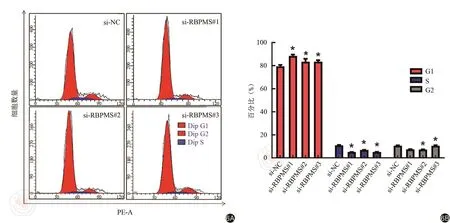
圖6 流式細胞術檢測敲降RBPMS對細胞周期的影響。6A:流式細胞術檢測周期結果圖;6B:各組G1期、S期和G2期統計結果圖。*P<0.05
討 論
RNA選擇性剪接是多外顯子基因組中翻譯蛋白多樣性的重要機制,通過選擇性地對前體mRNA剪接位點的組合加工,形成不同的成熟mRNA,可以使一個基因翻譯成不同結構和功能的異構體,進而改變功能結構域,親和力及穩定性[11-12]。約90%的基因存在選擇性剪接,且60%的剪接產生的異構體編碼不同的蛋白[13]。選擇性的對前體mRNA剪接位點的組合加工,形成不同的成熟mRNA,可以使一個基因翻譯成不同結構和功能的異構體,進而改變功能結構域,親和力及穩定性[14]。例如:BCL2L1 pre-mRNA選擇性剪接產生的BCL-XL在很多腫瘤中是抗凋亡功能,而腫瘤中低表達的BCL-XS則有明顯的促凋亡作用[14-16]。在腫瘤的發生與發展過程中任何作用蛋白的變化、作用元件或剪切位點的突變都會導致促癌基因或抑癌基因的異常剪接,導致細胞的惡性轉化[17],過度增殖[18],轉移[18]及藥物抗性增強[19]等。
本研究發現在結腸炎相關結腸癌組織中RBPMS mRNA表達水平升高,并且敲降該基因可以顯著抑制結腸癌細胞系HCT116的增殖和克隆形成能力。進一步研究發現敲降RBPMS造成結腸癌細胞G0/G1期阻滯,S期細胞減少。這提示RBPMS可能發揮癌基因的作用。但是目前關于RBPMS在腫瘤中的作用報道較少,大多數研究顯示該基因可能發揮抑癌基因的作用。在多發性骨髓瘤(multiple myeloma,MM),其低表達與晚期MM相關,EZH2通過啟動子的甲基化在轉錄水平抑制RBPMS的表達,并參與耐藥過程[20-21]。而且,RBPMS調控 MYC, Bcl-2, p15INK4b, p21CIP1/WAF1,p57KIP2等基因的表達抑制細胞增殖、促進細胞凋亡[22-23]。雖然RBPMS在結腸癌中的促癌作用還需要進一步的驗證,但是我們的研究提示該基因在不同的腫瘤中,可能發揮截然不同的作用。未來我們需要更多的研究明確結腸炎相關結腸癌中RBPMS的靶基因及其調控機制。

