桑枝多糖基于YAP/TAZ 信號通路調控db/db 小鼠腎纖維化作用的研究
余文勝 黃 飛 鄭 妮
糖尿病腎病(DN)是糖尿病常見的、嚴重的微血管并發癥,且超過三分之一的糖尿病患者伴發DN,并最終發展為終末期腎臟疾病(ESRD),成為糖尿病致死、致殘的主要因素[1]。DN 臨床治療較為棘手,且尚缺乏特異性、針對性的治療藥物,目前主要以血糖控制為基礎,聯合抗氧化、血管緊張素轉化酶抑制劑和鈣拮抗劑等藥物進行綜合治療,但從臨床療效上看,目前的治療方案只是減緩腎功能減退及腎纖維化的發展,仍難以阻止其病程進展[2-3]。
桑枝Mori Ramulus 是桑科植物桑Morus alba L.的干燥樹枝,具有祛風活絡、通利關節、燥濕利水、降血糖降血脂以及提高機體免疫功能等多種藥效[4-5]。桑枝多糖為桑枝的主要成分之一,課題組前期研究結果表明,桑枝多糖具有良好降血糖,增強糖尿病小鼠腎臟抗氧化能力,改善氧化應激對腎組織損傷的作用[6],但其對DN 的作用機制并未完全闡明。本研究以自發型2 型糖尿病db/db 小鼠為DN 模型,探究桑枝多糖對DN 的作用機制。
1 實驗材料
1.1 動 物 24 周齡db/db 小鼠40 只,db/m 小鼠10 只,SPF 級,雌雄各半,體質量(47.27±1.62)g,購自江蘇集萃藥康生物科技股份有限公司,實驗動物使用許可證:SYXK(蘇)2018-0027,實驗動物生產許可證:SYXK(蘇)2018-0008。小鼠飼養于通風良好的環境,室溫18~25℃,相對濕度40~70%,12h 光照晝夜循環。
1.2 藥 物 本研究應用的桑枝經廣西中醫藥研究所鑒定。桑枝多糖制備[7]:干燥桑枝1kg,粉碎成粗粉,使用6000mL 80%的乙醇溶液,85℃下回流提取4次,每次2h,過濾,濾液減壓至無醇味,加2000mL 雙蒸水,煮3 次,每次2h,過濾,合并濾液,10000pr/min離心10min,用微波真空干燥器濃縮,得濃縮液250mL,經氯仿-正丁醇(5∶1)多次萃取后除去蛋白質。提取液4℃過夜,10000pr/min 離心10min,過濾,加入5 倍量95%乙醇,使乙醇終濃度為70%,醇沉24h,抽濾,收集藥渣,濾渣依次用乙醚、無水乙醇、丙酮洗滌3 次,所得藥渣定性測定含粗多糖。將多糖粗品溶于水,加樣到經PBS 緩沖液(pH=7.8)處理的樹脂層析柱中,靜止12h,用雙蒸水以2mL/min 流速進行洗脫,合并洗脫液,真空干燥得桑枝多糖。經紫外-可見分光計測定樣品中的桑枝多糖純度達85.6%;纈沙坦,海南皇隆制藥股份有限公司,批號191205。
1.3 試 劑 腫瘤壞死因子-α(TNF-α)、白介素-1β(IL-1β)、轉化生長因子-β1(TGF-β1)、纖維連接蛋白(FN)、膠原Ⅰ型(CollagenⅠ)ELISA 試劑盒,上海酶聯生物科技有限公司,批號200720、200811、200705、200716、200818;單核細胞趨化蛋白-1(MCP-1)、結締組織生長因子(CTGF)ELISA 試劑盒,圣克魯斯生物技術(上海)有限公司,批號Sc-52734、Sc- 102086;兔抗人Yes 相關蛋白(YAP)、TEAD 多克隆抗體,美國Cell Signaling Technology 公司,批號20271、20397。
1.4 主要儀器 9602A-酶標儀(北京艾普生設備有限公司);全自動生化分析儀(日立公司,7100);Gel doc200 低溫高速離心機(上海安亭科學儀器廠);垂直電泳儀(BIO-RAD 公司);轉膜及顯影設備(BIORAD 公司);羅氏卓越型血糖儀(ACCU-CHEK Performa)。
2 實驗方法
2.1 動物分組及給藥 自發型2 型糖尿病24 周齡db/db 小鼠40 只,24 周齡db/m 小鼠10 只,均雌雄各半。使用隨機數字表法將db/db 小鼠分為模型組、纈沙坦組(20mg/kg)、桑枝多糖低劑量組(600mg/kg)、桑枝多糖高劑量組(1200mg/kg),每組10 只,日常進行高脂飲食喂養,連續灌胃相應藥物60 天,每天1 次。db/m 小鼠為空白組,日常進行普通飼料喂養,模型組與空白組小鼠灌胃等體積生理鹽水60 天。
2.2 HE 染色方法 將制作好的腎臟蠟塊切片,切片厚度4μm,切片用二甲苯脫蠟,置于二甲苯與純乙醇混合液中,乙醇逐級脫水,蘇木精染液染色,水洗及0.5%鹽酸乙醇分色,蒸餾流水沖洗,伊紅染液染色,乙醇逐級脫水后二甲苯透明,封片。觀察小鼠腎組織病理學變化。
2.3 生化指標檢測 于第60 天采集小鼠尿液,測量尿量,采用終點法測24h 尿白蛋白(UP)含量;末次給藥后,小鼠禁食不禁水12h,使用血糖儀檢測小鼠空腹血糖(FBG);眼眶靜脈取血,高速冷凍離心分離血清,使用全自動生化分析儀測定小鼠血清肌酐(Scr)、尿素氮(BUN)含量。
2.4 ELISA 法檢測小鼠腎組織纖維化指標 剝離小鼠腎組織,低溫條件下將其制成約10%的勻漿液,按ELISA 試劑盒說明書操作,檢測小鼠腎組織TGFβ1、FN、CTGF、CollagenⅠ表達及炎癥因子TNF-α、IL-6、MCP-1 表達量。
2.5 蛋白免疫印跡法檢測小鼠腎組織YAP、TAZ 表達量 剝離小鼠腎組織,低溫條件下將其制成約10%的勻漿液,冰浴靜置30min,高速冷凍離心機中離心5min,分離上清液,提取腎組織總蛋白。在SDSPAGE 膠上加入Marker 及檢測蛋白,轉移至PVDF膜后加5%脫脂奶粉,洗膜,加入一抗(1∶500),4℃低溫環境下孵育過夜,洗膜,加入稀釋的二抗(1∶2000),低溫靜置孵育60min,洗膜,暗室中曝光顯影。電泳成像分析系統掃描、分析蛋白條帶。
3 實驗結果
3.1 桑枝多糖對db/db 小鼠FBG 的影響 與空白組比較,給藥前各組小鼠FBG 均明顯上升,給藥后,桑枝多糖低、高劑量組小鼠FBG 有所下降,但仍高于空白組(P<0.05)。與模型組給藥后比較,纈沙坦組小鼠FBG 無明顯改變(P>0.05),桑枝多糖低、高劑量組小鼠給FBG 均明顯降低(P 均<0.05)。見表1。
表1 桑枝多糖對db/db 小鼠FBG 的影響(mmol/L,)

表1 桑枝多糖對db/db 小鼠FBG 的影響(mmol/L,)
注:空白組為db/m 小鼠,予生理鹽水;模型組為自發型2 型糖尿病db/db 小鼠,予生理鹽水;纈沙坦組為自發型2 型糖尿病db/db 小鼠予20mg/kg 纈沙坦混懸液;桑枝多糖低劑量組為自發型2 型糖尿病db/db 小鼠予600mg/kg 桑枝多糖混懸液;桑枝多糖高劑量組為自發型2型糖尿病db/db 小鼠予1200mg/kg 桑枝多糖混懸液;FBG 為空腹血糖;與空白組同期比較,aP<0.05;與本組給藥前比較,bP<0.05;與模型組給藥后比較,cP<0.05
3.2 桑枝多糖對db/db 小鼠24h 尿量、UP 及血清Scr、BUN 的影響 與空白組比較,模型組小鼠24h尿量、UP 含量及血清Scr、BUN 含量明顯升高(P 均<0.05)。與模型組比較,纈沙坦組及桑枝多糖低、高劑量組小鼠24h 尿量、UP 含量及血清Scr、BUN 含量均明顯降低(P 均<0.05)。見表2。
表2 桑枝多糖對db/db 小鼠24h 尿量、UP 及血清Scr、BUN 的影響()

表2 桑枝多糖對db/db 小鼠24h 尿量、UP 及血清Scr、BUN 的影響()
注:空白組為db/m 小鼠,予生理鹽水;模型組為自發型2 型糖尿病db/db 小鼠,予生理鹽水;纈沙坦組為自發型2 型糖尿病db/db 小鼠予20mg/kg纈沙坦混懸液;桑枝多糖低劑量組為自發型2 型糖尿病db/db 小鼠予600mg/kg 桑枝多糖混懸液;桑枝多糖高劑量組為自發型2 型糖尿病db/db 小鼠予1200mg/kg 桑枝多糖混懸液;UP 為尿白蛋白;Scr 為血清肌酐;BUN 為尿素氮;與空白組比較,aP<0.05;與模型組比較,bP<0.05
3.3 桑枝多糖對db/db 小鼠腎組織病理學變化 腎臟病理切片結果顯示,空白組小鼠腎小球數量多,分布廣泛,其結構飽滿完整。模型組小鼠腎小球囊腔內皺縮嚴重,腎小球基底膜均質性增厚且出現大量空泡及細胞核固縮現象,數量較少。纈沙坦及桑枝多糖低、高劑量組小鼠腎小球囊腔皺縮程度減少,仍有空泡出現,腎小球數量較模型組多。見圖1。

圖1 桑枝多糖對db/db 小鼠腎組織病理學變化(HE 染色×400)
3.4 桑枝多糖對db/db 小鼠腎組織炎癥因子、趨化因子的影響 與空白組比較,模型組小鼠腎組織炎癥因子TNF-α、IL-6、MCP-1 含量顯著升高(P 均<0.05)。與模型組比較,纈沙坦組及桑枝多糖低、高劑量組小鼠腎臟TNF-α、IL-6、MCP-1 含量明顯降低(P 均<0.05)。見表3。
表3 桑枝多糖對db/db 小鼠腎組織炎癥因子、趨化因子的影響(ng/L,)

表3 桑枝多糖對db/db 小鼠腎組織炎癥因子、趨化因子的影響(ng/L,)
注:空白組為db/m 小鼠,予生理鹽水;模型組為自發型2 型糖尿病db/db 小鼠,予生理鹽水;纈沙坦組為自發型2 型糖尿病db/db 小鼠予20mg/kg 纈沙坦混懸液;桑枝多糖低劑量組為自發型2 型糖尿病db/db 小鼠予600mg/kg 桑枝多糖混懸液;桑枝多糖高劑量組為自發型2型糖尿病db/db 小鼠予1200mg/kg 桑枝多糖混懸液;TNF-α 為腫瘤壞死因子-α;IL-6 為白介素-6;MCP-1 為單核細胞趨化蛋白-1;與空白組比較,aP<0.05;與模型組比較,bP<0.05
3.5 桑枝多糖對db/db 小鼠腎組織纖維指標的影響與空白組比較,模型組小鼠腎組織TGF-β1、FN、CTGF、CollagenⅠ含量顯著升高(P 均<0.05)。與模型組比較,纈沙坦組及桑枝多糖低、高劑量小鼠腎臟TGF-β1、FN、CTGF、CollagenⅠ含量明顯降低(P 均<0.05)。見表4。
表4 桑枝多糖對db/db 小鼠腎組織纖維指標的影響(ng/mL,)
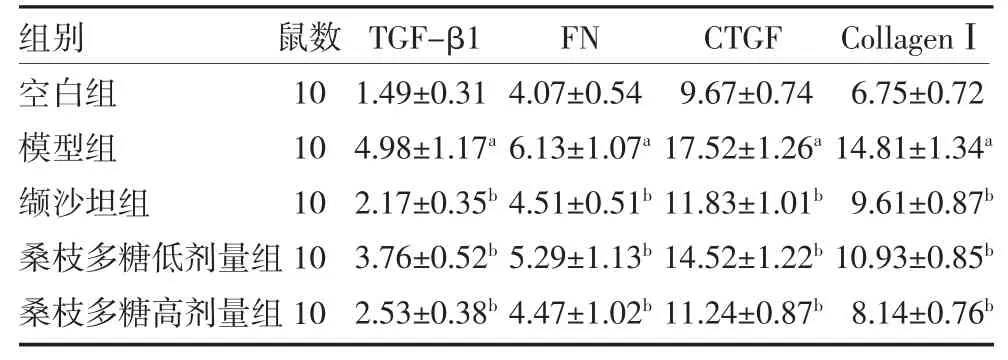
表4 桑枝多糖對db/db 小鼠腎組織纖維指標的影響(ng/mL,)
3.6 桑枝多糖對db/db 小鼠腎組織YAP、TAZ 表達的影響 與空白組比較,模型組小鼠腎組織YAP、TAZ 蛋白表達顯著增加(P 均<0.05)。與模型組比較,纈沙坦組及桑枝多糖低、高劑量小鼠腎組織YAP、TAZ 蛋白表達降低(P<0.05)。見表5、圖2。

圖2 桑枝多糖對db/db 小鼠腎組織YAP、TAZ 表達的影響
表5 桑枝多糖對db/db 小鼠腎組織YAP、TAZ 表達的影響()

表5 桑枝多糖對db/db 小鼠腎組織YAP、TAZ 表達的影響()
4 討論
DN 發病機制復雜,主要由于長期的高血糖影響,造成腎小球血流動力學的改變、引起腎小球高壓,腎臟系膜細胞受刺激后增殖、肥大,使基質增生[8]。同時腎素-血管緊張素-醛固酮系統(RAAS)的過度活躍和大量活性氧、炎癥因子的生成,導致腎小球足細胞損傷、提高腎臟細胞外基質(ECM)的增殖水平,促使腎臟的炎癥及纖維化的發生[9]。腎臟纖維化是DN 進入終末期的病理過程,其病程一般分為五期,主要以腎小球濾過率、腎小球毛細血管基底膜的厚度及寬度、蛋白尿、腎小管間質纖維化、腎小球硬化等指標判斷病程的發展。
腎小球和腎小管的巨噬細胞炎性浸潤及其大量聚集,是糖尿病腎損傷的主要病理特征[10]。在高糖環境下,單核細胞在黏附分子ICAM-1、VCAM-1 及趨化蛋白MCP-1 的作用下遷移到腎臟微環境,分化為巨噬細胞及進一步活化,釋放炎癥因子TNF-α、IL-6及纖維化因子TGF-β1 等細胞因子,加重腎組織的炎癥反應,誘導腎臟局部慢性亞臨床腎炎,促使腎小球系膜細胞對ECM 的分泌增加,進而引起成纖維細胞的增殖,系膜細胞外基質沉淀腎小球硬化及間質纖維化,促進糖尿病腎纖維化的發展[11-12]。
YAP/TAZ 復合物是對進化上有著高度保守的Hippo 信號通路的核心元件,其對器官大小的調控,腎臟成纖維細胞增生,肌成纖維細胞生成、分化、凋亡等重要的生物學過程均發揮著重要的作用。其中YAP 是調節細胞的增殖、分化及介導上皮間質轉化的關鍵因子。腎臟正常狀態下,磷酸化的YAP 與14-3-3 調控蛋白結合,調控CTGF、FN、CollagenⅠ等下游靶因子的表達,維持細胞生存平衡[13]。腎臟高糖內環境下,去磷酸化的YAP 會從細胞質向細胞核遷移且活化,與組織TEAD 相互作用,激活重要的纖維因子CTGF,促進細胞增殖和細胞外基質合成,以腎纖維化的方式修復慢性腎臟疾病的腎臟損傷[14]。TAZ 是YAP 的同源蛋白,在DN 的進展中發揮重要作用。研究表明,TAZ 在腎臟足細胞和腎小管上皮細胞的高表達,可激活纖維蛋白CTGF 的表達,進一步加重DN 的腎纖維化[15]。另外,由于YAP 誘導腎小管TGFβ1 表達,進而刺激HK-2 細胞,導致TAZ 蛋白表達增加,引發HK-2 細胞的增殖缺陷,介導細胞增殖和細胞外基質合成及腎纖維化的形成[16]。
實驗結果表明,桑枝多糖能有效改善DN 小鼠腎功能及腎組織的病理變化,減低腎臟間質纖維化指標TGF-β1、FN、CTGF、CollagenⅠ、炎癥因子TNFα、IL-6 及趨化蛋白MCP-1 含量,以減緩腎臟間質纖維的形成;同時降低腎組織YAP、TAZ 表達。提示,桑枝多糖可能通過調節腎組織YAP、TAZ 的蛋白表達,及抑制YAP/TAZ 信號通路下游的趨化蛋白MCP-1、纖維化指標TGF-β1、FN、CTGF、CollagenⅠ及炎癥因子TNF-α、IL-6 生成,減緩腎臟間質纖維的形成及炎癥因子對腎組織的攻擊損害,降低細胞外基質合成,達到抗纖維化的作用。

