內鏡黏膜下剝離術治療早期胃癌患者的臨床效果
汪剛
近幾年以來,伴隨著不斷進步的交叉學科及科學技術,臨床中的消化內鏡也顯著進步及發展,相繼出現了很多的全新內鏡技術并在臨床中應用,如超聲內鏡(EUS)、放大內鏡、染色內鏡、窄帶成像(NBI)及激光顯微內鏡等[1]。上述內鏡技術的出現及應用,使得臨床中對胃癌早期患者的診療水平顯著提高,同時也提高了在早期檢出胃癌的比率[2]。但臨床中的消化道腫瘤患者主要為中老年群體,尤其是針對其中的高齡胃癌患者,通常會合并存在各種基礎性的疾病,因此使得手術風險顯著增加,不適宜使用外科切除術治療[3]。使用胃腸鏡及腹腔鏡等內鏡技術來實施微創治療,理論方面可以完全切除病灶,且創傷更小、在術后所需的恢復時間更短[4]。本次研究選取本院2016年3月-2017年3月確診并治療的64例早期胃癌患者,回顧性分析如下。
1 資料與方法
1.1 一般資料
選取本院2016年3月-2017年3月確診并治療的64例早期胃癌患者進行回顧性分析。納入標準:(1)胃鏡結果顯示存在胃黏膜病變,且病理組織學結果顯示存在癌腫;(2)未發生淋巴結轉移。(3)研究組符合文獻[5]日本胃癌學會的相關內鏡黏膜下剝離術(ESD)適應證,即不限腫瘤大小,無潰瘍型;直徑≤30 mm,有潰瘍型;直徑≤30 mm,無潰瘍型,無血行及淋巴結轉移,浸潤至sm1;直徑<20 mm,有潰瘍型;(4)患者均自愿原則決定手術方式。排除標準:(1)術前臨床診斷為早期胃癌,但是術后病理組織學顯示為非早期胃癌;(2)合并相關血液病;(3)合并凝血功能或機制不全及障礙;(4)長期服用抗凝劑藥物;(5)不能耐受全身麻醉;(6)合并臟器功能不全及障礙;(7)合并其他惡性腫瘤疾病。依據手術方式分為對照組(32例)和研究組(32例)。對照組年齡(64.2±5.6)歲;男23例,女9例;病灶位置:胃下部18例,胃中部4例,胃上部10例。研究組年齡(64.4±5.1)歲;男24例,女8例;病灶位置:胃下部17例,胃中部6例,胃上部9例。兩組基線資料比較差異無統計學意義(P>0.05),有可比性。研究經倫理委員會批準。
1.2 方法
1.2.1 研究組 采用內鏡黏膜下剝離術(ESD)。(1)明確病變范圍及位置。通過胃鏡輔助確定病變位置,然后使用特殊的其他內鏡技術來對待病變范圍進行確定。(2)對病變范圍進行電凝標記。確認病變范圍及位置后,使用不同的方式如針形刀、Flex刀及氬氣刀等,在與病變距離約5 mm的位置實施逆時針或順時針的電凝標記,形狀為環形點狀。標記點與標記點的間隔距離為2 mm左右。(3)黏膜下注射液(甘油果糖溶液):在病灶邊緣的標記點位置外側,使用黏膜下注射液(含腎上腺素適量)進行黏膜下多處注射,抬舉病變。(4)對病變的周圍黏膜組織進行環形切開。順著標記點的外緣來將胃黏膜層切開,直至胃黏膜的下層組織。先切開病變肛側黏膜,然后切開病變口側,在切開過程當中切緣避免累及到病變組織。(5)剝離。在內鏡鏡頭上安裝透明帽,依據不同患者的實際情況來選取不同的刀具:針刀、勾刀或IT刀,實施黏膜下剝離,將病灶組織大塊、完整切除。在黏膜下剝離的過程當中,依據實際情況的需要來多次補充黏膜下注射液。假如在擁有豐富血管的黏膜肌層當中實施剝離,既有可能會影響剝離效果,還會增加患者的出血風險。在實施剝離操作的過程當中創面如果出血,可進行電凝或金屬夾止血。(6)處理創面。將病變完整剝離后,對創面血管使用電凝或金屬夾止血處理。常規將標本組織送檢進行病理學組織檢查。
1.2.2 對照組 采用外科切除術。所有患者均由固定的1名外科醫師來完成操作,患者在進行外科切除術過程中全部都遵循臨床中腫瘤根治規則。依據不同的患者的腫瘤位置不同,為患者選擇具體的手術方法:全胃切除術、胃大部近端根治性切除術及胃大部遠端根治性切除術。常規將標本組織送檢進行病理學組織檢查。
兩組術后均同樣進行處理:(1)待患者麻醉完全清醒之后,協助患者呈半臥位,避免發生誤吸。(2)常規禁食,同時給予患者實施持續性2~3 d的胃腸減壓,并對出量及入量進行記錄。(3)維持患者體內的水電解質平衡及確保營養。假如合并出現貧血時,及時進行對癥干預。(4)抗生素預防性的使用。(5)恢復胃腸道功能后可進食流食,并慢慢地進行過渡,直至正常的飲食。
1.3 觀察指標及評價標準
(1)兩組術中及術后指標:手術時間、術中出血量、輸血例數及住院時間。(2)兩組療效指標:治愈性切除率及3年生存率。治愈性切除評價標準:①病灶未浸潤淋巴脈管;②病灶基底及側切緣均未殘留瘤細胞[6]。術后叮囑患者定期到院復診,觀察并分析兩組生存情況。(3)兩組并發癥發生情況。
1.4 統計學處理
本研究數據采用SPSS 22.0統計學軟件進行分析和處理,計量資料以(±s)表示,采用t檢驗,計數資料以率(%)表示,采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組術中及術后指標比較
研究組手術時間及住院時間顯著短于對照組(P<0.05);研究組術中出血量及輸血占比低于對照組(P<0.05),見表1。
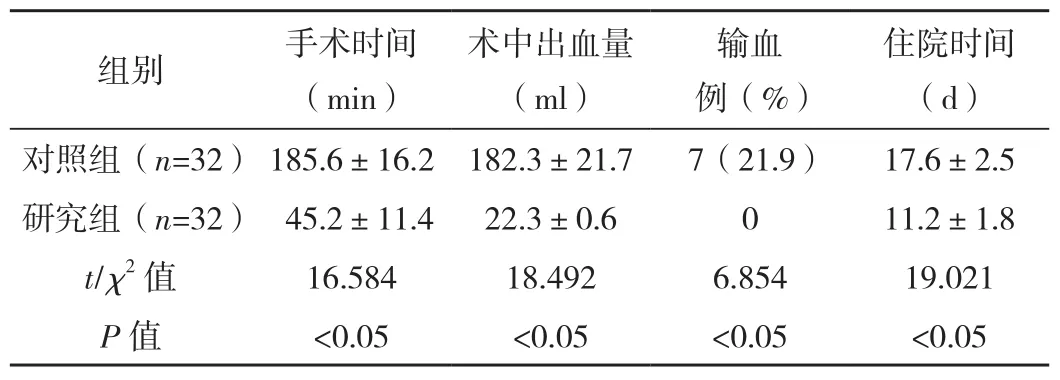
表1 兩組術中及術后指標比較
2.2 兩組療效比較
兩組治愈性切除率及3年生存率比較差異無統計學意義(P>0.05),見表 2。
2.3 兩組并發癥發生情況比較
研究組并發癥發生率顯著低于對照組(P<0.05),見表3。

表3 兩組并發癥發生情況比較 例(%)
3 討論
臨床中較為常見的一種惡性腫瘤就是胃癌,其在臨床當中的死亡率十分高,嚴重威脅患者的生命健康[7]。導致胃癌患者較差預后的原因主要為未能及時給予早期患者進行有效的篩查,使得絕大部分胃癌患者在被臨床確診時就已經發展到中期或晚期,不利于臨床治療。日本胃腸內鏡學會對早期胃癌的定義為腫瘤未對肌層產生浸潤,且局限在黏膜下層或黏膜中,不管是否存在淋巴結浸潤現象[8]。假如可以給予患者在病情早期進行有效的治療干預,可顯著提高早期胃癌的生存率,改善預后。既往臨床中人們缺乏清晰認識局部早期胃癌淋巴結轉移的情況,以為僅能夠通過外科手術才能夠治愈,這一觀念至今依舊普遍存在在胃癌患者當中。因此,本次研究將自愿選擇外科切除術的早期胃癌患者診療資料作為對照組。
雖然外科切除術能夠有效地根治早期胃癌患者,但是,在手術過程當中會對患者造成很大的創傷,會顯著降低患者的圍手術期生活質量水平。且在術后患者會出現較多的并發癥,進而使患者整體生活質量水平嚴重降低。所以,針對早期胃癌患者其存在較低淋巴結遠處轉移及轉移風險時,較好的一個治療選擇就是內鏡治療,尤其是臨床中不斷發展的ESD術,使得內鏡治療早期胃癌的適應證范圍持續擴大,成為更多早期胃癌患者的關注重點及熱點[9]。
ESD主要指的是通過染色劑來對病灶組織進行染色標記,然后再通過絕緣刀順著標記位置將病灶組織進行切開,完整剝離病灶組織[10]。同時,ESD還能夠依據不同患者的實際情況進行具有個體化針對性的臨床治療、且患者更易耐受、創傷性小,可多次進行治療、對多部位進行治療。ESD還可以在治療過程中獲得完整性的病理標本組織,對病理組織情況進行分析,如是否發生轉移、分化情況、浸潤深度及分期等,為制定后續治療方案提供重要的參考資料[11]。除此之外,ESD還能夠將面積較大、不規則形態的瘢痕或潰瘍腫瘤完整一次性切除,進而降低殘留腫瘤組織的風險,使得術后復發率降低[3]。本次研究結果提示,兩組治愈性切除率及3年生存率比較差異無統計學意義(P>0.05)。結果提示,ESD術在短期療效方面跟外科切除術可以獲得相當的效果。
與此同時,本次研究結果還提示,研究組手術時間及住院時間比對照組顯著更短(P<0.05);研究組術中出血量及輸血占比顯著低于對照組(P<0.05)。早期胃癌患者使用ESD術進行治療時,可將手術時長及住院時間顯著性的縮短,促使患者更快康復。所以,針對存在外科手術禁忌的早期胃癌患者來說,在術前進行充分、全面性的評估,確認符合ESD適應證時,可獲得理想的療效[12]。
本次研究結果提示,研究組并發癥發生率水平顯著低于對照組(P<0.05)。可能的原因為,在實施ESD術時,并不會對胃部的正常的生理解剖結果進行破壞及損傷,僅實施黏膜下病灶剝離。恰當的操作干預能夠使得剝離創面有效愈合,從而使得胃部能夠恢復正常的功能,因此并發癥更少。研究指出,ESD術術后最常見的并發癥就是穿孔及活動性出血[13]。但是值得注意的是,研究組所有并發癥僅為術后活動性出血,并未發生穿孔病例。分析其可能的原因為:(1)此次研究所納入的樣本數量偏小;(2)染色技術能夠進一步在內鏡當中顯現固有肌層,有效避免在手術過程中對固有肌層產生損傷;(3)假如在手術過程中對固有肌層產生損傷,在發生穿孔前使用金屬夾進行連續性的夾閉,有效地預防了發生穿孔。雖然ESD術屬于一種微創手術,但是依舊會對機體產生創傷。依據臨床外科準則,ESD術的手術切口為Ⅱ類切口,所以,在手術后一定要給予患者預防性地應用相關抗生素藥物,避免發生嚴重性的后果,尤其是針對合并體弱、年齡較大、免疫力低下、合并糖尿病者,更加需要注意[14]。
綜上所述,給予早期胃癌患者使用ESD術治療,相比傳統外科切除術,治愈性切除率水平及3年生存率水平相當,且并發癥更低,手術時間更短,因手術而造成的創傷更少。

