γ-聚谷氨酸的生物合成及提取工藝
荀順義,朱 海,劉 慶,單繼軍
(博瑞生物醫藥泰興市有限公司,江蘇泰興 225400)
1 攪拌轉速對γ-PGA合成的影響分析
攪拌轉速對γ-PGA合成影響較強,會影響生物反應機制以及氧傳遞,因此,也稱為生物合成γ-PGA以及提升產率的重要問題。國外研究發現,提高轉速以及采用高純氧,能夠有效控制容量,以解決該問題,提升γ-PGA的生產速率。高轉速對于發酵體系傳質來說具有重要作用,但較高轉速也會形成剪切力作用,對培養群體細胞產生不利影響。之外,攪拌轉速較大,還會形成大量泡沫,使發酵體積增加,對于發酵來說是不利的,因此,研究非流動型流體發酵參數,利于優化發酵過程,提高γ-PGA產率。本研究在5L發酵罐中分析了不同轉速對于分批發酵γ-PGA的影響,具體如下。
1.1 實驗材料
在本研究中所使用的實驗儀器,包括電子天平、5升發酵罐、恒溫搖床、紫外檢測器、生物傳感器、電熱恒溫干燥箱、精密pH計、凝膠滲透色譜柱等。所使用的試劑包括硫酸鎂、硫酸銨、葡萄糖、蛋白胨、牛肉膏、磷酸氫二鉀、谷氨酸鈉等。實驗菌種為Bacillus snbtilis NX2,使用平板基類型,包括斜面基、平板培養基、種子培養基,發酵培養基。
1.2 研究方法
在具體培養中,接菌于斜面和平板培養基中,將其置于32℃,24h培養。接一環菌將其置于50mL種子培養基的三角瓶中,轉速為220r/min,置于32.5℃,培養15h。以5%接種量將種子接種液置于3L發酵培養基的發酵罐中,通氣量為0.8vv m, 溫度設置為32.5℃,通過控制轉速進行發酵。測定細胞生長,包括濁度及細胞干重。測定發酵液中葡萄糖以及谷氨酸濃度,可使用生物傳感器進行測定。
2 研究結果
攪拌轉速對Bsubtilis NX2細胞生長產生的影響。使用不同轉速包括300、400、600、800、1 000r/min,分析在發酵時細胞生長情況,結果發現,轉速會影響細胞生長,提高攪拌轉速,會增加菌體生長速率,達到菌體濃度最大值,使時間有一定程度縮短。當轉速為1 000r/min時,在24h生物量達到最高值。當轉速為300r/min時,生物量在68h可達到最高值,較大攪拌轉速利于發酵液傳質,以及細胞對底物的消耗。由于γ-PGA是在細胞膜中合成,并將其分泌到胞外的,是細胞莢膜的重要成分。莢膜中產物高濃度會影響營養物質進入細胞,進而影響細胞生長代謝、產物合成。攪拌轉速越高時,會使莢膜更快散落,降低莢膜對細胞的營養物質,以及氧傳遞阻礙,因此,根據實驗研究發現,攪拌轉速越高,此時菌體的代謝周期會越短,會促進菌體生長。當轉速為1 000r/min時,此時生物量可達到最高值,濃度為7.72g/L。分別比較不同攪拌轉速下細胞生長曲線以及殘余葡萄糖曲線結構發現,細胞生長與葡萄糖濃度具有一定聯系,在發酵后期葡萄糖逐漸消耗盡之后,細胞衰亡,并且提高攪拌轉速,會加快細胞凋亡速度。
3 攪拌轉速對γ-PGA產率的影響分析
結合上述研究發現,發酵時間延長,會使γ-PGA產量有所降低,主要由于菌體衰亡,γ-PGA降解酶在其中發揮作用。在處于較高轉速下,體系傳輸速度較快,能夠使細胞濃度在短時間內達到飽和,之后衰亡,γ-PGA產率較低。在處于較低攪拌轉速下,體系傳質慢,γ-PGA合成率降低。當轉速為400r/min時,此時PGA的產值最高,其濃度可達到21.78g/L。轉速對γ-PGA平均分子量的影響。γ-PHA以及衍生物加工和應用,從一定程度上是與平均分子量具有緊密聯系的,結合實際生產需求,在發酵過程中γ-PGA平均分子量也是其重要指標。
4 γ-PGA分批發酵動力學分析
當前,國內外針對γ-PGA發酵相關研究較多,大多數集中于菌種選育、合成機理、發酵工藝化等,很少涉及發酵動力學研究。針對γ-PGA生產菌發酵動力學特性研究,包括γ-PGA合成速率和基質濃度變化規律、菌體生長速率等,利于有效控制發酵過程,以提高γ-PGA物質的產率,降低企業生產成本。根據Richarda等人研究表明,PGA和生物聚合物分批發酵模型中觀察,細胞生長無明顯的抑制效果。拓展細胞生長是符合Monod方程的,產物的濃度是擴展細胞與實際細胞濃度差值。利用該實驗構建的模型,沒有考慮外源谷氨酸對于γ-PGA物質合成產生的影響,該模型能夠用于生長發酵期,沒有考慮發酵后期影響。對于本次研究群體Bacillus subtilis NX2為谷氨酸依賴型菌,γ-PGA合成產物的谷氨酸單體來源于外源谷氨酸,少量則來源于葡萄糖。
4.1 研究材料和方法
在本次研究中,所采用的菌種信號為Bacillussubtilis NX-2。由于B.Subtilis為谷氨酸依賴型菌,在無谷氨酸基礎上,無法合成γ-PGA。外源谷氨酸是該菌株γ-PGA前體以及γ-PGA合成的重要活化劑,該群體能夠利用葡萄糖以及谷氨酸合成γ-PGA,具體路徑如圖1所示。
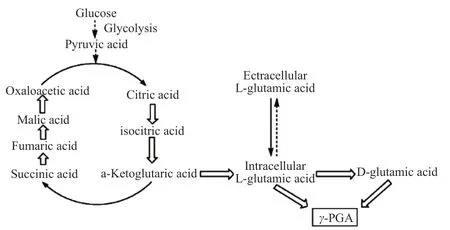
圖1 葡萄糖以及谷氨酸合成γ-PGA路徑
4.2 研究結果
分析γ-PGA分批發酵代謝變化以及動力學。5L發酵罐中初始葡萄糖濃度為40g/L,將其置于32.5℃,400r/min下,分批發酵γ-PGA,如圖2所示。

圖2 γ-PGA分批發酵代謝變化以及動力學變化
根據該結果可以發現,細胞生長與葡萄糖濃度具有緊密聯系的,當耗盡葡萄糖之后,菌體會進入衰亡期,繼續合成,而隨發酵時間延長,會使γ-PGA存在一定程度的降解。分析菌體生長速率以及γ-PGA合成速率隨時間變化,結果發現,γ-PGA物質在發酵中,菌體成長可分為4個階段,包括延遲期、加速生長期、減速期、衰亡期。在菌體合成γ-PGA質時,發酵前期γ-PGA合成是與細胞生長保持同步的,當菌體生長至一定時期,會受多種因素的影響,降低其生長速率,但仍會以較高的速率合成γ-PGA物質,因此,表明γ-PGA物質的合成與細胞生長具有一定聯系。在細胞反應過程中,細胞生長速率降低,主要是由于存在部分物質對細胞生長起到抑制作用。根據γ-PGA濃度對于菌體生長速率產生的影響,可以發現初始葡萄糖濃度為30~60g/L時,細胞增殖濃度理論值與實驗值能夠獲得一定吻合,當葡萄糖的初始濃度為30~50g/L時,利用動力學方程能夠反映γ-PHA的生物合成過程。γ-PGA產率理論值與實驗值相關性為0.99以上,當葡萄糖初始濃度為60g/L,此時γ-PGA產率理論值與實驗值在發酵后期存在一定偏離,表明本研究所構建的模型,在一定程度上能夠準確預測實驗結果。
5 γ-PGA物質的分離提取
5.1 材料和方法
本實驗中使用菌株分批發酵,結合上述實驗方法,通過發酵獲得γ-PGA發酵液,將發酵液稀釋25倍之后,使其光密度值為0.323,濃度對應24g/L,發酵液呈淡黃色。將pH調至3.0,取1L發酵液,分別采用不同孔徑微濾膜處理,比較發酵原液以及透過液菌體含量、產物濃度,計算菌體去除率以及產物損失率。
5.2 實驗結果
pH及溫度對γ-PGA酵液黏度的影響分析。在發酵過程中γ-PGA培養基pH為中性,聚谷氨酸由于側鏈具有游離羧基,導致其帶有負電荷,可作為菌株莢膜重要成分分泌至胞外,因已經替代負電荷菌體,無法聚集,而懸浮于發酵液中。γ-PGA分子量較大,在胞外逐漸積累之下,會使發酵液黏度提高,給菌液分離以及γ-PGA物質分離純化提高難度,通過pH對發酵體系黏度影響,結果發現,pH由7調至3,會降低發酵液的黏度,當pH低于3時,發酵液黏度變化不明顯,在堿性條件下黏度較高。當pH為6時,黏度降低,當pH為3時,黏度達3kcp,主要由于pH會影響γ-PGA分子構象,酸性溶液中γ-PHA分子為β片層結構,中性條件下則為無規卷曲結構,在堿性下為收縮隨機結構,不同pH條件所表現的黏度變化不同。當pH低于4時,溫度對于發酵液體系黏度產生影響不明顯,在常溫下可進行菌液分離以及產物超濾提取。結合pH對γ-PGA物質分子構象產生的影響,可以推測,在酸性條件下,γ-PGA分子相比中性、堿性易于透過微濾膜,因此,選擇pH為3時,進行發酵微濾除菌。
6 結束語
通過實驗探究了不同攪拌轉速對B.subtilis NX-2分批發酵γ-PGA產生的影響,最終選擇了400r/min攪拌轉速,該菌體物質產率較高,可達到21.78g/L,在處于該轉速下,對該菌體γ-PGA代謝變化和動力學分析,構建細胞生長以及產物合成動力學模型,求解模型參數后,獲得γ-PGA分批發酵動力學模型,該模型表明在30~60g/L葡萄糖初始濃度下,細胞增殖濃度理論值與實驗值具有良好吻合度。當初始葡萄糖濃度低于50g/L,γ-PGA生物合成產率理論值和實驗值具有良好吻合,當葡萄糖初始液濃度為60g/L時,此時γ-PGA產率理論值和實驗值在發酵后期存在一定的偏離,將發酵液pH調至3,采用0.8um孔徑微濾膜,其除菌率為70.9%,產物損失率為5%。

