容積激活性氯離子通道蛋白ClC-3表達下調促進H9c2心肌細胞肥大及其機制研究
孫 宇,陳夢青,汪 帥,李艷文,喻 陽,李詠琪,李春梅
心肌肥大的主要特點是心肌細胞體積增大,易引發心律失常,最終導致心力衰竭和心肌梗死等疾病。ClC-3是電壓門控氯通道基因家族成員之一,在心臟、腦等組織中廣泛表達。許多研究表明,ClC-3的功能具有多效性,包括作為容積調節性氯離子通道的關鍵組成部分,能調節細胞體積,保護心肌細胞免受低氧、缺血或肥大時細胞體積過度增加的影響。前期研究表明異丙腎上腺素能誘導大鼠原代心肌細胞、H9c2細胞和C57小鼠ClC-3表達降低,且AAV-9介導的ClC-3過表達小鼠能明顯抑制異丙腎上腺素誘導的心肌肥厚。該研究利用siRNA轉染H9c2心肌細胞構建ClC-3表達下調模型,觀察其對心肌細胞的影響及機制,為研究ClC-3在心臟中的功能提供借鑒,同時也為臨床心肌肥大的防治提供思路。
1 材料與方法
1.1 細胞與主要試劑
H9c2細胞購自上海中國科學院細胞庫。異丙腎上腺素(ISO)購自美國Sigma公司。ClC-3一抗購自英國Abcam公司。siRNA ClC-3及轉染試劑盒購自蘇州瑞博生物有限公司。Bradford蛋白濃度試劑盒、JC-1線粒體膜電位(mitochondrial membrane potential,MMP)試劑盒、細胞骨架染色α-Tubulin一抗均購自北京碧云天生物技術有限公司。DMEM培養基、FBS胎牛血清、0.25%胰酶均購自上海Gibco公司。TRIzol購自大連TaKaRa生物公司。PCR引物由上海生工生物工程有限公司設計并合成。Prime ScriptTMRT Reagent及SYBR PCR Mix購自日本ToYoBo公司。1.2 主要方法
1
.2
.1
細胞培養及分組 大鼠H9c2心肌細胞株在含10%的胎牛血清的DMEM培養基中培養,每2 d更換1次。在37 ℃、5% CO的培養箱中培養傳代,取對數期、生長良好的細胞進行實驗。將2×10個細胞接種于6孔板中,待細胞融合度達到60%~70%時進行轉染。加入小干擾RNA在培養箱中轉染48 h和72 h后,更換為完全培養基繼續培養48 h,采用qRT-PCR和Western blot檢測轉染效率。實驗主要分為4組:空白組、siRNA空載對照組、肥大模型組:ISO(10 μmol/L誘導心肌肥大)以及siRNA轉染敲低ClC-3組。1
.2
.2
Western blot檢測ClC-3蛋白表達 H9c2細胞經100 nmol/L的siRNA轉染不同時間后,提取蛋白,并用Bradford法測定蛋白濃度。加入上樣緩沖液后,用SDS-PAGE電泳分離蛋白樣品,轉膜后用奶粉封閉2 h。4 ℃孵育一抗,過夜后室溫孵育二抗。采用ECL化學發光法檢測。各組蛋白均以GAPDH作為內參校正。1
.2
.3
α-
Tubulin免疫熒光染色 將生長狀態良好的H9c2細胞經胰蛋白酶消化后,接種于帶有細胞小圓玻片的48孔板中,每孔200 μl,計數后調節細胞濃度約8×10個/孔,培養24 h細胞貼壁后,進行饑餓處理12 h,細胞換液按分組分別處理48 h后,棄去培養基,PBS洗3次,每次5 min,用4%的多聚甲醛固定15 min,棄固定液,PBS洗3次,室溫封閉1 h,然后加入α-Tubulin(1∶100)一抗4 ℃過夜。第2天加入羊抗鼠二抗室溫避光孵育1 h,DAPI染色,PBS洗3次后封片,熒光顯微鏡拍照,用Image Pro Plus 6.0進行圖像處理和分析。1
.2
.4
總RNA提取和qRT-
PCR檢測mRNA表達水平1
.2
.4
.1
mRNA提取 細胞按2×10個/孔的密度接種于6孔板中,每孔給予每組相應處理后加入TRIzol試劑裂解細胞。用細胞刮刮下細胞,收取細胞懸液于1.5 ml EP管中,振蕩1 min,使細胞完全裂解。加入氯仿,劇烈振蕩15 s,混勻后室溫放置3 min,12 000 r/min,4 ℃離心15 min,取上清液加異丙醇,顛倒混勻,室溫靜置10 min,12 000 r/min,4 ℃離心10 min,棄上清液,加75%的乙醇進行洗滌,7 500 r/min,4 ℃離心5 min,棄上清液,倒扣EP管在潔凈的濾紙上,室溫靜置20 min。加入10 μl的DEPC水冰上溶解,吹打混勻后分光光度計測定RNA濃度和純度。1
.2
.4
.2
qRT-PCR檢測 按逆轉錄試劑盒(QPS-201)說明書反轉錄后,以GAPDH為內參,RT-PCR檢測心肌組織ANP、BNP、β-MHC的相對表達量。引物序列如下:ANP上游引物5′-TACGAGACAGTGACGGACAA-3′,下游引物5′-GAAGAAGCCCAGGGTGAT-3′;BNP上游引物5′-CAGCTCTCAAAGGACCAAGG-3′,下游引物5′-CGATCCGGTCTATCTTCTGC-3′;β-MHC上游引物5′-GGGTATCCGCATCTGTAGGA-3′,下游引物5′-CCTTTCCGGCTATCAATGAA-3′;ClC-3上游引物5′-AGACATTGCTGCTGACTGGA-3′,下游引物5′-CCCTCTCTTCAAACGTCGTC-3′;GAPDH上游引物5′-AGGAGTAAGAAACCCTGGAC-3′,下游引物5′-CTGGGATGGAATTGTGAG-3′。PCR反應體系為SYBR MIX 10 μl、上游引物 1 μl、下游引物 1 μl、cDNA 2 μl、ddHO 6 μl。根據2法計算各組相對mRNA的含量。1
.2
.5
JC-1染色 接種H9c2細胞于48孔板中,1×10個/孔,待細胞貼壁后按1.2.1進行分組及給藥后,按試劑盒說明書進行操作,熒光顯微鏡下進行拍照,并用Image J軟件進行分析。1
.2
.6
容積調節性能力檢測 在觀察不同滲透壓條件下細胞的容積調節性能力(RVD)時,用等滲液(ISO)灌流細胞5 min,改換低滲液灌流20 min,再等滲液灌流5 min。細胞玻片安放在浴槽中,用數字式攝像機連接相差顯微鏡與計算機,調節好顯微鏡焦距及亮度后,拍攝圖像,采用Image Pro Plus軟件進行處理。1
.2
.7
全細胞膜片鉗記錄ICl電流 該實驗使用芯片膜片鉗技術檢測H9C2細胞膜上氯電流的變化。膜片鉗技術用于記錄電壓鉗位條件下一小片膜中的電流,將細胞懸浮液置于芯片上。然后,通過氣泵施加壓力進行抽吸,將單個細胞吸引并定位在孔上。通過向孔施加負壓來實現膜的密封和破裂以建立整個電池構造。在NPC系統中,壓力由PatchControl軟件控制。使用此軟件,可以運行預定義的協議,儀器收集的電流信號由EPC 10 USB膜片鉗放大器處理后呈現于顯示屏并通過程序記錄下來。觀察并記錄等滲條件下的穩定電流5 min,接著將細胞外環境的等滲液換為低滲液,待細胞電流穩定后,持續記錄穩定電流5 min,最后將細胞外環境的低滲液換為等滲液,記錄全程的電流變化。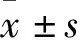
2 結果
2.1 siRNA轉染H9c2心肌細胞后ClC-3 mRNA及蛋白的表達
圖1顯示,與空白組比較,siRNA空載對照組并不能影響細胞內ClC-3 mRNA和蛋白水平,而siRNA轉染H9c2細胞48 h后,使細胞內ClC-3 mRNA降低(F
=6.35,P
<0.05)但并沒有引起細胞內ClC-3蛋白水平的變化(F
=2.77,P
>0.05);siRNA ClC-3轉染72 h后,能誘導細胞內ClC-3 mRNA和蛋白水平都降低(F
=52.84,P
<0.01和F
=70.93,P
<0.01)。結果表明,siRNA轉染H9c2細胞72 h后可以成功構建ClC-3表達下調模型。
圖1 siRNA ClC-3抑制H9c2細胞ClC-3表達
2.2 ClC-3表達下調對H9c2心肌細胞的影響
該研究分別采用α-tubulin(一種細胞骨架蛋白)進行熒光染色和qRT-PCR的方法來觀察ClC-3表達下調對H9c2心肌細胞表面積和細胞內幾個常見的心肌肥大標志因子ANP、BNP和β-MHC mRNA的表達水平的影響。如圖2所示,ISO(10 μmol/L)刺激H9c2細胞48 h后,心肌細胞的表面積增加[ISO組vs
空白組,(2 130.40 ± 369.78)vs
(877.33 ± 109.88),F
=11.33,P
<0.01,圖2A、B],且ANP、BNP和β-MHC mRNA的表達水平降低(F
=9.38、597.9、86.51,均P
<0.01);而與siRNA空載對照組不同,siRNA誘導的ClC-3敲低組的細胞表面積增加[ClC-3敲低組vs
空白組,(2 127.33 ± 109.62)vs
(877.33 ± 109.88),F
=4.93,P
<0.01],ANP、BNP和β-MHC mRNA的表達水平升高(F
=12.8、1 088、63.6,P
<0.01)。
圖2 ClC-3表達下調可使H9c2細胞產生心肌肥大
2.3 ClC-3表達下調對H9c2心肌細胞線粒體功能的影響
JC-1是一種廣泛用于檢測MMP△Ψm的理想熒光探針,紅色熒光代表JC-1聚集體(即MMP較高),綠色熒光代表JC-1單體(即MMP較低),綠色熒光與紅綠熒光強度的比值越高說明MMP越高;線粒體電子傳遞鏈抑制劑CCCP(CON+)被用作陽性對照。如圖3所示,與空白組相比,siRNA 空載組不能引起MMP發生變化(F
=3.26,P
>0.05),而與CCCP(CON+)(F
=64.5,P
<0.01)和ISO(F
=30.49,P
<0.01)處理一樣,siRNA ClC-3能使MMP下降(F
=280.5,P
<0.01),說明ClC-3表達下調能誘導線粒體結構和功能損傷。
圖3 細胞內線粒體膜電位的變化
2.4 ClC-3表達下調對H9c2心肌細胞容積激活性氯離子電流的影響
與空白組相比,空載siRNA處理后不會引起細胞容積激活性氯電流的改變(F
=17.25,P
<0.01),而ISO誘導與ClC-3表達下調都可抑制細胞容積激活性氯離子電流(F
=7.72,P
<0.01)。結果顯示,ClC-3可能通過調節容積激活性氯離子電流調控H9c2心肌細胞的表面積大小。見圖4。
圖4 ClC-3表達下調對H9c2細胞容積激活性氯離子電流的影響
2.5 ClC-3表達下調對H9c2心肌細胞容積調節能力的影響
如圖5所示,與空白組相比,ISO誘導H9c2心肌細胞肥大后,H9c2細胞的容積調節性能力下降(F
=1.49,P
<0.01);而空載siRNA不引起細胞容積調節能力的改變(F
=4.59,P
>0.05);siRNA轉染敲低ClC-3組與ISO組類似,也可抑制細胞容積調節能力(F
=2.67,P
<0.01)。以上結果表明ClC-3表達下調導致H9c2細胞的肥大可能與其下調細胞的容積調節性能力有關。
圖5 ClC-3表達下調對H9c2細胞RVD的影響
3 討論
心肌肥大的特征是長期高血壓引起的室壁厚度增加,是心血管疾病的主要危險因素,嚴重威脅到人類健康。它常會引起心臟收縮功能障礙、心肌間質的纖維化以及胎兒基因ANP、BNP、β-MHC的等效應分子的表達增加。ClC-3氯通道是容積調節性氯離子通道基因家族成員之一,在各類動物體內廣泛表達。參與到細胞興奮、遷移、增殖、分化、凋亡和體積穩態的過程中。研究表明ClC-3在主動脈縮窄術誘導的心肌肥厚及心力衰竭中起著重要作用。因此,ClC-3可能具有調控心肌肥大的作用。該研究在前期研究基礎上進一步采用siRNA轉染H9c2心肌細胞72 h成功構建了ClC-3表達下調的細胞模型。ClC-3下調的同時能誘導H9c2心肌細胞表面積增加,心肌肥大標志性因子ANP、BNP和β-MHC mRNA的表達水平升高,表明ClC-3表達下調能誘導心肌細胞肥大。這與前期研究在大鼠原代心肌細胞、H9c2細胞和C57小鼠以及AAV-9介導的ClC-3過表達小鼠的結果是一致的。同時該研究還通過與計算機連接的顯微鏡和膜片鉗技術檢測了細胞RVD能力和細胞容積激活性氯離子電流。結果顯示,ClC-3下調降低細胞的RVD能力和細胞的容積激活性氯離子電流,這些可能與其誘導心肌細胞肥大具有一定關系。
心臟是機體的重要器官,線粒體約占心肌細胞質量的30%,心臟空白運轉所需的能量約95%來自線粒體。因此,線粒體功能與心臟功能息息相關,線粒體在細胞內信號傳導、細胞死亡等方面發揮著重要作用。有報道顯示,由于線粒體功能受損導致的能量生成障礙將導致心臟代謝疾病。有研究表明,肥大性心肌病中也觀察到心臟線粒體腫脹、嵴斷裂、呼吸鏈復合物活性降低。MMP作為重要的生物能量指標,能夠反映線粒體的功能。該研究表明這與ISO處理相似,ClC-3下調也能誘導MMP降低,而導致線粒體功能損傷,這可能也與其能誘導心肌細胞肥大有關。

