煙草NNttGGCCNN22啟動子的克隆及功能研究
翟春賀,王浩,李怡博,蘇夢迪,郭豪,楊永霞,張松濤*
1 河南農業大學煙草學院,國家煙草栽培生理生化研究基地,煙草行業煙草栽培重點實驗室,河南鄭州農業路63號 450002;
2 廣東煙草韶關市有限公司,廣東韶關北江中路27號 512000
真核翻譯起始因子2(eukaryotic Initiation Factor 2,eIF2)是調控蛋白翻譯起始階段的關鍵因子。eIF2的α亞基發生磷酸化修飾后,可抑制蛋白質翻譯起始。目前,在動物中已發現四種可磷酸化eIF2α的蛋白激酶,包括PKR(protein kinase double-stranded RNA-dependent)、HRI(heme-regulated inhibitor)、PERK(PKR-like endoplasmic reticulum kinase) 和GCN2(General Control Non-derepressible 2)。在動物和芽殖酵母中,當氨基酸缺乏時,GCN2介導的eIF2α磷酸化可以降低翻譯起始速率,同時激活氨基酸合成相關基因的表達,從而應對氨基酸缺乏[1-2]。在植物中,目前只發現GCN2一種蛋白激酶可使eIF2α磷酸化,暗示著GCN2在植物營養缺乏中起重要作用。
植物GCN2在多種組織中均可表達。在擬南芥和煙草中,AtGCN2和NtGCN2在根、莖、葉、花中均可表達[3]。其中,NtGCN2在葉片中表達量最高,在根和莖中表達量最低。此外,GCN2還參與植物生長發育的調控。在擬南芥中,gcn2突變會導致種子萌發延遲,葉片變長,葉綠素含量降低[4]。GCN2還可以響應多種生物和非生物脅迫[5-10]。紫丁香假單胞菌和黃斑病菌ES4326侵染擬南芥時,GCN2被激活并磷酸化eIF2α,同時在侵染前期正調控ABA生物合成[11]。在煙草中,煙粉虱侵染也可以激活煙草GCN2的表達[13]。此外,低溫、鹽脅迫、UV輻射、干旱和冷害等非生物脅迫均能激活GCN2的表達[3,12-13]。
植物激素是由植物自身代謝產生的一類有機物質,在極低的濃度下就對植物生長發育有明顯生理效應,在植物生長發育過程中起重要作用。研究發現,GCN2可被多種植物激素激活,包括壬二酸(AZA)、茉莉酸甲酯(MeJA)和水楊酸(SA)等[3,12-13]。茉莉酸甲酯和水楊酸均是植物生長發育及抗逆反應中起重要作用的內源性激素,其中水楊酸是植物系統獲得性抗性(Systemic Acquired Resistance,SAR)的重要信號分子[14-15],而茉莉酸甲酯參與了植物防御信號轉導。噴施茉莉酸甲酯和水楊酸可激活AtGCN2[4,12],表明GCN2可能在植物防御食草昆蟲中發揮了重要作用。脫落酸(ABA)是一種應激激素,在植物遭受干旱和鹽脅迫時迅速積累,參與植物逆境響應[16]。擬南芥受到病原菌侵染時,GCN2參與了ABA信號傳導,進而關閉氣孔,限制病原體進入[11]。AZA是植物生物脅迫和非生物脅迫下脂質過氧化的產物,它能夠引起植物中SA的積累進而引發防御反應[17]。在擬南芥和煙草中,一定濃度的壬二酸處理可激活GCN2[3,12]。這些研究結果表明GCN2可以響應多種植物激素,廣泛參與了植物對各種脅迫的應答。
目前啟動子的相關研究主要集中在組織特異性啟動子、誘導型啟動子和合成啟動子的發現和應用等方面[18-22]。組織特異性啟動子如牽牛子綠色組織特異性PNZIP(pharbitis nil leucine zipper)啟動子和煙草腺毛特異表達的TTR1啟動子(Transthyretin 1)。前者可以驅動外源基因在綠色組織中高表達,后者可以在腺毛中特異表達外源基因。誘導型啟動子PR1aP(Pathogenesis-related genes la)具有水楊酸誘導性[23-25]。合成啟動子由核心啟動子區和應答元件組合而成,也可以通過構建啟動子文庫合成[21]。研究發現,根特異性順式作用元件模塊與玉米泛素基因啟動子PortUbi882(Porteresia ubiquitin)上86 bp核心序列融合而成的合成啟動子可以驅動GUS基因在煙草的根部特異性表達[26]。此外,利用CRISPR/Cas9技術通過敲除或插入應答元件探究啟動子功能也是啟動子研究的一種重要手段[27]。
目前關于GCN2的研究大多集中在動物和芽殖酵母中[28-29],植物GCN2的研究主要集中在模式植物擬南芥,但目前有關GCN2啟動子的研究尚未見報道,其調控機制尚不明確。實驗室前期研究發現煙草NtGCN2包含了NtGCN2-1和NtGCN2-2兩個拷貝,二者在進化上分別來自于其親本林煙草和絨毛狀煙草[12]。本研究從煙草中克隆了NtGCN2-1上游2000 bp的啟動子NtGCN2-Nsy-pro2000,構建了NtGCN2-Nsy-pro2000驅動的GUS基因表達載體,將其轉化煙草后分析煙草NtGCN2啟動子在不同植物激素處理下的表達模式,為進一步研究GCN2基因的轉錄調控機制提供了資料。
1 材料與方法
1.1 材料
植物材料:N. tabacumK326種植在河南農業大學煙草栽培生理生化研究基地實驗室。
菌株和載體:pCAMBIA-NPT-GUS載體為河南農業大學煙草栽培生理生化研究基地保存,大腸桿菌Escherichia coliDH5α,農桿菌Agrobacterium tumefaciensEHA105感受態購于諾唯贊生物科技有限公司。
1.2 方法
1.2.1 啟動子克隆及質粒構建
根據NtGCN2基因上游2000 bp序列設計引物(表1),以煙草K326基因組DNA為模板擴增NtGCN2上游啟動子序列,將NtGCN2-Nsy-pro2000連接至pCAMBIA-NPT-GUS載體的HindIII和EcoRI位點,替代原有的35S啟動子,將獲得的表達載體pCAMBIA-NPT-NtGCN2-Nsy-pro2000::GUS轉化大腸桿菌E. coliDH5α,挑選陽性菌落鑒定后進行測序。

表1 本實驗用到的引物Tab. 1 The primers used in this study
1.2.2NtGCN2啟動子序列分析
采 用Plant CARE (http//bioinformatics.psb.ugent.be/webtools/plantcare/html/)和PLACE數據庫(https://www.dna.affrc.go.jp/PLACE/?action=newplace)分 析啟動子序列并預測應答元件。
1.2.3 煙草遺傳轉化及PCR鑒定
采用農桿菌介導的葉盤轉化法[30]將NtGCN2-Nsy-pro2000::GUS片段轉入煙草K326中,獲得轉基因株系。
提取轉基因植株DNA,采用GUS-F/R引物進行PCR擴增。PCR反應程序:95℃預變性10 min;95℃變性10 s,55℃退火30 s,72℃延伸1 min,重復30個循環;72℃延伸10 min。
1.2.4 激素處理
選取在培養基中培養30 d的轉基因煙苗進行處理,將過濾后的激素(1 mmol/L SA、0.1 mmol/L MeJA、0.1 mmol/L ABA、0.1 mmol/L AZA,SA、MeJA、 ABA和AZA購自生工生物工程有限公司)用干凈的噴壺均勻噴灑到煙草幼苗上,分別在噴施0 h、24 h、48 h后取培養基上幼苗8~10棵用于GUS基因分析和GUS酶活性檢測。
1.2.5 RNA提取及實時熒光定量PCR
采用艾德萊試劑公司植物總RNA快速通用試劑盒提取上述待測樣品總RNA,諾唯贊生物科技有限公司HiScript? II Reverse Transcriptase試劑盒進行反轉錄。實時熒光定量PCR以轉基因煙草cDNA為模板,采用L25和GUS上下游引物對進行定量PCR(表1)。反應體系為:2 μL模板,0.5 μL上下游引物,10 μL SYBR Green Mix,7 μL ddH2O。反應程序采用95℃預變性10 min;95℃變性10 s,60℃退火30 s,重復30個循環;70℃-95℃獲得溶解曲線。以L25為內參基因,采用2-ΔΔCT法計算定量結果。
1.2.6 GUS組織化學染色
取待測樣品浸入-20℃預冷的90%丙酮,冰上靜置15 min。將樣品浸入GUS染液(10 mmol/L Na2EDTA、1 mmol/L K3[Fe(CN)6]、1 mmol/L K4[Fe(CN)6]、0.5% Triton X-100、20%甲醇、pH為7的100 mmol/L磷酸緩沖溶液、1 mg/mL X-Gluc),37℃過夜。采用75%~95%乙醇進行梯度脫色至透明,觀察染色情況并拍照。
1.2.7 GUS酶活性分析
取100 mg待測樣品液氮研磨粉碎,置入2 mL離心管,加入1 mL GUS酶提取液(100 mL pH為7的0.1 M 磷酸緩沖液,2 mL 10% SDS溶液,4 mL pH為8的0.5 M EDTA溶液,200 μL Triton X-100溶液,β-巰基乙醇200 μL,混勻后定容至200 mL),混勻后在12000 rpm離心5 min(4℃),將上清液轉移至新的離心管,-80℃保存待用。
采用Bradford法測定蛋白濃度,取20 μL蛋白上清,加入80 μL 37℃預熱的GUS酶提取液,再加入100 μL 底物MUG,37℃溫浴30 min。365 nm激發波長,455 nm發射波長,狹縫10 nm條件下測定熒光強度,根據標準曲線計算酶活性。
2 實驗結果
2.1 啟動子序列克隆與分析
2.1.1NtGCN2-Nsy-pro2000啟動子克隆與表達載體構建
以煙草K326基因組DNA為模板進行PCR擴增,結果如圖1A所示。對獲得的重組載體進行PCR鑒定,結果如圖1B所示。PCR擴增產物大小約為2000 bp,均與預期結果一致。測序結果表明pCAMBIANPT-NtGCN2-Nsy-pro2000::GUS載體構建成功。
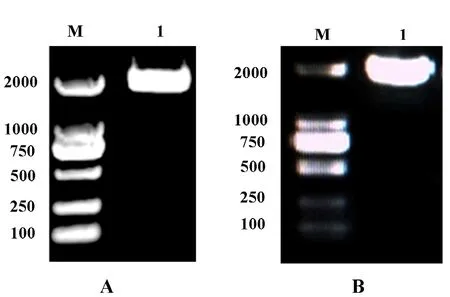
圖1 PCR擴增NtGCN2-Nsy-pro2000片段與重組載體鑒定Fig.1 PCR amplification of the NtGCN2-Nsy-pro2000 and identification of the recombinant vector
2.1.2NtGCN2-Nsy-pro2000啟動子序列分析
對獲得的NtGCN2-Nsy-pro2000序列進行順式作用元件分析發現,該序列含有高等植物啟動子核心區域和上游調控區。其上游調控區分布著多種脅迫響應元件,包括干旱誘導元件(MBS)、脫落酸應答元件(ABRE)、與茉莉酸甲酯應答相關的基序(TGACG-motif)、乙烯應答元件(ERE)、光響應元件(AE-box)、厭氧誘導應答元件(ARE)以及參與防御和脅迫應答的元件(TC-rich repeasts)(表2)。
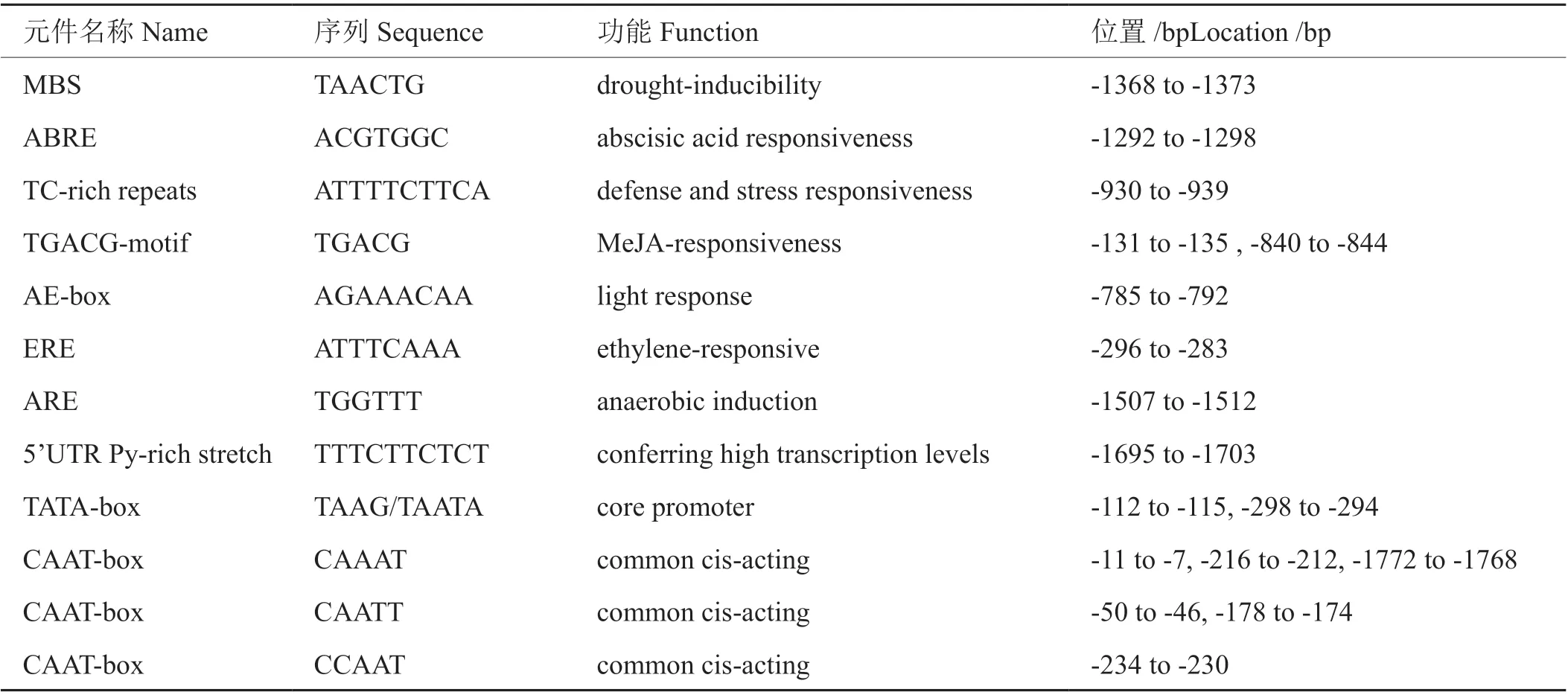
表2 NtGCN2-Nsy-pro2000順式作用元件預測Tab. 2 Prediction of NtGCN2-Nsy-pro2000 cis-acting elements
將獲得的NtGCN2-Nsy-pro2000與不同煙草中GCN2啟動子序列進行比對分析。BLAST分析結果顯示NtGCN2-Nsy-pro2000與NsyGCN2-pro相似度高達98.9%(數據未顯示)。系統進化分析結果發現煙草GCN2啟動子在進化上分為兩種類型,其中NtGCN2-Nsy-pro2000、弱毒煙草NatGCN2-pro(N. attenuata)、白肋煙TN90GCN2-X3-pro(N. tabacum TN90 X3)與林煙草NsyGCN2-pro(N. sylvestris)在進化上親緣關系較近。白肋煙TN90GCN2-pro(N. tabacum TN90)與絨毛狀煙草NtoGCN2-pro(N. tomentosiformis)在進化上親緣關系較近(圖2)。這些結果表明NtGCN2-Nsypro2000在進化上可能來自林煙草。

圖2 不同品種煙草GCN2啟動子的系統進化分析Fig.2 The phylogenetic analysis of the GCN2 promoter from different tobacco varieties
2.2 NtGCN2-Nsy-pro2000::GUS的遺傳轉化
采用農桿菌介導的方法進行遺傳轉化,結果如圖3所示。未侵染菌液的K326葉片在含有卡那霉素的分化培養基上逐漸發白死亡(圖3A),而在不含卡那霉素的分化培養基上正常分化(圖3B),NtGCN2-Nsy-pro2000::GUS轉基因葉片分化出不定芽(圖3C),將其移至生根培養基上培養,獲得轉基因植株(圖3D)。
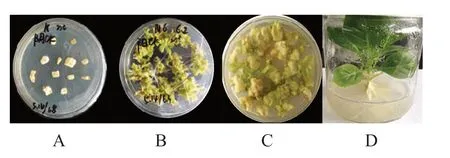
圖3 NtGCN2-Nsy-pro2000遺傳轉化Fig.3 Genetic transformation of NtGCN2-Nsy-pro2000
2.3 轉基因株系篩選與鑒定
2.3.1 組織化學染色分析
對獲得的轉基因株系進行GUS化學染色,結果如圖4所示。其中,CaMV35S啟動子轉基因植株和NtGCN2-Nsy-pro2000啟動子轉基因植株葉片均被染上藍色。該結果初步表明NtGCN2-Nsy-pro2000具有啟動子活性,并在葉片中表達量最高,該結果與擬南芥和煙草中的基因表達結果相一致[4,12]。
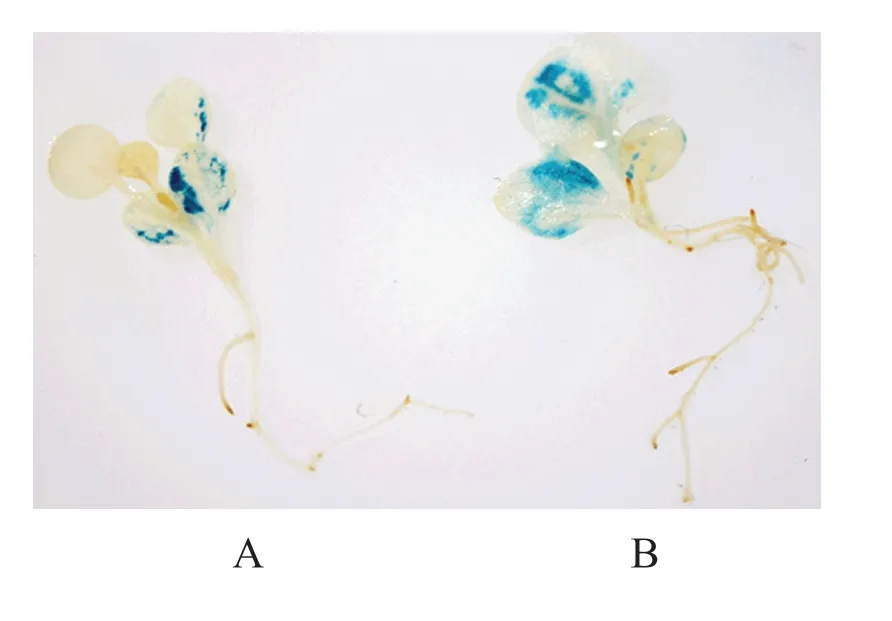
圖4 轉基因煙草幼苗的GUS組織化學染色Fig.4 The GUS staining of transgenic tobacco seedlings
2.3.2 PCR鑒定
以提取轉基因煙草植株的DNA為模板,采用GUS-F/R引物進行DNA鑒定,結果如圖5所示。其中,以質粒為模板的陽性對照擴增出250 bp左右的條帶,而以提取的K326植株DNA為模板的陰性對照未擴增出條帶,NtGCN2-Nsy-pro2000轉基因株系擴增產物與陽性對照擴增產物大小一致。該結果說明pCAMBIA-NPT-NtGCN2-Nsy-pro2000::GUS載體成功整合至煙草K326的基因組中。
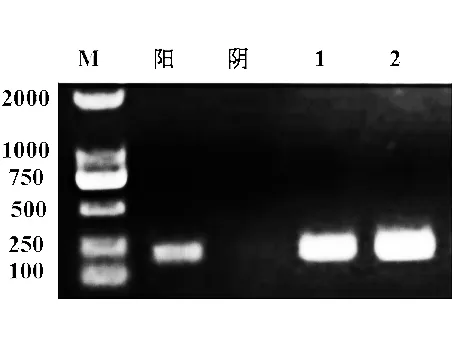
圖5 轉基因煙草的DNA-PCR鑒定Fig.5 DNA-PCR identification of transgenic tobacco
2.4 不同植物激素處理下NtGCN2-Nsy-pro2000啟動子表達分析
采用SA處理NtGCN2-Nsy-pro2000啟動子轉基因幼苗后,轉基因植株GUS基因表達和酶活測定結果如圖6A所示。結果表明,SA處理后,GUS表達量和酶活性均呈現出先增加后降低的趨勢。其中,SA處理24 h后,GUS表達量和酶活性最高。GUS基因表達量結果表明,SA處理24 h和48 h后GUS基因表達量顯著高于0 h。GUS酶活性分析發現,SA處理24 h后GUS酶活性提高,48 h后下降。這些結果表明SA處理24 h激活GCN2-Nsy-pro2000啟動子的表達。
MeJA處理NtGCN2-Nsy-pro2000轉基因幼苗后,轉基因植株GUS基因表達和酶活性分析如圖6B所示。結果表明,MeJA處理后GUS基因表達和酶活性呈下降趨勢。MeJA處理24 h和48 h后,GUS表達量與0 h相比顯著下降。GUS酶活性測定結果表明,在處理24 h和48 h后,GUS酶活性顯著下降,與GUS基因表達結果一致。這些結果表明MeJA抑制GCN2-Nsy-pro2000啟動子的表達。
ABA處理NtGCN2-Nsy-pro2000轉基因幼苗后,轉基因植株GUS基因表達和酶活性分析如圖6C所示。結果表明,ABA處理后,GUS基因表達量呈上升趨勢而GUS酶活性呈先上升后下降趨勢。ABA處理24 h和48 h后,GUS基因表達量持續增加。GUS酶活性測定在ABA處理24 h后顯著增加,處理48 h后顯著低于對照0 h。這些結果表明ABA處理可以激活GCN2-Nsy-pro2000啟動子的表達活性。
AZA處理NtGCN2-Nsy-pro2000轉基因幼苗后,GUS基因定量表達和酶活性分析結果如圖6D所示。結果表明,AZA處理后GUS基因表達量呈上升趨勢而酶活性呈先下降后上升趨勢。處理48 h后GUS基因表達量是0 h的3.27(±0.05)倍,GUS酶活性是0 h的1.14(±0.02)倍。這些結果表明,NtGCN2-Nsy-pro2000啟動子的表達活性在AZA處理48 h達到最大。
3 討論
在植物中,GCN2廣泛參與了多種生物和非生物脅迫應答[3-4]。此外,GCN2也可以被多種植物激素(SA、MeJA、AZA等)所激活[3-4,12]。本研究克隆了煙草NtGCN2基因啟動子,發現啟動子中存在眾多脅迫應答元件,分析了不同植物激素處理下NtGCN2基因啟動子的表達。
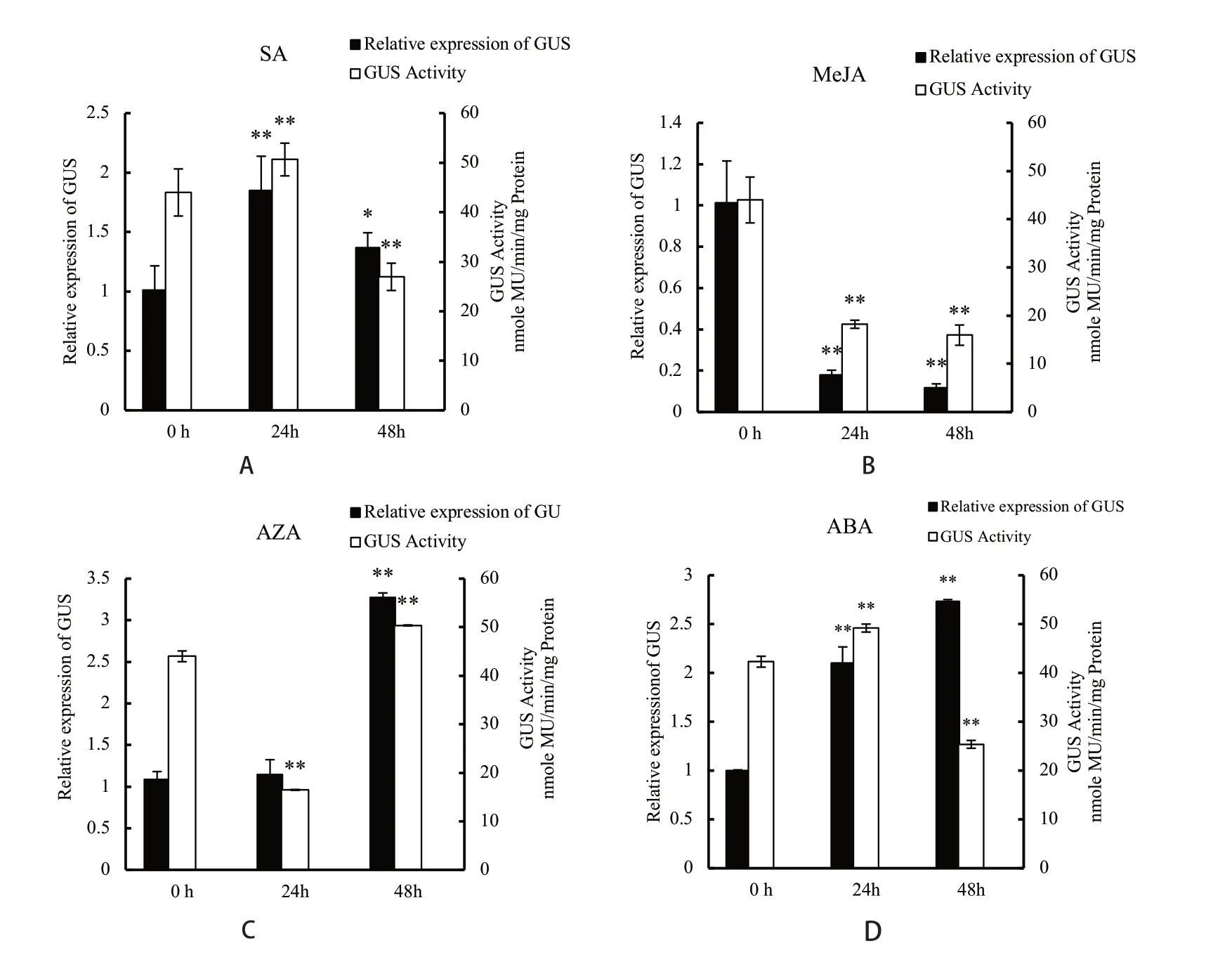
圖6 SA、MeJA、ABA及AZA處理對轉基因株系GUS基因表達量和酶活性的影響Fig.6 Effects of SA, MeJA , ABA and AZA treatments on the expression and enzymatic activity of GUSin transgenic lines
啟動子通常位于基因上游,包含典型的核心啟動子區和調控區,是基因表達的重要調控元件。本研究克隆的NtGCN2-Nsy-pro2000啟動子有典型的高等植物啟動子結構特點,調控區域存在諸多順式作用元件,如干旱誘導元件(MBS)、脫落酸應答元件(ABRE)、茉莉酸甲酯應答元件(TGACG-motif)、乙烯應答元件(ERE)、光響應元件(AE-box)、厭氧誘導應答元件(ARE)以及參與防御和脅迫應答元件(TCrich repeasts)。在擬南芥和煙草中,GCN2可以響應干旱和冷害等非生物脅迫應答,同時也參與了SA、ABA、MeJA和AZA等植物激素應答[3,12],這可能與NtGCN2-Nsy-pro2000啟動子上含有眾多順式作用元件有關。
在煙草中,本實驗室前期研究發現NtGCN2基因存在兩個拷貝NtGCN2-1和NtGCN2-2,二者分別來自于其親本林煙草和絨毛狀煙草[4,10]。本實驗克隆了NtGCN2-1基因上游2000 bp的啟動子NtGCN2-Nsypro2000,系統進化分析發現該啟動子序列與林煙草啟動子序列相似度高達98.9%,這與NtGCN2-1在進化上來源于林煙草的結論一致[4,10]。
在煙草和擬南芥中,GCN2基因在根、莖、葉和花中均有表達[4,12]。煙草中,葉片中GCN2-1基因表達量最高,花莖次之,根中最低。本研究發現NtGCN2-Nsy-pro2000轉基因株系幼苗的葉片中GUS染色最深,而在根和莖中未發現藍色。該結果與NtGCN2在煙草中基因表達量結果相一致[4,12]。另外,盡管在根中未檢測到染色,但基因表達結果表明其在根中有相對較低的表達。同時,擬南芥AtGCN2在根、莖、葉、花和角果中均有表達[4],因此推測該啟動子可能不具有組織特異性。
GCN2在動物和芽殖酵母中能夠被氨基酸等營養缺乏激活,進而磷酸化eIF2α調節蛋白合成以應對脅迫和維持生存。GCN2在植物逆境脅迫中起重要作用。擬南芥和煙草中,GCN2廣泛參與了各種生物和非生物脅迫(植物激素、干旱、低溫、鹽害和病蟲害等)應答[12,14,31]。本研究中,NtGCN2-Nsy-pro2000啟動子序列分析發現其上含有包括茉莉酸甲酯和脫落酸等植物激素應答元件在內的諸多順式作用元件。植物激素ABA在植物抗逆中起重要作用,當植物受到干旱和鹽脅迫時,植物體內ABA迅速積累以響應逆境[32]。在擬南芥和煙草中,GCN2能被ABA激活[10-11]。本研究發現NtGCN2-Nsy-pro2000序列上存在一個ABA應答元件(-1292 bp~-1298 bp),ABA處理激活了NtGCN2-Nsy-pro2000驅動的GUS基因表達。因此,推測ABA可能通過與啟動子中ABA應答元件相互作用激活了GCN2的表達。茉莉酸甲酯可誘導激活植物防御機制,外源茉莉酸甲酯可激活植物對干旱、低溫和鹽脅迫等逆境的響應[33-35]。本研究結果發現NtGCN2-Nsy-pro2000上含有兩個MeJA應答元件(-131 bp~-135 bp,-840 bp~-844 bp),MeJA激素處理結果表明MeJA抑制了NtGCN2-Nsy-pro2000啟動子活性,該結果與實驗室前期研究發現MeJA處理抑制了NtGCN2基因表達的結論相一致[12]。水楊酸是一種天然的植物激素信號分子,大量研究表明一定濃度的外源SA可以減輕鹽脅迫對植物造成的危害[36-41]。在擬南芥和煙草中,SA處理激活了GCN2基因的表達[12,14]。本研究發現雖然NtGCN2-Nsy-pro2000啟動子上未預測到SA應答元件,但是SA處理24 h激活了NtGCN2-Nsy-pro2000啟動子驅動的GUS基因表達。該結果與擬南芥、煙草中SA激活GCN2基因表達的結果相一致。AZA是激活植物防御基因表達的誘導劑,在系統獲得性抗性防御中起誘導作用[42]。在擬南芥和煙草中,AZA處理均激活了GCN2基因的表達,這與本研究中AZA處理48 h激活NtGCN2-Nsy-pro2000啟動子驅動的GUS基因表達的結果相一致[12,14]。雖然在NtGCN2-Nsy-pro2000序列上未發現AZA和SA應答元件,但是SA和AZA處理后GCN2基因和NtGCN2-Nsy-pro2000啟動子驅動GUS基因均被激活,說明NtGCN2-Nsy-pro2000啟動子上可能存在著未預測到的SA和AZA應答元件,或者存在其它未知的調控機制。此外,缺失突變分析發現玉米亞硫酸氧化酶基因(ZmSO)啟動子上含有的119 bp DNA元件能被ABA和干旱激活[43];柑橘CsLCYb1(Lycopene β-cyclase)基因啟動子含有的增強子元件可區分不同的柑橘種類[44];小麥TaSnRK2(sucrose non-fermenting 1-related protein kinase 2)基因啟動子TaSnRK2.8區域存在著莖特異性元件(-1481~-821)、葉特異性元件和根特異性元件(-2631~-1481 之間)[45]。因此,研究將進一步對NtGCN2-Nsy-pro2000啟動子進行5’端缺失突變分析,明確其順式作用元件的功能,為GCN2啟動子調控研究奠定基礎。
4 結論
本研究克隆了NtGCN2上游2000 bp序列,構建了NtGCN2-Nsy-pro2000::GUS啟動子表達載體,并獲得了啟動子轉基因株系。分析了NtGCN2-Nsypro2000啟動子在四種植物激素脅迫下的表達,初步探究NtGCN2-Nsy-pro2000啟動子的功能,得出以下結論:(1)克隆的NtGCN2上游2000 bp基因序列具有啟動子活性,在進化上可能來源于其親本林煙草。(2)NtGCN2-Nsy-pro2000驅動的GUS基因表達在四種激素處理下有不同的響應模式,AZA、ABA和SA激活NtGCN2-Nsy-pro2000啟動子驅動的GUS基因表達,而MeJA抑制了NtGCN2-Nsy-pro2000啟動子驅動的GUS基因表達。本研究從啟動子入手探究了GCN2的表達模式,為GCN2調控機理的研究奠定了基礎。

