亮丙瑞林聯合屈螺酮炔雌醇在子宮腺肌病患者術后的應用
盛玲玲
(新鄭市第二人民醫院 婦產科,河南 鄭州 451100)
子宮腺肌病(adenomyosis,AM)為臨床常見的子宮良性病變,多發于生育年齡婦女,發病率為7%~23%,嚴重影響患者的身心健康[1]。采用腹腔鏡下病灶切除術治療AM,能有效控制癥狀,保留生育功能,但仍面臨術后高復發率的問題。亮丙瑞林為目前術后常用的預防復發的藥物,能降低雌激素對殘余病灶的刺激作用,使病灶萎縮,但治療過程中患者易出現潮熱、多汗、情緒煩躁等不良反應,停藥后可能會復發[2]。本研究探討亮丙瑞林聯合屈螺酮炔雌醇在AM患者術后的應用效果。
1 資料與方法
1.1 一般資料選取2018年5月至2020年1月新鄭市第二人民醫院收治的84例AM患者。按照隨機數表法分為對照組和觀察組,各42例。經新鄭市第二人民醫院醫學倫理委員會審核批準,患者及家屬均簽訂書面知情同意書。對照組:年齡28~40歲,平均(33.54±1.89)歲;孕次2~4次,平均(3.12±0.35)次;產次1~3次,平均(1.85±0.40)次。觀察組:年齡30~39歲,平均(34.09±2.01)歲;孕次2~4次,平均(3.26±0.32)次;產次1~3次,平均(1.96±0.47)次。兩組年齡、孕次、產次比較,差異無統計學意義(P>0.05)。
1.2 選取標準(1)納入標準:①確診為AM;②存在月經量過多、進行性痛經等癥狀;③病變局限,有保留子宮的意愿;④年齡≤40歲。(2)排除標準:①合并子宮內膜病變、子宮肌瘤、卵巢囊腫;②有短期妊娠計劃;③術前接受過相關治療;④合并腎、心、肝等器官功能嚴重障礙;⑤閉經;⑥卵巢功能明顯減退。
1.3 治療方法患者均接受腹腔鏡下子宮腺肌病病灶切除術治療。對照組術后給予亮丙瑞林(上海麗珠制藥有限公司,國藥準字H20093852)治療,即術后次日皮下注射3.75 mg,每4周1次,共注射6次。術后給予觀察組患者亮丙瑞林聯合屈螺酮炔雌醇(Jenapharm GmbH & Co. KG,批準文號J20171071)治療:亮丙瑞林用法用量同對照組;于亮丙瑞林使用第3周期結束后,開始口服屈螺酮炔雌醇,每日1片(每片含炔雌醇0.03 mg和屈螺酮3 mg),連服21 d(1個周期)后停服7 d,第8天開始下個周期,共6個周期。
1.4 觀察指標
1.4.1痛經程度 分別于術前、術后6個月、術后12個月采用視覺模擬評分法(visual analogue scale,VAS)評估痛經程度,總分10分,分值與痛經程度呈正相關。
1.4.2子宮體積 分別于術前、術后6個月、術后12個月采用B超測定子宮體積,計算公式為
V=0.52×d1×d2×d3。
式中:V為子宮體積;d1為子宮×長徑;d2為子宮前后徑;d3為子宮橫徑。
1.4.3血清指標 分別于術前、術后6個月、術后12個月取5 mL肘靜脈血,離心處理(轉速為3 000 r·min-1,離心半徑10 cm,離心5 min),分離血清,以化學發光免疫分析法測定糖類抗原125(carbohydrate antigen 125,CA125)水平,血管內皮生長因子(vascular endothelial growth factor,VEGF)水平以酶聯免疫吸附試驗測定。試劑、試劑盒均購自上海通蔚科技有限公司。
1.4.4癥狀 分別于術前、術后6個月、術后12個月采用Kupperman評分表評價低雌激素狀態所致絕經期癥狀,包括感覺異常、潮熱盜汗、失眠、抑郁、焦躁等13項。癥狀評分為基本分與程度分的乘積,<20分為輕度,20~35分為中度,>35分為重度。
1.4.5不良反應和復發情況 記錄用藥期間不良反應(失眠、乏力、惡心、潮熱出汗等)及術后1 a復發情況。復發標準:子宮進行性增大,痛經及月經增多逐漸加重。
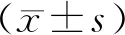
2 結果
2.1 痛經程度術后隨訪1 a,兩組各失訪1例。重復測量方差分析可知,兩組處理效應與時間效應存在交互作用(F=18.354,P<0.001),處理效應、時間效應均存在統計學意義(F組間=14.639、P組間<0.001,F時間=25.463、P時間<0.001)。術后6、12個月,兩組VAS評分逐步下降,且觀察組低于對照組(P<0.05)。見表1。
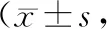
表1 兩組手術前后VAS評分比較分)
2.2 子宮體積重復測量方差分析可知,兩組處理效應與時間效應存在交互作用(F=27.639,P<0.001),處理效應、時間效應均存在統計學意義(F組間=18.694、P組間<0.001,F時間=45.369,P時間<0.001)。術后6、12個月,兩組子宮體積逐步縮小,且觀察組小于對照組(P<0.05)。見表2。

表2 兩組手術前后子宮體積比較
2.3 CA125重復測量方差分析可知,兩組處理效應與時間效應存在交互作用(F=12.453,P<0.001),處理效應、時間效應均存在統計學意義(F組間=9.695、P組間<0.001,F時間=15.367、P時間<0.001)。術后6、12個月,兩組CA125水平逐步下降,且觀察組低于對照組(P<0.05)。見表3。

表3 兩組手術前后CA125水平比較
2.4 VEGF重復測量方差分析可知,兩組處理效應與時間效應存在交互作用(F=19.145,P<0.001),處理效應、時間效應均存在統計學意義(F組間=15.374、P組間<0.001,F時間=26.349、P時間<0.001)。術后6、12個月,兩組VEGF水平逐步下降,且觀察組低于對照組(P<0.05)。見表4。

表4 兩組手術前后CA125水平比較
2.5 Kupperman評分重復測量方差分析可知,兩組處理效應與時間效應存在交互作用(F=10.543,P<0.001),處理效應、時間效應均存在統計學意義(F組間=9.362、P組間<0.001,F時間=14.563、P時間<0.001)。術后6個月,兩組Kupperman評分高于術前,觀察組Kupperman評分低于對照組(P<0.05);術后12個月,兩組Kupperman評分低于術后6個月(P<0.05),但兩組Kupperman評分比較,差異無統計學意義(P>0.05)。見表5。
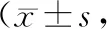
表5 兩組手術前后Kupperman評分比較分)
2.6 不良反應觀察組潮熱出汗發生率低于對照組(P<0.05)。見表6。

表6 兩組不良反應發生率比較[n(%)]
2.7 復發率觀察組復發率[2.44%(1/41)]與對照組[12.20%(5/41)]比較,差異無統計學意義(χ2=2.877,P=0.090)。
3 討論
隨著腔鏡技術的發展,腹腔鏡下病灶切除術已成為治療AM患者的主要方案。但是,由于患者需要保留生育功能、術式操作局限以及病灶解剖位置特殊等因素的影響,術后尚有少量病灶組織殘留,復發率較高。術后如何通過輔助藥物治療達到有效清除殘存病灶及預防復發為當前研究的熱點。
亮丙瑞林為促性腺激素釋放激素激動劑(gonadotropin releasing hormone agonist-α,GnRH-α),能與體內GnRH受體結合,抑制垂體的性激素分泌功能,維持機體低雌激素狀態,改善雌激素對殘存病灶的刺激,促使病灶萎縮,減少復發,但其所致的低雌激素效應可引起更年期癥狀、骨質丟失,嚴重影響患者的治療依從性和生活質量[3]。反向添加療法,即在GnRH-α治療期間加用雌、孕激素,將雌激素控制在一定范圍內,能有效減輕GnRH-α的低雌激素癥狀[4]。本研究中觀察組潮熱出汗發生率、術后6個月Kupperman評分及術后6、12個月VAS評分均低于對照組,子宮體積小于對照組,可見聯合用藥能減少低雌激素癥狀,改善患者痛經程度,縮小子宮體積。屈螺酮炔雌醇片為復方制劑,有孕激素、抗鹽皮質激素活性,可抑制排卵,使體內雌孕激素水平降低,同時使子宮內膜變薄,減少月經量,緩解痛經[5]。屈螺酮炔雌醇片與亮丙瑞林聯合應用可能發揮協同作用,增強治療效果。
CA125是來源于上皮性卵巢抗原的糖蛋白。VEGF可促進異位腺上皮細胞成長、轉移,形成新生血管。AM患者血清CA125、VEGF明顯升高,在評價治療后疾病復發時具有關鍵作用[6-7]。在本研究中,術后6、12個月,觀察組血清CA125、VEGF的降低程度更為明顯。但兩組術后1 a復發率對比差異無統計學意義,這可能與本研究隨訪時間較短有關。
綜上所述,將亮丙瑞林聯合屈螺酮炔雌醇應用于AM患者術后,能改善患者的痛經程度,縮小子宮體積,調節血清CA125、VEGF水平,降低潮熱出汗等不良反應發生率。

