注射用艾普拉唑鈉聯合生長抑素對重癥急性胰腺炎患者氧化應激指標及急性呼吸窘迫綜合征發生率的影響
束 穎
(河南省周口市中心醫院急診科,周口 466000)
重癥急性胰腺炎(severe acute pancreatitis,SAP)病情進展快,隨著病情進展患者機體可持續產生大量氧自由基。當氧自由基產生量超過抗氧化系統清除能力時,會出現氧化應激[1]。氧化應激可損傷毛細血管內皮細胞,增加血管通透性,加重胰腺微循環障礙程度,導致病情難以控制,使預后風險升高[2]。此外,SAP還可誘發多種并發癥,其中急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)是常見并發癥之一,以呼吸困難、進行性低氧血癥為主要特征,具有較高病死風險,并可進一步增加患者預后風險[3]。針對氧化應激及ARDS的負性影響,臨床對患者實施積極治療尤為必要。目前可用于治療SAP的方法包括手術及藥物治療,其中藥物療法是SAP治療的重要手段,注射用艾普拉唑鈉、生長抑素(SS)是2種常用藥物。注射用艾普拉唑鈉可通過抑制胃酸分泌,保護黏膜屏障功能[4]。SS可減輕患者全身炎癥狀態、抑制胰酶分泌、緩解腸道黏膜功能損傷[5]。結合2種藥物在SAP中的應用效果,推測聯合使用可以提高SAP患者的整體療效獲益,對減輕氧化應激、預防ARDS有一定效果,且有助于降低SAP患者預后風險。基于此,本研究進一步觀察注射用艾普拉唑鈉聯合SS治療SAP的可行性,分析聯合治療方案對患者氧化應激、ARDS發生的影響,以期為指導此類藥物合理使用提供參考。現報道如下。
1 資料與方法
1.1 一般資料
選取本院2017年2月~2020年2月收治的80例SAP患者作為研究對象,采用隨機數字表法分為對照組和觀察組,每組40例。對照組:男性28例,女性12例;年齡53~72歲,平均年齡(59.28±4.21)歲;發病至入院時間3~19 h,平均時間(11.42±2.68) h;改良Marshall評分[6]3~6分,平均評分(4.95±0.38)分。觀察組:男性30例,女性10例;年齡52~73歲,平均年齡(58.91±4.54)歲;發病至入院時間3~18 h,平均時間(11.61±2.58) h;改良Marshall評分3~6分,平均評分(4.63±0.45)分。兩組一般資料比較無統計學差異(P>0.05),具有可對比性。本研究經本院醫學倫理委員會批準。患者及家屬知情且簽署知情同意書。
納入標準:① 符合《中國急性胰腺炎診治指南(2019年,沈陽)》[7]中有關SAP診斷標準者。② 血清淀粉酶或脂肪酶活性>3倍正常值上限者。③ 合并急性上腹部疼痛者,部分患者疼痛向背部放射。④ 合并>48 h的單器官或多器官功能障礙者。
排除標準:① 合并惡性腫瘤者。② 合并心肺基礎性疾病者。③ 合并慢性炎癥疾病者。④ 處于昏迷狀態者。⑤ 入組前1周接受過相關治療者。⑥ 對本研究藥物有過敏反應者。
1.2 治療方法
兩組均接受液體復蘇、抗感染等常規治療。在此基礎上,對照組采用SS治療,將注射用生長抑素[海南中和藥業股份有限公司,國藥準字H20043481,批號20161205、20181121,規格0.25 mg(按SS計)] 3 mg 與5% 100 ml葡萄糖注射液充分混合,靜脈滴注,滴注速度為0.25 mg/h,qd,連續治療6天。觀察組在上述基礎上,將注射用艾普拉唑鈉[麗珠集團麗珠制藥廠,國藥準字H20170019,批號20161124、20180906,規格10 mg(按C19H18N4O2S計)]20 mg(初始劑量)與200 ml 0.9%氯化鈉注射液充分混合,靜脈滴注,30 min內滴注完,隨后劑量改為10 mg/次,將10 mg注射用艾普拉唑鈉與100 ml 0.9%氯化鈉注射液充分混合,靜脈滴注,qd,連續治療6天。
1.3 評價指標
兩組均連續治療6天,比較治療后患者情況。① 記錄兩組治療期間ARDS發生率及病死情況:ARDS診斷需符合柏林標準[8],通過X線造影結合血氧指標確診。② 氧化應激指標:分別于治療前、治療6天時,于清晨抽取患者空腹外周血3 ml,3000 r/min離心10 min,取血清。采用氧化應激檢測試劑盒(英國沃特曼公司)檢測血清丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)及谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)水平,檢測方法選用酶聯免疫吸附試驗。③ 記錄兩組治療期間不良反應發生情況,包括臉紅、腹瀉、惡心、眩暈、胸悶、嗜睡,通過患者主訴癥狀評估。
1.4 統計學方法
2 結果
2.1 兩組ARDS發生率及病死率
觀察組ARDS發生率低于對照組,具有統計學差異(P<0.05);兩組病死率比較無統計學差異(P>0.05)。見表1。
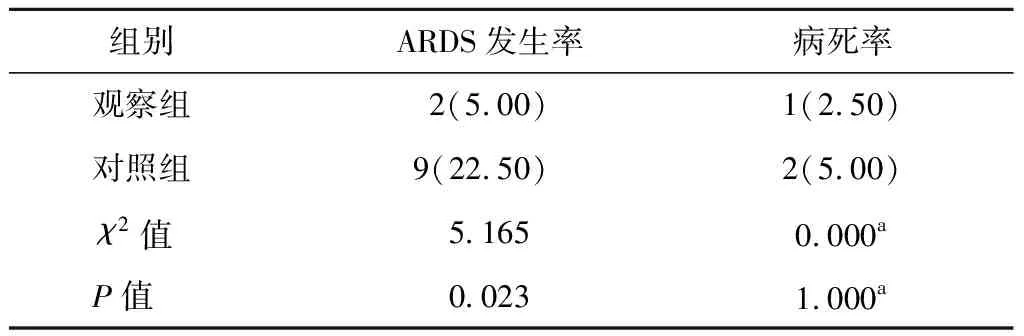
表1 兩組ARDS發生率及病死率比較n=40,n(%)
2.2 兩組氧化應激指標比較
治療前,兩組MDA、SOD及GSH-Px水平比較無統計學差異(P>0.05);治療6天后,兩組MDA水平均較治療前降低,且觀察組低于對照組;兩組SOD及GSH-Px水平均較治療前升高,且觀察組均高于對照組,具有統計學差異(P<0.05)。見表2。
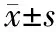
表2 兩組氧化應激指標比較
與同組同指標治療前比較,a:P<0.05
2.3 兩組不良反應發生率比較
兩組各項不良反應(臉紅、腹瀉、惡心、眩暈、胸悶、嗜睡)發生率比較,無統計學差異(P>0.05)。見表3。
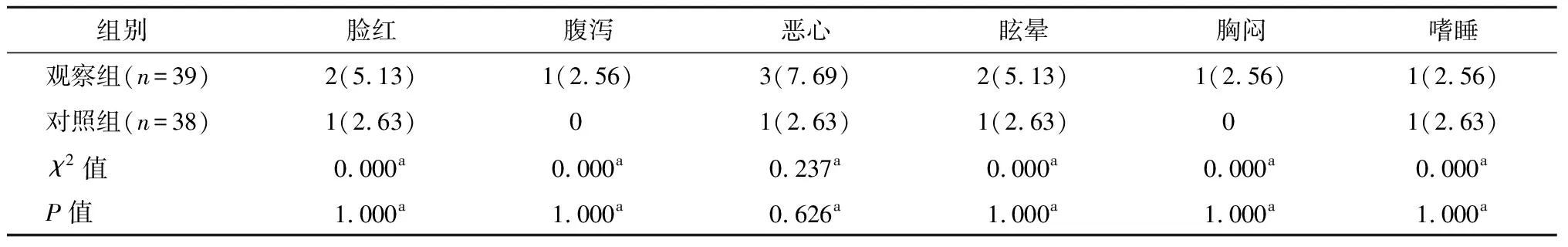
表3 兩組不良反應發生率比較 n(%)
3 討論
SAP作為危重癥,對患者實施積極有效的治療是降低病死率、改善患者預后的重要條件。目前臨床用于治療SAP的方法較多,但尚無特效療法。主要療法為手術、液體復蘇、藥物治療等,均以預防并發癥的發生、減輕患者預后風險為原則。其中,藥物療法是治療過程中不可缺少的重要環節,聯合用藥對改善患者病情相關指標、預防并發癥的發生有重要意義。
SS是SAP患者常用的治療藥物。SAP患者機體內分布著大量SS受體,在應用SS治療后,SS可與受體結合,抑制胰腺外分泌,減少環磷酸腺苷合成[9]。此外,SS還可抑制迷走神經興奮、減少血流量、抑制胰酶胰腺分泌,繼而改善患者全身炎癥狀態[10]。但僅采用SS治療,難以有效改善SAP患者氧化應激狀態,且對ARDS的預防效果并不理想。本研究觀察組在SS治療的基礎上聯合注射用艾普拉唑鈉治療,結果顯示,觀察組ARDS發生率低于對照組,兩組病死率比較無統計學差異,提示注射用艾普拉唑鈉聯合注射用SS雖對SAP患者的短期病死率無明顯影響,但可有效預防ARDS的發生。主要原因在于,SAP發生、病情進展與腸道細菌移位、繼發細菌感染密切相關,其中腸黏膜屏障功能損傷是關鍵病理環節,可導致腸道細菌異常[11]。艾普拉唑鈉對改善腸道屏障功能有較好的治療效果,艾普拉唑鈉是新一代質子泵抑制劑,可結合多種酶,形成不可逆的酶抑制復合物,從而發揮抑酸效果,抑制胃酸分泌,保護患者腸道黏膜屏障功能,進而控制病情進展[12]。患者病情改善后,炎性細胞間的相互作用減輕,肺損傷程度減輕,ARDS發病風險隨之降低。
本研究結果還提示,治療6天后,觀察組MDA水平低于對照組,SOD及GSH-Px水平高于對照組。MDA是反饋氧自由基脂質過氧化損害程度的主要指標之一,水平越高提示機體氧化應激反應越劇烈;SOD是抗氧化酶,GSH-Px是過氧化氫分解催化酶,兩者可反饋機體清除氧自由基和活性氧的能力[13-14]。研究結果提示,經注射用艾普拉唑鈉聯合注射用SS治療后,SAP患者的機體氧化應激狀態得到有效改善。主要原因在于,自身消化功能異常形成的過氧化損傷是導致SAP患者氧化應激的主要因素,因消化異常產生的活性氧、氧自由基相對減少,而采用注射用艾普拉唑鈉治療SAP后,患者腸道黏膜屏障功能改善、SAP病情進展延緩、腹內壓逐漸恢復、胰腺功能損傷減輕,因此氧化應激狀態減弱[15]。兩組各項不良反應比較無統計學差異,提示注射用艾普拉唑鈉聯合注射用SS治療SAP具有一定安全性,可在臨床推廣應用。兩組中均有死亡病例,究其原因,主要是患者年齡較大且病程較長,導致患者病情加重,臨床療效較差,最終死亡。
綜上所述,SAP患者采用注射用艾普拉唑鈉聯合注射用SS治療療效較好,患者氧化應激程度減輕,ARDS發生率降低,且聯合用藥不良反應未明顯增加,用藥安全可靠。但因本研究選取例數較少,治療及隨訪時間較短,且未對患者炎癥因子水平、器官衰竭程度進行探討,結論仍有局限。今后還應擴大樣本量、延長治療及隨訪時間、增加研究指標,以進一步證實注射用艾普拉唑鈉聯合注射用SS治療SAP的價值,指導臨床合理治療SAP。

