重癥急性胰腺炎外周血miR-9、miR-155表達水平與淀粉酶、炎性反應及Th17/Treg平衡的關系
趙瑞臣,次多,何春婭,胡佳佳,李素芝,馮東方
急性胰腺炎(acute pancreatitis,AP)是急診科常見病,其病理過程為胰酶在胰腺內被激活后引起胰腺組織自身消化、水腫、出血甚至壞死的炎性反應,具體病因迄今尚不十分明確,多認為與過量飲酒、膽結石、膽道感染等有關[1-2]。根據“中國急性胰腺炎診治指南”[3]可將AP分為輕度AP(mild acute pancreatitis,MAP)、中度AP(moderately severe acute pancreatitis,MSAP)和重度AP(severe acute pancreatitis,SAP)。在預后方面,雖然大部分輕度AP患者為自限性疾病,預后良好,但仍有近1/5會轉為MSAP或SAP。SAP病情進展較快,并發癥多,治療難度大,病死率居高不下,嚴重威脅患者的生命安全。有研究表明[4],當胰腺受到損傷時,胰腺泡細胞釋放微小核糖核酸(microRNA,miR),并在外周血中穩定表達。另有研究表明[5-6],miR-9、miR-155在胰腺損傷中異常表達,提示miR-9、miR-155可能在SAP的病理過程中發揮了重要作用。現分析SAP患者外周血中miR-9、miR-155的表達及其與血清淀粉酶(serum amylase,S-amy)、炎性反應、輔助性T細胞17(helper T cells 17,Th17)/調節性T細胞(regulatory T cells,Treg)平衡的關系,以期為SAP診療提供參考,報道如下。
1 資料與方法
1.1 臨床資料 選擇2015年3月—2020年5月中國人民解放軍西藏軍區總醫院急診醫學科收治AP患者294例(病例組)及同期在醫院進行體檢的健康者51例(健康對照組)為研究對象。根據“中國急性胰腺炎診治指南”[3]中的分類標準,其中重度AP患者39例為SAP亞組,中度AP患者97例為MSAP亞組,輕度AP患者158例為MAP亞組。SAP亞組男26例,女13例,年齡18~71(45.73±7.26)歲;發病至入院時間4~9(6.23±1.86)h;基礎疾病:高血壓11例,糖尿病3例;病因:高脂血癥性12例,膽源性18例,酒精性5例,特發性4例。MSAP亞組男66例,女31例,年齡19~75(46.57±7.79)歲;發病至入院時間4~10(6.29±1.72)h;基礎疾病:高血壓28例,糖尿病5例;病因:高脂血癥性33例,膽源性41例,酒精性12例,特發性11例。MAP亞組男105例,女53例,年齡19~76(46.64±7.81)歲;發病至入院時間4~9(6.27±1.78)h;基礎疾病:高血壓27例,糖尿病7例;病因:高脂血癥性49例,膽源性73例,酒精性20例,特發性16例。健康對照組男34例,女17例,年齡18~70(44.85±7.06)歲。4組對象的性別、年齡比較差異無統計學意義(P>0.05),具有可比性。3亞組發病至入院時間、基礎疾病、病因構成比較差異無統計學意義(P>0.05)。本研究經醫院倫理委員會審核批準(審批號:YZJQZYYLS20150109),患者及家屬知情同意并簽署知情同意書。
1.2 入組選擇標準 (1)納入標準:①AP患者經腹部超聲及腹部增強CT檢查,符合AP的臨床診斷標準[3],患者胰腺形態改變,存在明顯的腹痛、腹脹、惡心、嘔吐等表現;年齡≥18歲,均為首次確診;②健康對照組經肝功能、血尿常規、心電圖、X線胸片等檢查顯示無異常者。(2)排除標準:①伴有肝炎、皰疹病毒感染者;②患惡性腫瘤及自身免疫性疾病者;③患有其他嚴重器質性病變者;④入組前1個月內服用過可能影響炎性指標、Treg、Th17水平的藥物者。
1.3 觀測指標與方法
1.3.1 血標本采集:AP患者于確診后(治療前)及健康對照組于體檢當日采集清晨空腹外周血8 ml,均分為4份,每份2 ml,按相關規程保存待檢。
1.3.2 外周血miR-9、miR-155水平檢測:血樣本2 ml離心獲取血清,采用實時熒光定量聚合酶鏈式反應(RT-qPCR)檢測血清miR-9和miR-155表達量。血清在無菌無RNA酶條件下采用TRI Reagent BD試劑(美國Gene Copeia公司)提取總RNA,嚴格按照試劑盒說明書操作,用紫外分光光度計NanoDrop2000c(美國賽默飛世爾公司)檢測RNA濃度,樣品吸光度(A230/280)值在1.8~2.0保存待測。采用RT反轉錄試劑盒(美國Gene Copeia公司)進行RNA逆轉錄,將RNA逆轉錄為cDNA,操作嚴格按照試劑盒說明書進行。miR-9和miR-155定量檢測采用U6為內參基因,U6上游引物序列為5'-AGCGGGAACGTGCGTGACA-3',U6下游引物序列為5'-GTGGACTTGGGAGAGGACTGG-3';miR-9上游引物序列為5'-GCGTCTITGGTTATCTAGCTGTA-3',下游為5'-GCATGCTCATGAGCATCG’-3';miR-155上游引物序列為5'-GCGAAAGCATTTGCCAAGAA-3'。下游為5'-CATCACAGACCTGTTATTGC-3'。RT-qPCR反應體系總體積20 μl,RT-qPCR反應條件為:94℃預變性2 min,95℃變性30 s,95℃退火3 s,60 ℃延長30 s,共進行40個循環。miR-9和miR-155的相對表達量用2-△△CT法計算[7]。
1.3.3 血清炎性指標及淀粉酶檢測:上述血樣本2 ml離心獲取血清,采用酶聯免疫吸附試驗(ELISA)測定白介素6(IL-6)、IL-8、腫瘤壞死因子α(TNF-α)、C反應蛋白(CRP)水平,試劑盒購自上海哈靈生物科技有限公司;另取血樣本2 ml離心獲取血清采用酶速率法(37℃)檢測S-amy水平,試劑盒購自上海信裕生物科技有限公司。檢測過程嚴格按照試劑盒說明書進行操作。
1.3.4 Th17、Treg水平檢測:取肝素鈉抗凝的外周血2 ml,常規分離外周血單個核細胞并提純,調整細胞濃度為1×106/ml,取1 ml加入流式細胞檢測專用試管,離心棄上清后加入磷酸鹽緩沖液100 μl,加入CD4單克隆抗體、CD25單克隆抗體、CD127單克隆抗體各20 μl,抗體與細胞懸浮液混勻,在室溫下避光孵育20 min,再次加入磷酸鹽緩沖液2 ml,混勻后再離心棄上清,加入0.5 ml磷酸鹽緩沖液重懸浮細胞,混勻后避光放置,以流式細胞儀檢測Treg。用于檢測Th17的樣本加入濃度為1 μl/ml的佛波酯(美國Sigma公司)0.5 μl,在37℃溫箱中培養1 h,再加入蛋白逆轉抑制劑2 μl,在37℃溫箱中培養3 h,加入磷酸鹽緩沖液2 ml洗滌,混勻后離心棄上清后加入CD4單克隆抗體30 μl,于4℃下避光孵育15 min,加入IL-17抗體5 μl,混勻后在4℃下避光孵育30 min,加入磷酸鹽緩沖液2 ml,混勻棄上清,再加入磷酸鹽緩沖液重懸浮細胞0.5 ml,以流式細胞儀檢測Th17。Th17、Treg檢測結果以陽性細胞百分數表示,并計算Th17/Treg比值。
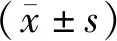
2 結 果
2.1 各組miR-9、miR-155表達水平比較 外周血中miR-9、miR-155表達水平比較,SAP亞組>MSAP亞組>MAP亞組>健康對照組,差異均有統計學意義(P<0.01),見表1。
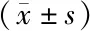
表1 各組外周血miR-9、miR-155相對表達量比較
2.2 各組血清炎性指標及S-amy水平比較 血清IL-6、IL-8、TNF-α、CRP、S-amy水平比較,SAP亞組>MSAP亞組>MAP亞組>健康對照組,差異均有統計學意義(P<0.01),見表2。
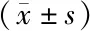
表2 各組血清炎性指標及S-amy水平比較
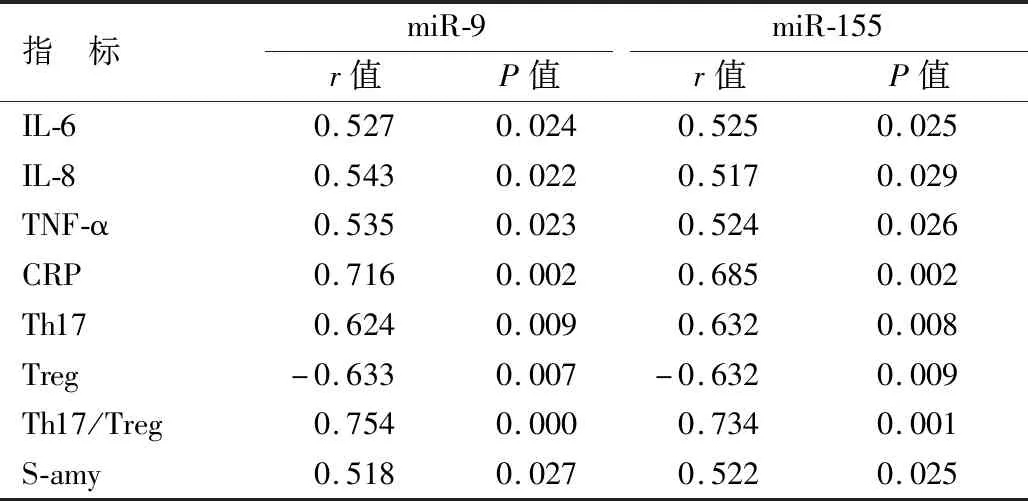
2.3 各組Th17、Treg水平比較 Th17水平、Th17/Treg比較,SAP亞組>MSAP亞組>MAP亞組>健康對照組,差異均有統計學意義(P<0.01);Treg水平比較,SAP亞組 表3 各組Th17、Treg水平比較 2.4 miR-9、miR-155與炎性指標、Th17、Treg、S-amy的相關性分析 Pearson相關性分析結果顯示,外周血中miR-9、miR-155表達與IL-6、IL-8、TNF-α、CRP、Th17、Th17/Treg、S-amy呈正相關(P<0.05),與Treg呈負相關(P<0.05),見表4。 表4 miR-9、miR-155與炎性指標、Th17、Treg、S-amy相關性分析結果 目前關于AP的發病機制尚不十分明確,多數學者認為是炎性細胞(如內皮細胞、淋巴細胞、單核巨噬細胞、樹突狀細胞等)、炎性因子(如TNF-α、轉化生長因子β1、白介素、血小板激活因子等)之間相互作用從而產生級聯瀑布反應,進而引發全身性炎性反應,造成AP的早期病理損害[8-10]。IL-6是一種功能廣泛的多效性細胞因子,可調節免疫應答,是重要的炎性指標之一。IL-8屬于趨化因子家族的細胞因子,IL-8結合IL-8受體α和受體β對中性粒細胞有細胞趨化作用,實現其對炎性反應的調節功能。TNF-α是一種主要由巨噬細胞和單核細胞產生的促炎細胞因子,參與炎性反應和免疫反應過程。CRP是一種經典的急性時相蛋白,其本身直接參與了炎性反應過程,是一種非特異的炎性標志物。湯偉勝等[11]研究顯示,SAP患者血清炎性指標(IL-6、IL-8、IL-10、CPR)水平升高。張婷婷等[12]的研究表明,TLR4信號通路作為炎性反應的閘門,通過一系列信號轉導調控炎性介質的釋放,引起SAP患者各器官損傷。Matsuda等[13]的研究也表明,炎性反應與AP病情密切相關。本研究中,IL-6、IL-8、TNF-α、CRP的表達水平比較,SAP亞組>MSAP亞組>健康對照組,表明AP患者機體存在炎性反應,且炎性反應水平與病情程度有關。在正常機體狀態下,炎性因子與炎性細胞保持動態平衡,在AP病理過程中,會發生促炎—抑炎之間的失衡,從而打破原有的動態平衡,機體狀態向促炎一方極化,引發機體多個器官受損[14]。 Th17細胞通過分泌IL-17參與炎性反應的過程,IL-17可激活免疫T細胞活性,產生化學增活素、細胞黏附分子等,從而介導炎性反應發生[15]。Treg細胞是CD4+T細胞亞群之一,其主要分泌特異性表達叉狀頭轉錄因子,具有免疫抑制作用,通過分泌IL-10、IL-4等細胞因子維持體內免疫環境的穩定[16]。Th17細胞和Treg細胞的分化過程是相互拮抗的,在正常機體狀態下,二者通過免疫網絡保持抗炎—抑炎平衡,當機體損傷時,抗炎—抑炎的平衡被打破,對機體免疫起負調節作用[17]。本研究顯示,Th17細胞、Th17/Treg水平比較,SAP亞組>MSAP亞組>MAP亞組>健康對照組;Treg水平比較,SAP亞組 miRNA是一類由21~25個核苷酸組成的非編碼小分子核糖核酸,其生物學功能是參與細胞增殖、分化、凋亡、激素調節和新陳代謝等過程[20]。目前有研究[21]證實,miRNA與腫瘤、心血管病、腦血管病等多種疾病有關,miRNA通過特定的細胞因子和信號通路對Th17和Treg細胞的分化進行調節,并在分子水平上介導Th17與Treg細胞的平衡,參與免疫應答的過程。但目前關于miR-9、miR-155與SAP關系的研究較少。本研究發現,外周血中miR-9、miR-155的表達水平比較,健康對照組 本結果表明,SAP患者外周血中miR-9、miR-155表達與血清淀粉酶、炎性指標水平及Th17/Treg平衡有關,但只是初步分析相關性,今后可從細胞株、動物實驗分析miR-9、miR-155與SAP病理過程的關系及具體機制,并探究二者對SAP的臨床診斷價值。 綜上所述,SAP患者外周血miR-9、miR-155表達上調,其可能通過影響炎性反應、免疫平衡、淀粉酶參與AP的病理變化過程,檢測外周血miR-9、miR-155表達水平對SAP的診療具有一定意義,可進行深入研究。 利益沖突:所有作者聲明無利益沖突 作者貢獻聲明 趙瑞臣:設計研究方案,實施研究過程,論文撰寫;次多、何春婭:實施研究過程,資料搜集整理,論文修改;胡佳佳、李素芝:進行統計學分析;馮東方:提出研究思路,分析試驗數據,論文審核
3 討 論

