Clec9A介導的體內壞死細胞清除機制研究進展①
晏 黎 黃 偉 全紫瑤 崔天盆 (湖北中醫藥大學附屬武漢市中西醫結合醫院檢驗科,武漢430022)
惡性腫瘤由于生長迅速,腫瘤中央部位血液供應相對不足,易導致腫瘤細胞發生壞死。同時,細胞壞死也是機體病毒感染的常見結果之一,且可發生于病毒感染的任一階段[1]。未被及時清除的壞死細胞,會通過釋放胞內物質,如損傷相關分子模式(damage-associated molecular patterns,DAMPs)物質,引起炎癥反應[2-3]。因此,機體免疫系統通過識別DAMPs 以起到清除壞死細胞和抑制炎癥反應的功能[3]。
C 型凝集素 9 家族 A 成員( C-type lectin domain family 9,member A,Clec9A),又稱為樹突狀細胞-NK細胞凝集素群受體1(DC-NK lectin group receptor-1,DNGR-1)是一種限制性表達在人外周血BDCA3+樹突狀細胞(dendritic cells,DC)和小鼠 CD8α+DC、CD103+DC 上識別細胞死亡信號的 DAMPs 受體[4-8]。研究表明人BDCA3+DC 具有與小鼠CD8α+DC 相似的表型和功能特性,能利用Clec9A 識別壞死細胞,通過主要組織相容性復合體(major histocompatibility complex,MHC)Ⅰ類分子交叉提呈壞死細胞抗原[5,7-10]。
Clec9A 分子與受損或壞死細胞暴露的細胞骨架成分——纖維狀肌動蛋白(filaments actin,F-ac?tin)結合后通過其胞質區的免疫受體酪氨酸活化基序(immunoreceptor tyrosine-based activation motif,ITAM)募集和活化脾酪氨酸激酶(spleen tyrosinebased kinase,Syk),交叉提呈壞死細胞的抗原,激活細胞毒性T 淋巴細胞(cytotoxic T lymphocyte,CTL),啟動機體對壞死細胞的清除[4-6,11](見圖1)。本文將從Clec9A 的分子結構、配體、信號通路、交叉提呈抗原等方面來闡述其介導壞死細胞清除的機制及研究進展。
1 Clec9A 的CTLD 是結合纖維狀肌動蛋白的特異位點
Clec9A 屬于2 型跨膜蛋白,具有典型的V 群C型凝集素樣受體的結構。包括細胞外C型凝集素區域(C-type lectin-like domain,CTLD)、頸部區域和跨膜區以及胞質內帶有半免疫受體酪氨酸活化基序(hem-ITAM)[6](見圖 1)。ZHANG 等[11]研 究 發 現Clec9A 的 CTLD 是識別 F-actin 的區域,這與其中兩個色氨酸殘基有關。CTLD 結構雖與其他C 型凝集素相似,但這種特異性并不存在于其他C 型凝集素中[4,12]。進一步對 CTLD 結合 F-actin 的結構進行研究,發現每個CTLD 與螺旋狀排列在F-actin 中的3個肌動蛋白亞基作用,連接兩個肌動蛋白原絲[12]。這種拓撲結構不同于其他肌動蛋白結合結構,證實Clec9A 受體的特異性,與其作為識別壞死細胞的受體功能相一致。2016 年,HAN? 等[13]發現 Clec9A 的頸部區域能夠感知細胞外pH 值和離子強度的變化,做出相應結構的改變,以提高交叉提呈抗原的能力。同時用其他C 型凝集素頸部結構替換,發現不能促進壞死細胞抗原的表達。表明Clec9A 的頸部區域屬于受體功能完整性的一部分,對抗原的有效提呈是必不可少的。
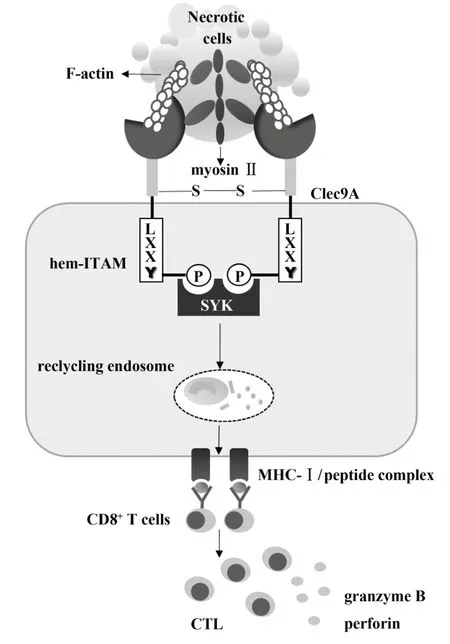
圖1 Clec9A介導的體內壞死細胞清除機制示意圖Fig.1 Clec9A mediated mechanism of phagocytosis necrotic cells in vivo
綜上所述,Clec9A 的功能不同于其他C 型凝集素,能夠特異性識別壞死細胞,交叉提呈至CD8+T細胞[4,11-12]。在識別過程中,病原因素所導致細胞損傷釋放的細菌毒素、病毒核衣殼等微環境能夠增加CTLD 對 F-actin 的親和力[12]。此外,Clec9A 的頸部區域結構在抗原內吞途徑中發生構象改變,這有助于壞死細胞抗原的交叉提呈[13]。
2 Clec9A 通過結合暴露的纖維狀肌動蛋白識別壞死細胞
肌動蛋白是真核細胞中最豐富、最保守、功能最廣泛的蛋白之一,是細胞骨架微絲系統的主要組成成分,在球狀(G-actin)和絲狀(F-actin)之間經歷聚合和拆卸的循環[14]。SANCHO 等[5]發現 Clec9A的配體對糖苷酶和核酸酶有抵抗性,但對蛋白酶、高溫和酸敏感。認為其配體是一種由于細胞壞死,失去胞膜的完整性而暴露出來的胞質蛋白質。進一步對配體受體復合物進行質譜分析發現該復合物是一個復雜的細胞骨架蛋白,包括血影蛋白、肌球蛋白和細絲蛋白[4]。2012 年,AHRENS 等[4]和ZHANG 等[11]研究發現纖維狀肌動蛋白是 Clec9A 的特異性配體[4,11](見圖 1)。近年研究指出Ⅱ型肌球蛋白(Myosin Ⅱ)能將肌動蛋白絲組織成束狀,增強Clec9A 與 F-actin 的結合力[14]。而缺乏Ⅱ型肌球蛋白的纖維狀肌動蛋白會減弱其刺激Clec9A 交叉提呈壞死抗原的能力。這一發現為臨床增強Clec9A疫苗效果提供了新策略。
當細胞受到損傷,細胞膜破裂時,并不會突然導致細胞骨架完整性的喪失,相反死亡細胞也會保留聚合的肌動蛋白絲作為細胞壞死的信號[4]。這一特點使大量暴露的F-actin 非常適合作為一種細胞損傷的危險信號啟動機體免疫反應[4,14]。而Clec9A結合F-actin 是啟動壞死細胞相關抗原表達的基礎[4-5,11-12]。此外,Clec9A 還可以識別晚期凋亡細胞,可能是由于細胞膜完整性喪失和胞膜上肌動蛋白暴露所致[11]。
3 Clec9A 通過激活胞內脾酪氨酸激酶Syk啟動內吞壞死細胞
研究表明Clec9A 是一個激活受體,也是一個內吞受體[5-6]。Clec9A 的胞質含有與 C 型凝集素 1(Dectin-1)相同的 hem-ITAM 序列,且 Dectin-1 啟動的信號通路依賴 Syk 激酶。因此,HUYSAME 等[6]構建了與Clec9A和Dectin-1胞質尾部相一致的酪氨酸磷酸化和非磷酸化形式的多肽,與RAW264.7 巨噬細胞溶解產物的信號分子進行免疫印跡反應,發現Clec9A 胞質的hem ITAM 序列能募集和活化Syk 激酶,誘導產生高水平的腫瘤壞死因子、Ⅲ型干擾素等。這些細胞因子能夠激活體內其他免疫細胞,共同清除體內壞死細胞。進一步研究確認Clec9A 結合F-actin 后依賴Syk 激酶啟動下游信號通路,內吞壞死細胞,同時信號啟動的能力與結合F-actin 的含量有關[4-6](見圖1)。
SCHREIBELT 等[7]通過 NIH3T3 成纖維細胞表面交聯Clec9A 觀察細胞表面受體,發現隨著時間推移受體數目逐漸減少,晚期核內體/溶酶體標記物LAMP-1 染色也證實細胞內形成內吞小泡。與大多數的受體攝取抗原后將抗原送入胞質溶酶體內處理不同的是,Clec9A 通過Syk 激酶信號將壞死細胞碎片轉移到一個不可降解的循環內體腔室,經過MHCⅠ類途徑提呈[10](見圖1)。這種特性可能會使Clec9A 保護抗原不被溶酶體降解,最大限度地提取抗原,繼而激活機體獲得性免疫應答。
4 Clec9A 交叉提呈壞死細胞抗原至CD8+T細胞,激活CTL
Clec9A 交叉提呈的壞死細胞抗原包括非感染的壞死細胞、病毒感染的壞死細胞和腫瘤相關抗原,在治療腫瘤、抗病毒感染中具有重要作用[5,7,10,15]。IBORRA 等[15]研究指出向小鼠注射牛痘病毒感染細胞后,Clec9A 識別壞死細胞中的配體,啟動抗牛痘病CD8+T 細胞的交叉反應(見圖1)。在高免疫原性的環境(單純皰疹病毒感染),缺乏Clec9A 的樹突狀細胞會影響 CTL 的活化[10]。體外培養BDCA3+DC 能夠交叉提呈黑色素瘤抗原肽至CD8+T 細胞[7]。此外,最新研究指出 Clec9A 可以促進CD169+巨噬細胞攝取抗原后,通過cDC1s 激活CD8+T細胞的能力[16]。
活化的CTL 通過識別MHC Ⅰ類途徑交叉提呈的抗原,特異性結合靶細胞,釋放顆粒酶與穿孔素,而不攻擊正常組織。因此,Clec9A 在機體免疫系統激活CTL 上具有一定作用,能夠感應細胞壞死信號并且誘導T細胞反應,清除靶細胞[10]。
5 應用
Clec9A能夠交叉提呈壞死細胞抗原,活化CTL,啟動機體獲得性免疫,在抗病毒感染和腫瘤治療中具有重要作用。在丙型肝炎病毒感染中,人外周血BDCA3+Clec9A+DC 細胞能產生大量Ⅲ型干擾素,直接干擾病毒的復制[17]。同樣的結果也發現在人類肝臟和扁桃體組織中的DC 上[18]。表明產生高水平的Ⅲ型干擾素是BDCA3+Clec9A+DC 的特點之一。進一步研究發現,在皮膚感染牛痘病毒的小鼠中,DNGR-1 可以促進BDCA3+DC 交叉提呈抗原,產生細胞因子IL-12、IL-15 和共刺激分子CD24,促進生成皮膚組織常駐記憶性T 細胞(Trm)[19]。此外,DN?GR-1 同樣有助于流感病毒感染后肺 Trm 的生成[19]。當皮膚和黏膜再次感染時,Trm 能夠快速啟動機體免疫應答。因此,Clec9A 通過結合F-actin 感知壞死細胞,啟動強烈的CTL 抗病毒反應,同時在機體生成抗病毒記憶細胞中也起到重要作用[15,19]。
DC 是體內連接固有免疫和適應性免疫的專職提呈細胞,靶向抗原至DC 上的Clec9A 可以引起CTL的活化,識別腫瘤細胞表面相關腫瘤抗原,并通過細胞毒性促進腫瘤細胞的死亡[20-21]。KRISTEEN等[22]合成抗腫瘤免疫治療劑抗Clec9A 抗體,該抗體能特異性與CD141+細胞結合,將抗原提呈至CD4+T及CD8+T 細胞,為制備Clec9A 抗體在腫瘤治療中提供實驗依據。ZENG 等[23]研究出含有抗 Clec9A 抗體和特異腫瘤抗原的納米制劑,發現此納米制劑能有效地將抗原提呈至靶向腫瘤浸潤的DCs,促進抗原特異性CD4+和CD8+T 細胞增殖,增強抗腫瘤的CTL反應和抗體應答。最新研究發現在此納米制劑中增加α-半乳糖神經酰胺免疫佐劑,不僅能增強CTL細胞的毒性,同時可以活化NKT 細胞,啟動機體固有免疫,為腫瘤治療提供了新思路[24]。
6 結語
機體對壞死細胞的清除障礙會導致壞死性碎片病理性的積聚,促進炎癥因子的表達,加重炎癥反應[5]。Clec9A 通過胞外 CTLD 區域不僅識別壞死細胞釋放的F-actin,同時交叉提呈至CD8+T 細胞,激活CTL 特異性殺傷靶細胞,導致壞死細胞進一步清除[5-7,10]。在治療腫瘤及抗病毒感染中具有重要研究前景。現階段對Clec9A 啟動的信號通路機制研究并不很明確,進一步探索Clec9A 的分子機制及其在病理反應中的作用,對基礎醫學和許多重大疾病的發展、診斷及治療有重要意義。