術前MRI語義特征預測顱內Ⅱ~Ⅲ級孤立性纖維瘤/血管外皮細胞瘤術后腫瘤進展的價值
張斌,李昇霖,張鵬,王藝格,韓濤,林曉強,景夢園,鄧靚娜,周俊林*
1.蘭州大學第二醫院放射科,蘭州大學第二臨床醫學院,甘肅省醫學影像重點實驗室,甘肅 蘭州 730030;2.蘭州大學第二醫院病理科,甘肅 蘭州 730030;3.蘭州大學公共衛生學院,甘肅 蘭州 730000;*通信作者 周俊林 E-mail:lzuzjl601.163.com
顱內血管外皮細胞瘤(hemangiopericytoma,HPC)起源于腦膜間質毛細血管Zimmerman細胞,約占顱內腫瘤的1%[1]。根據2016版WHO中樞神經系統腫瘤分類,孤立性纖維瘤/血管外皮細胞瘤(solitary fibrous tumor/hemangiopericytoma,SFT/HPC)劃分為3個等級,本研究僅包括Ⅱ~Ⅲ級SFT/HPC,即過去診斷的HPC和間變型血管周細胞瘤(anaplastic hemangiopericytoma,AHPC)(下文統稱HPC,使用Ⅱ級或Ⅲ級進行區分)[2]。臨床通常采取外科手術全切治療,因其具有明顯的侵襲性,術后可能發生原位復發或顱外轉移,會大大降低患者的總生存率[3]。因此,早期預測HPC術后復發、轉移的相關危險因素尤為重要。既往研究發現:HPC術后腫瘤的病理級別、手術方式、術后放療[4]與術后腫瘤進展存在密切關系,但目前相關的腫瘤術后進展預測因素僅能在術后獲得,通過術前MRI語義特征,即影像醫師對圖像主觀解釋的特征,可能對HPC臨床制定治療方案具有重要的實踐意義[5-6]。本研究擬利用HPC患者術前MRI構建預測腫瘤術后進展的Cox多因素模型,以確定HPC患者術前MRI與腫瘤復發、轉移的最相關特征。
1 資料與方法
1.1 研究對象 回顧性分析2010年10月—2017年10月蘭州大學第二醫院手術病理證實的42例顱內血管外皮細胞瘤的術前MRI及臨床資料,并以影像學方法和電話方式連續隨訪,患者術后復發、轉移或死亡定義為隨訪的終點事件;無進展生存期(progress free survival,PFS)定義為自腫瘤完全切除至腫瘤出現原位復發和(或)遠處轉移的時間;HPC術后的復發、轉移定義為腫瘤進展,反之則為腫瘤無進展。
納入標準:①具有完整的術前MRI圖像;②初次手術達到腫瘤完全或次全切除(術后72 h內頭顱MRI增強未見病灶區異常強化,或臨床手術記錄腫瘤切除程度達到Simpson I~Ⅲ級[7-8]);③隨訪資料完整;④顱外轉移需有充足的影像資料或病理報告。
排除標準:①術前接受放療;②顱內HPC由穿刺病理確診;③缺乏隨訪資料;④術前MRI圖像不完整。最終納入37例Ⅱ~Ⅲ級HPC,其中WHO分級HPC Ⅱ級15例,Ⅲ級22例;腫瘤進展組16例,包括11例復發不合并顱外轉移、1例僅顱外轉移、4例顱內復發合并顱外轉移,腫瘤無進展組21例。本研究經蘭州大學第二醫院醫學倫理委員會批準(批準號:2020A-070),免除受試者知情同意。
1.2 儀器與方法 采用Siemens Verio 3.0T超導型MR掃描儀,平掃序列包括軸位/矢狀位SE-T1WI(ITR 550 ms、TE 12 ms)、軸位FSE-T2WI(TR 2 200 ms、TE 90 ms),軸位液體衰減反轉恢復(fluid attenuated inversion recovery,FLAIR)T2WI(TR 9 000 ms、TE 110 ms、TI 2 371 ms),視野(FOV)320 mm×320 mm,矩陣256×256,軸位層厚5 mm,層間距1.5 mm,矢狀位層厚8 mm,層間距2 mm。擴散加權成像(DWI)采用SE-EPI序列加頻率選擇脂肪抑制技術,TR 4 000 ms,TE 100 ms,層厚9 mm,層間距1 mm,FOV 260 mm×260 mm,矩陣256×192。在x、y、z軸3個方向上施加擴散梯度(b值=0、1 000 s/mm2)。對比劑為Gd-DTPA 0.1 mmol/kg,流速3 ml/s,獲得軸位、矢狀位和冠狀位增強T1WI。所有患者在治療前行T1WI、T2WI、T2-FLAIR、DWI及MRI增強掃描。
1.3 圖像分析與測量 由2名具有10年臨床診斷經驗的放射科醫師采用雙盲法在PACS系統上閱片,并獨立觀察和測量病灶數據。觀察特征包括腫瘤部位、形態、瘤卒中、壞死/囊變、腦水腫程度(FLAIR圖像上腫瘤邊緣腦水腫延伸<1 cm為輕度,1~3 cm為中度,>3 cm為重度)、強化方式、瘤-腦界面(腫瘤與腦組織之間存在明顯的腦脊液信號,且連續2個層面為瘤-腦界面清晰;反之則稱為瘤-腦界面模糊)、靜脈竇侵犯、顱骨侵犯[9-10]。測量腫瘤的大小、體積、最大表觀擴散系數(maximum apparent diffusion coefficient,ADCmax)、平均ADC值(average ADC,ADCmean)、最小ADC值(minimum ADC,ADCmin)、相對ADC值(relative ADC,rADC)。當2名醫師對顱內血管周細胞瘤MR語義特征判斷結果不一致時,討論后達成一致;定量參數取2名觀察者測量的平均值作為最終結果。
1.4 隨訪 采用定期磁共振或電話方式進行隨訪。術后2年內每6個月隨訪1次,2年后每12個月隨訪1次。隨訪內容包括病史采集,頭顱MRI、胸部CT、腹部B超或全身PET/CT。每次頭顱MRI檢查期間,若臨床癥狀可疑腫瘤復發或轉移可提前進行適當部位的影像學檢查。隨訪時間截至2020年10月,研究的終點事件定為腫瘤復發、轉移或死亡。復發定義為MRI圖像上原術區位置腫瘤再現,或再次手術病理確認HPC復發。轉移定義為在任何顱外部位存在影像和病理證實的≥2個病灶的HPC。隨訪時間8~120個月,平均(57±31)個月。
1.5 統計學方法 采用SPSS 25.0軟件。正態分布的計量資料以±s表示,組間比較采用獨立樣本t檢驗;偏態分布的計量資料以M(Qr)表示,組間比較采用Mann-WhitneyU檢驗。計數資料組間比較采用χ2檢驗或Fisher確切概率法。采用Kappa檢驗對比2位觀察者之間的一致性。采用Kaplan-Meier法繪制生存曲線,并計算生存率,采用Log-rank檢驗進行生存情況分析。多因素Cox比例風險回歸模型計算各因素的風險比(hazard ratios,HR),P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 納入37例Ⅱ~Ⅲ級HPC,其中男17例,女20例,平均年齡(51±12)歲;WHO分級:HPC Ⅱ級15例(40.54%),Ⅲ級22例(59.46%);腫瘤進展組16例(43.24%),包括11例復發不合并顱外轉移、1例僅顱外轉移、4例顱內復發合并顱外轉移,無進展組21例(56.76%);術后放射治療15例(40.54%),見表1。隨訪過程中,3例(8.11%)死亡。
腫瘤術后是否進展的患者HPC病理分級和術后放療比較,差異有統計學意義(P<0.05),見表1。

表1 HPC術后無進展生存期患者術前一般資料比較
2.2 影像特征分析 2位觀察者對于顱內血管周細胞瘤影像特征(腫瘤基底、形態、瘤卒中)判斷具有較高的一致性(Kappa=0.887、1.000、0.995,P均<0.01)。顱內HPC呈均勻或不均勻T1WI等低信號,T2WI稍高信號,DWI呈高信號,ADC呈低信號,增強呈均質或異質性明顯強化。與術后腫瘤無進展組比較,腫瘤進展組中術前MRI表現為“寬基底”附著硬腦膜(P=0.002)、瘤-腦界面模糊(P=0.022)、顱骨侵犯(P=0.003)語義特征的比例高于非進展組(圖1、2,表2)。

表2 HPC術后無進展生存期的術前MRI征象及ADC值比較
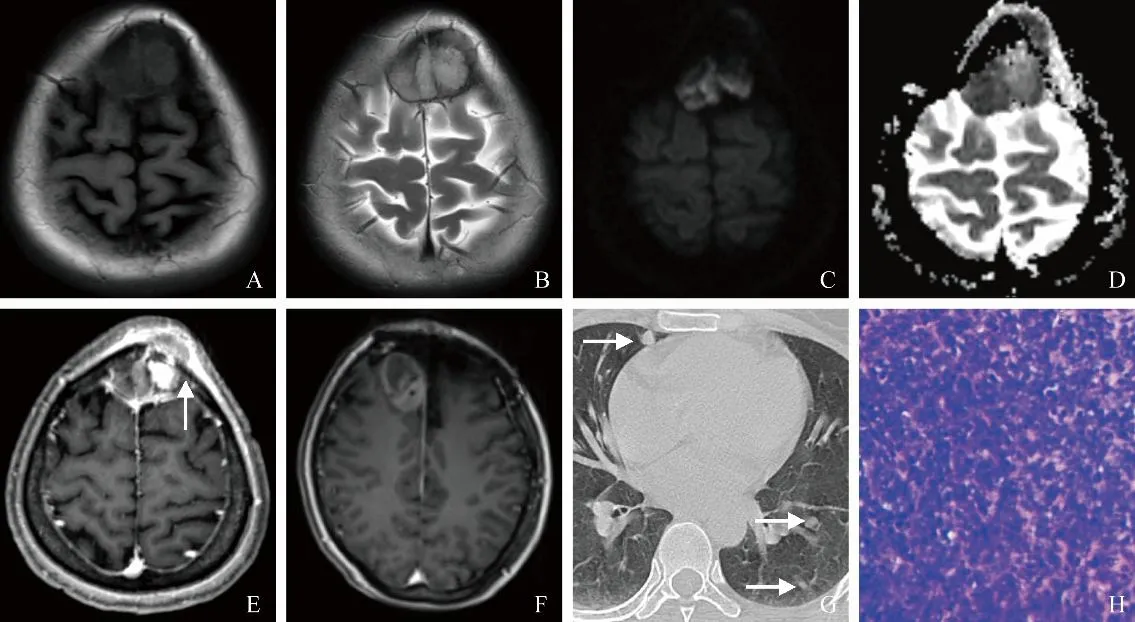
圖1 女,38歲,額部Ⅲ級HPC。術前MRI示T1WI、T2WI腫瘤信號較為均勻,額骨骨松質信號異常(A、B);DWI與ADC圖像顯示腫瘤明顯擴散受限(C、D);增強掃描呈明顯不均勻強化,腫瘤侵犯顱骨并穿透骨板(箭,E);術后8個月復查頭部MRI發現右側額部類圓形占位,增強掃描呈不均勻強化(F);術后12個月,胸部CT平掃可見雙肺多發小結節(箭),綜合考慮腫瘤原位復發并雙肺轉移(G);病理鏡下見大量異型細胞(HE,×100,H)

圖2 女,48 歲,右側頂部分葉狀III 級HPC。MRI 示腫瘤T1WI、T2WI 信號較均勻(A、B);FLAIR 示瘤-腦界面顯示不清,瘤周大片腦組織水腫形成(C);增強掃描示腫瘤均勻明顯強化,并呈寬基底附著于硬腦膜(箭,D);術后72 h 增強MRI 示矢狀竇旁結節狀強化病灶(箭,E);術后12 個月腹部增強CT 示肝內多發占位,動脈起明顯不均勻強化(箭,F);肝臟穿刺病理結果證實顱內HPC 肝臟多發轉移(HE,×200,G)
與HPC Ⅲ級比較,HPC Ⅱ級窄基底附著硬腦膜比例較高,ADC值較高(P均<0.05),而其他常規MR語義特征差異無統計學意義(P>0.05),見表3。

表3 HPC不同分級MRI征象及ADC值比較
2.3 Cox模型多因素分析 單因素生存分析發現腫瘤分級(P=0.024)、腫瘤寬基底(P=0.009)、瘤-腦界面模糊(P=0.008)、顱骨侵犯(P=0.002)、術后無放療(P=0.006)為HPC術后腫瘤進展的相關因素(表4,圖3)。

圖3 腫瘤分級(A)、腫瘤基底附著(B)、瘤-腦界面(C)、顱骨侵犯(D)和術后放療(E)的Kaplan-Meier生存分析曲線

表4 Kaplan-Meier單因素生存分析HPC術后腫瘤進展的相關因素
將上述因素納入Cox多因素回歸分析發現:腫瘤分級、顱骨侵犯、術后無放療是HPC術后腫瘤進展的獨立危險因子,見表5。

表5 COX多因素生存分析HPC術后腫瘤進展的獨立危險因素
3 討論
HPC具有一些獨特的影像表現和臨床特征,如血供豐富、壞死/囊變、侵襲性生長、術后腫瘤復發和顱外轉移[11],其中以HPC術后腫瘤進展廣受臨床關注,因為這會大大降低患者的總生存期[12],因此術前預測顱內HPC術后腫瘤進展的相關危險因素,可以為患者制定個性化術前治療方案提供重要的理論依據。本研究基于HPC術前MRI獲得的腫瘤影像學和臨床特征所構建的多因素回歸模型發現:HPC病理分級、術后無放療和腫瘤顱骨侵犯是HPC術后進展的獨立危險因素。除上述因素外,單因素分析發現腫瘤寬基底、瘤-腦界面模糊也是HPC術后腫瘤進展的影響因素。
3.1 術前MRI語義特征與HPC術后進展的聯系 本研究中,顱內HPC與硬腦膜寬基底附著是術后腫瘤進展的相關因素,可能與腫瘤沿硬腦膜浸潤性生長,粘連廣泛的硬腦膜,甚至包繞靜脈竇,從而阻礙手術徹底切除腫瘤浸潤的組織結構有關[13],HPC影像表現為廣泛的硬腦膜附著,AHPC少見腦膜尾征,這種影像學的差異本質可能與腫瘤浸潤性生長有關[14]。因此,本研究推測寬基底附著于硬腦膜可能是HPC惡性潛能的一種影像學特征,而將腫瘤分級納入多因素回歸分析時,腫瘤寬基底附著硬腦膜對于PFS的影響消失,間接提示腫瘤分級與寬基底的影像學特征存在共線性。此外,通過回顧HPC的術中記錄和病理報告,發現HPC出現腦組織侵犯的MRI表現為瘤-腦界面模糊,腫瘤包膜不連續等影像學特征,單因素分析瘤-腦界面模糊對于PFS亦存在一定的影響,在惡性腦膜瘤中瘤-腦界面模糊提示可能存在腫瘤的腦侵犯[15-16],對于臨床術者至關重要,因為這將增加手術切除腫瘤的難度,甚至為了保護功能區的腦組織而采取次全切腫瘤的手術方式,因此,術前MRI提示HPC出現瘤-腦界面模糊時,臨床術者應考慮優化手術方案,且術后可局部放療并密切隨訪,以預防腫瘤術后進展。
與既往研究結果不同[17],本研究未發現HPC大小、體積和部位對于PFS存在顯著影響,推測可能與納入樣本量較少和手術切除的難度相關,本研究中顱底HPC 9例,其中6例術后進展,可見單論顱底HPC術后腫瘤進展比率依然很高,與顱底腫瘤手術難度較大相關。由于HPC屬于顱內腦實質外的腫瘤,腫瘤的大小并不能代表HPC的分級,同時腫瘤未浸潤周圍組織結構,亦不影響手術切除的難度。此外,本研究還探討腫瘤的形態、腦水腫的程度、強化方式以及ADC值等MRI定量特征,但這些特征均無顯著差異,推測現有的MRI定量參數(如ADC值)未體現出預測價值的原因可能是Ⅱ、Ⅲ級HPC均可能在術后復發、轉移也可以無進展存活,即使在進展與無進展腫瘤分級上存在一定的差異,但這種微弱的分級差異無法在生存分析時體現出來,因此,該領域仍需要進一步探索更有價值的定量MRI指標,以預測HPC術后腫瘤進展。
3.2 多因素回歸分析HPC術后進展 運用術前MRI特征和臨床信息整合形成的多因素回歸分析發現:HPC顱骨侵犯、腫瘤高分級和術后無放療是術后腫瘤進展的獨立危險因子。顱骨侵犯定義為HPC所致顱骨骨質增生、破壞及骨髓腔內軟組織腫塊形成[7],其原因與腫瘤浸潤性生長有關,本研究中6例(85.71%)顱骨侵犯出現術后腫瘤進展,如先前腦膜瘤的相關研究,顱骨侵犯亦是腦膜瘤術后腫瘤進展的重要預測因子[8],無論惡性腦膜瘤還是HPC,顱骨侵犯提示腫瘤增殖旺盛,則腫瘤周圍結構的術中清理尤為重要,然而腫瘤細胞浸潤在術中無法用肉眼評估,因此術前MRI提示HPC存在顱骨侵犯時,應特別注意術中顱骨和硬腦膜的處理,從而預防術后腫瘤進展。其次,術后放療是HPC術后PFS的保護因素,與既往研究一致,無論腫瘤采取何種手術方式亦或是腫瘤級別高低,術后放療均有益于延長患者PFS的時間[18],HPC的浸潤生長與腦膜瘤不同,HPC血供豐富,其脈管內、瘤周硬腦膜、腦組織或顱骨髓腔內浸潤的腫瘤細胞是導致術后復發的關鍵因素[19-20],通過放療可輔助手術更好地預防腫瘤術后進展。但術后放療對于總生存期的影響尚存在爭議[21],本研究認為放療確實可降低術后腫瘤的原位復發比率,當然,還需要更大樣本研究進行探討。最后,腫瘤分級也是HPC術后腫瘤進展的獨立預測因子,本研究中Ⅲ級HPC共13例術后腫瘤進展,由于Ⅲ級HPC增殖指數≥10%,瘤周組織結構的浸潤增大了術中處理的難度,因此,對于Ⅲ級HPC需要臨床綜合處理,如盡可能的術中腫瘤全切和早期局部輔助放療的治療方案[22],基于術前MRI腫瘤特征的預測因素可以更好地輔助臨床優化手術方案、制定術后放療計劃以及規范隨訪流程,從而延長患者PFS時間。
本研究的局限性:本研究是單中心小樣本量研究,術前MRI腫瘤特征的提取可能存在局限,缺乏MRI定量參數的預測,嘗試已有的MRI定量參數(如腫瘤體積、ADC值)發現并不影響HPC患者PFS時間。
總之,本研究使用HPC患者術前MRI構建的預測模型中,腫瘤腦組織侵犯、顱骨侵犯、寬基底附著硬腦膜、腫瘤級別和術后放療是影響HPC術后PFS的預測因子,對于臨床術前治療方案的制定、術中切除范圍的確定以及術后隨訪計劃的實施均具有重要意義。

