miR-27a及其靶標PPAR-γ與冠心病合并2型糖尿病的相關性分析*
黃昌志,許學忠,劉小菁
1.海南省萬寧市人民醫(yī)院急診內分泌科,海南萬寧572000;2.海南省萬寧市婦幼保健院藥劑科,海南萬寧571500
2型糖尿病(T2DM)是冠心病(CAD)的高風險因素之一[1]。微小RNA(miRNA)已經成為多種疾病預測或診斷中最具潛力的生物學分子[2]。CHEN等[3]研究發(fā)現(xiàn),miR-27a能夠通過靶向抑制過氧化物酶體增殖物激活受體-γ(PPAR-γ)表達促進胰島素抵抗并影響糖脂代謝。PPAR-γ屬于一類配體激活轉錄因子,在控制糖脂代謝過程中發(fā)揮關鍵作用[4]。目前,已知PPAR-γ與多種代謝性疾病有關,如高脂血癥、糖尿病和CAD[5]。為了明確miR-27a在預測CAD合并T2DM方面的作用,本研究分析了CAD、T2DM及CAD合并T2DM患者中循環(huán)miR-27a及其靶點PPAR-γ的表達差異。
1 資料與方法
1.1一般資料 經萬寧市人民醫(yī)院醫(yī)學倫理委員會批準,并提供書面知情同意書。選取萬寧市人民醫(yī)院2018年12月至2019年12月的147例受試者作為研究對象,男89例,女58例,年齡37~82歲,平均(54.39±12.95)歲。男選取36例健康人群作為對照組,空腹血糖(FBG)、糖化血紅蛋白(HbA1c)、血生化指標均正常;既往無T2DM、高血壓、CAD或其他心血管疾病史,入組前3個月未因任何慢性疾病服用藥物。選取38例單純T2DM患者作為T2DM組,根據(jù)美國糖尿病協(xié)會指南[7],患者HbA1c水平≥6.5%,無其他糖尿病并發(fā)癥,且排除不穩(wěn)定型心絞痛患者、無創(chuàng)心功能檢查陽性、腦血管疾病、冠狀動脈疾病、外周動脈疾病、急性冠狀動脈綜合征者。選取36例單純CAD患者作為CAD組,根據(jù)陽性病史(心肌梗死、心絞痛和冠狀動脈旁路移植術)和/或常規(guī)12導聯(lián)心電圖上的缺血性變化(包括ST段壓低或Q波改變)和/或血管造影結果(至少有1根冠狀動脈狹窄>70%)診斷。選取37例CAD合并T2DM患者作為CAD-T2DM組,診斷為CAD,且患者HbA1c水平≥6.5%,具有T2DM病史。除上述以外,所有研究對象還需排除1型糖尿病、腦卒中、心肌梗死、惡性腫瘤、肝腎功能障礙、慢性炎癥、自身免疫性疾病。
1.2方法
1.2.1人體測量學和生物化學測量 采用標準公式[體質量(kg)/身高2(m2)]計算體質量指數(shù)(BMI)。此外,使用標準血壓計測量研究對象休息15 min后的收縮壓(SBP)和舒張壓(DBP)。禁食8 h以上收集所有研究對象的靜脈血,檢測FBG、三酰甘油(TG)、總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL)、丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)和肌酐(Cr)。另外采用酶聯(lián)免疫吸附試驗(ELISA)測定空腹胰島素(Fins)水平。胰島素抵抗指數(shù)(HOMA-IR)的計算公式如下:HOMA-Ir=[FBG(mg/dL)]×[Fins(μU/mL)]/405。
1.2.2采用實時熒光定量PCR檢測血清miR-27a表達水平 抽取靜脈血10 mL,使用750 μL TRIzol?LS試劑(美國Invitrogen公司)從250 μL血清中提取循環(huán)RNA,并用35 μL預熱(65 ℃)洗脫液進行洗脫。血清與三唑醇混合后,加入10 μL秀麗隱桿線蟲miR-39(0.05 μmol/L,由中國上海基因公司合成)。使用NanoDrop 1000(美國Thermo Fisher Scientific公司)進行RNA定量。用Taqman MicroRNA反轉錄試劑盒(美國Applied Biosystems公司)進行反轉錄。qPCR在20 μL體積反應中進行,并用Bio Rad IQ5熱循環(huán)儀(美國Bio Rad Laboratories公司)進行熱循環(huán)處理:94 ℃ 1 min,然后94 ℃ 15 s+60 ℃30 s循環(huán)40次。使用2-ΔΔCq方法計算miR-27a相對于其內參的表達水平。引物序列如下:miR-27a正向為5′-GCG GAA CTT AGC CAC TGT GA-3′;反向為5′-TGA GGA GCA GGG CTT AGC TG-3′。
1.2.3血清PPAR-γ水平檢測 根據(jù)制造商說明書,采用人PPAR-γ ELISA試劑盒(美國Protein Tech公司)檢測血清PPAR-γ水平,在450 nm波長處測定吸光度(A值)。根據(jù)擬合的標準濃度A值曲線計算血清樣本中PPAR-γ水平(pg/mL)。
1.2.4雙熒光素酶報告基因分析 經在線軟件TargetScan Human7.2預測血清miR-27a及靶基因PPAR-γ的結合位點,采用Genecreate設計并構建報告基因 pmirGLO-PPARγ-3′UTR-WT、pmirGLO-PPARγ-3′UTR-MUT。熒光素酶試驗是采用雙熒光素酶報告分析系統(tǒng)(美國Promega公司),根據(jù)產品說明執(zhí)行。HEK293T細胞分別與miR-27a、 miR-NC、 ppmirGLO-PPARγ-3′UTR-WT、pmirGLO-PPARγ-3′UTR-MUT共轉染36 h。將細胞溶解并測量熒光素酶活性。
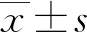
2 結 果
2.14組研究對象一般資料及生化指標水平比較 與對照組比較,CAD-T2DM組患者SBP、HbA1c、FBG、HOMA-IR、TG、TC、LDL-C水平均明顯升高,HDL-C水平明顯降低,差異均有統(tǒng)計學意義(P<0.05);4組其他一般資料和生化指標比較,差異均無統(tǒng)計學意義(P>0.05)。見表1。

表1 4組研究對象一般資料及生化指標水平比較

組別nDBP(mm Hg)HbA1c(%)FBG(mg/dL)HOMA-IRTG(mmol/L)TC(mmol/L)對照組3678.44±5.605.42±0.4397.0(88.0,107.0)0.95±0.561.48±0.393.95±0.82T2DM組3881.61±8.957.95±1.03*189.0(156.0,239.2)*2.85±1.04*1.60±0.654.81±1.72*CAD組3682.36±11.275.54±0.35#97.5(82.7,109.5)#0.96±0.47#1.85±0.73*4.96±1.26*CAD-T2DM組3782.68±12.398.53±0.89*#△198.2(153.5,257.8)*△3.38±1.25*△2.34±1.01*#△5.74±1.63*#F/χ2/H1.389173.40847.25673.01210.0959.879P0.249<0.001<0.001<0.001<0.001<0.001

注:與對照組比較,*P<0.05;與T2DM組比較,#P<0.05;與CAD組比較,△P<0.05。
2.24組研究對象血清miR-27a、PPAR-γ水平比較 與對照組比較,T2DM組、CAD組、CAD-T2DM組患者血清miR-27a表達水平降低,血清PPAR-γ水平升高,差異均有統(tǒng)計學意義(P<0.05);與T2DM組、CAD組比較,CAD-T2DM組患者血清miR-27a表達水平進一步降低,血清PPAR-γ水平則進一步升高,差異均有統(tǒng)計學意義(P<0.05)。見表2。

表2 4組血清miR-27a、PPAR-γ水平比較
2.3多因素Logistic回歸分析血清miR-27a與健康人群T2DM、CAD發(fā)生風險及T2DM患者CAD發(fā)生風險的相關性 分別以健康人群是否發(fā)生T2DM(賦值1=T2DM,0=對照組)、健康人群是否發(fā)生CAD(賦值1=CAD,0=對照組)、T2DM患者是否發(fā)生CAD(賦值1=CAD-T2DM,0=T2DM)作為因變量,校正各種混雜因素后,經多元線性回歸模型分析,血清miR-27a低表達水平可增加健康人群發(fā)生T2DM、CAD的風險或T2DM發(fā)生CAD的風險(OR=0.870、0.912、0.738,P<0.05)。見表3。

表3 單因素和多因素Logistic回歸分析血清miR-27a與及健康人群T2DM、CAD發(fā)生風險及T2DM患者CAD發(fā)生風險的相關性
2.4血清miR-27a表達水平對T2DM、CAD、CAD-T2DM的輔助診斷價值 經ROC曲線分析發(fā)現(xiàn),血清miR-27a輔助診斷健康人群發(fā)生T2DM、CAD及T2DM發(fā)生CAD的AUC分別為0.755(95%CI:0.646~0.864,P<0.05)、0.759(95%CI:0.646~0.872,P<0.05)、0.850(95%CI:0.766~0.934,P<0.05),cut off值分別為0.835、0.870、0.555,靈敏度分別為94.4%、88.9%、84.2%,特異度分別為44.7%、52.8%、70.3%。見圖1。

圖1 血清miR-27a用于輔助診斷T2DM、CAD、CAD-T2DM的ROC曲線
2.5血清miR-27a和PPAR-γ靶向調控關系 經TargetScan數(shù)據(jù)庫分析,miR-27a存在與PPAR-γ mRNA相結合的互補序列。經雙熒光素酶報告基因分析,miR-27a mimics和PPARγ-3′UTR-WT共轉染后,可降低熒光素酶活性(P<0.05),但是與PPARγ-3′UTR-MUT共轉染后,熒光素酶活性無明顯變化(P>0.05)。見圖2。

注:與miR-NC比較,*P<0.05。
2.6CAD-T2DM組患者血清miR-27a和PPAR-γ水平的關系 經Pearson分析發(fā)現(xiàn),CAD-T2DM組患者miR-27a表達水平與血液PPAR-γ水平呈負相關(r=-0.808,P<0.05)。見圖3。

圖3 CAD-T2DM組患者血清miR-27a和PPAR-γ水平的關系
3 討 論
CAD是嚴重威脅人類健康和生命的心血管疾病,多發(fā)于40歲以上人群,受高血壓、高血脂和T2DM等多種因素影響[6]。流行病學調查結果顯示,我國CAD患者合并 T2DM呈逐年升高趨勢[7]。與單純T2DM或單純CAD患者比較,CAD-T2DM患者病情更加嚴重,且會出現(xiàn)彌漫性改變征象,因而具有較高的病死率和致殘率。及時采取有效的治療和控制措施,對CAD-T2DM患者有重要意義。
本研究結果顯示,與對照組、T2DM組和CAD組比較,CAD-T2DM組患者血清miR-27a表達水平明顯降低,而且經單因素和多因素Logistic回歸分析顯示,血清miR-27a低表達水平是增加健康人群發(fā)生T2DM、CAD及T2DM發(fā)生CAD的獨立危險因素。在ROC曲線分析中,血清miR-27a可以用來分析健康人群與CAD患者或T2DM患者及T2DM患者與CAD-T2DM患者之間的區(qū)別。經Pearson相關分析顯示,CAD-T2DM組患者血清miR-27a和PPAR-γ水平呈負相關。生物信息學和熒光素酶報告基因證明,miR-27a可以直接靶向PPAR-γ基因的3′UTR并介導其相關轉錄。上述研究數(shù)據(jù)表明,miR-27a與T2DM和CAD的發(fā)生均有關,可能是兩種疾病的共病機制之一,而且miR-27a與PPAR-γ基因存在靶向調控關系,miR-27a低表達可能是引起PPAR-γ表達上調的重要原因。
CAD合并T2DM的發(fā)生是環(huán)境與多種基因聯(lián)合作用進而影響相關通路活性改變的復雜疾病[8]。PPAR-γ基因位于3號染色體,其編碼的PPAR-γ是核激素受體家族成員之一,主要在脂肪組織、造血細胞和大腸中表達。PPAR-γ控制著大量基因的表達,這些基因涉及代謝穩(wěn)態(tài)、脂質、葡萄糖和能量代謝、脂肪形成和炎癥等[9]。有研究證實,PPARs調節(jié)大量代謝通路,與代謝綜合征、T2DM、非酒精性脂肪肝和心血管疾病等代謝性疾病的發(fā)病機制有關[10]。例如PPAR-γ可通過減少基質金屬肽酶9的表達來降低斑塊的穩(wěn)定性,并通過刺激氧化低密度脂蛋白的攝入來促進泡沫細胞形成,這也可能被PPAR-γ依賴或獨立的反調節(jié)機制所抵消[11]。QIAN等[12]研究發(fā)現(xiàn),PPAR-γ基因外顯子中C161T的多態(tài)性可能會影響促炎細胞因子的分泌,并影響對CAD的易感性。HASAN等[13]研究證實,埃及人群中PPAR-γ基因rs1801282位點單核苷酸多態(tài)性可以增加T2DM發(fā)生CAD的風險。PPAR-γ可以將脂質和糖代謝的改變與CAD的發(fā)展聯(lián)系起來,尤其是在CAD合并T2DM中。有研究證實,PPAR-γ在CAD-T2DM患者血清中呈高表達,而通過PPAR-γ激動劑(如噻唑烷二酮類)誘導PPAR-γ活化后,導致PPAR-γ構象發(fā)生改變,血清PPAR-γ表達水平下降[14]。目前,很多人工合成的PPAR-γ 激動劑,如曲格列酮、吡格列酮、羅格列酮被證實可以降低T2DM發(fā)生CAD的風險,并且能夠改善CAD-T2DM的預后,但是其具體調控機制有待進一步研究。
miRNA是一種內源性非編碼RNA,可以調控靶基因轉錄后翻譯過程,其中miR-27a被證實與胰島素抵抗及血脂代謝途徑有關。YU等[15]研究證實,miR-27a可能參與了糖尿病的病理機制,如脂質代謝紊亂、氧化應激、細胞外基質沉積、腎纖維化等。本研究結果顯示,與對照組、CAD組和T2DM組比較,CAD-T2DM組患者血清miR-27a水平明顯下降,這表明與冠狀動脈事件的風險呈負相關,該結果與之前的基礎研究結論基本一致。PPAR-γ為單亞基,具有N端區(qū)(A/B區(qū))、居中高度保守的DNA結合區(qū)(C區(qū))和C端的激素結合區(qū)(E區(qū))。本研究通過TargetScan在線數(shù)據(jù)庫預測,PPAR-γ mRNA可能含有與miR-27a結合的靶向位點。通過雙熒光素酶報告基因分析,miR-27a mimics和PPARγ-3′UTR-WT共轉染后,可降低熒光素酶活性,說明miR-27a可以直接靶向PPARγ-3′UTR并介導相關轉錄。進一步通過Pearson相關分析顯示,在CAD-T2DM患者miR-27a和PPAR-γ之間存在明顯負相關,說明miR-27a低表達可能是影響PPAR-γ基因轉錄的重要上游機制之一。另外,ROC曲線分析顯示,血清miR-27a用于輔助診斷T2DM、CAD、CAD-T2DM發(fā)生的靈敏度較高,說明血清miR-27a不僅可以作為一項潛在的風險預測參數(shù),而且還可以作為1項生物標志物來區(qū)分發(fā)生CAD的T2DM患者和未發(fā)生CAD的T2DM患者。本研究納入的樣本量相對較小,miR-27a用于鑒別的實用性還需要進一步確認。
綜上所述,CAD合并T2DM患者表現(xiàn)為血清miR-27a表達水平降低,這可能是導致血清PPAR-γ水平升高的重要原因之一。檢測血清miR-27a表達水平對于輔助診斷T2DM并發(fā)CAD有一定臨床價值,而且miR-27a和PPAR-γ也有望成為未來預防或治療CAD合并T2DM的新靶點。

