中青年與老年早期胃癌患者臨床病理特征及內鏡黏膜下剝離術后淋巴結轉移的風險比較
張艷偉,張海輝,韓雙印
(鄭州大學人民醫院/河南省人民醫院 消化內科,河南 鄭州 450003)
胃癌是全球發病率第五、死亡率第三的消化道腫瘤[1],在中國的發病率和死亡率更是高居第二[2]。研究顯示,90%的胃癌患者確診時已處于進展期,5 a生存率僅為14%~25%,而早期胃癌(early gastric cancer,EGC)患者的5 a生存率高達90%以上[3-5],甚至有治愈的可能[6]。但我國EGC的檢出率僅為10%左右,遠遠低于日本(70%)和韓國(50%)的EGC檢出率[7-8]。這可能與我國早診早治覆蓋面不夠、胃癌風險人群篩查量不夠、內鏡醫生對EGC的鏡下表現診斷能力有限以及缺乏對EGC臨床病理特征的全面認識有關[9]。隨著人們生活水平的提高,胃癌的發生也呈現出年輕化的態勢。
EGC是指腫瘤僅局限于黏膜層或黏膜下層,無論其大小、范圍以及有無淋巴結轉移(lymph node metastasis,LNM)[10]。由于EGC存在LNM的潛在風險,指南[11-12]推薦對病理發現為非治療性切除的EGC患者追加胃切除術聯合淋巴結清掃術治療,但多數在附加手術中既無LNM,又無局部殘留腫瘤,尚不清楚對這些患者進行根治性手術的優點。既往研究通過隨訪僅接受內鏡黏膜下剝離術(endoscopic submucosal dissection,ESD)治療的患者與ESD術后接受根治性手術治療的患者發現,兩者5 a生存率無顯著差異[13]。因此,該建議可能被高估而造成過度治療。
目前,我國逐漸進入老齡化社會,但胃癌的發生人群逐漸趨于年輕化,中青年患者的占比逐年上升。老年人機體功能衰退相對明顯,其生理和病理狀態也有別于中青年。因此,有必要對中青年及老年EGC患者的臨床病理特征及LNM風險進行評估。為了更好地了解EGC患者的臨床病理特征并對其LNM風險進行預測,本研究整理了近3 a河南省人民醫院內鏡中心內鏡下切除的EGC數據,對比分析了中青年患者和老年患者的臨床病理特征,并根據日本的LNM風險評分系統,即eCura系統[14],對中青年組與老年組患者切除標本的治愈性進行評價,預測LNM的風險,以期為臨床應用和內鏡下操作、診斷以及ESD術后的治療策略提供新的方案。
1 資料與方法
1.1 研究對象收集2017年9月至2020年9月于河南省人民醫院消化內鏡中心接受ESD治療并且經術后病理證實為EGC的211例患者的臨床資料。根據日本胃癌治療指南將世界衛生組織病理分類中的高級別上皮內瘤變(high-grade intraepithelial neoplasia,HGIN)定義為EGC[15]。本研究經河南省人民醫院醫學倫理委員會的批準。患者及家屬簽署知情同意書。(1)納入標準:①經ESD術后病理確診為原發EGC;②術前檢查提示患者可接受ESD治療并排除遠處轉移;③未合并其他原發惡性腫瘤;④臨床資料完整。(2)排除標準:①進展期胃癌;②殘胃癌;③存在嚴重心肺功能不全、肝腎功能障礙或凝血功能障礙等不能接受ESD治療;④臨床病理資料不完整。
1.2 收集資料收集患者的臨床病理特征,包括性別、年齡、腫瘤位置、腫瘤直徑、內鏡分型、組織分化類型、浸潤深度、是否有淋巴管及靜脈浸潤、是否合并潰瘍、水平切緣及垂直切緣情況等。根據我國年齡劃分標準及收集數據特點[3]將年齡<60歲定義為中青年,將年齡≥60歲定義為老年。根據病灶部位分為近端胃(賁門、胃底、胃體上部1/3)和遠端胃。參照日本胃癌學會(Japan Gastric Cancer Association,JGCA)相關標準[11],以病變最大徑計算腫瘤直徑,將組織分化類型分為分化型和未分化型。當具有不同類型的組織分型時,按占據優勢的病理類型亞型進行分類。依照浸潤深度分為黏膜層(M)和黏膜下層(SM,其中黏膜下層侵犯深度<500 μm為SM1,黏膜下層侵犯深度>500 μm為SM2)。依據2005年巴黎分型標準更新版[16]將腫瘤的內鏡分型分為隆起型、平坦型和凹陷型。根據日本eCura評分系統[14]預測LNM的風險,對切除標本的治愈性進行評價。風險因素評分:腫瘤直徑>3 cm、靜脈侵犯、SM2和垂直切緣陽性各記1分,淋巴侵犯記3分。每例患者的總風險評分為0~7分。通過將風險因素對應的分數相加計算風險評分,然后根據評分將風險分類,即0~1分為低危,2~4分為中危,5~7分為高危。
2 結果
2.1 EGC患者的性別、年齡在211例患者中,男162例(76.8%),女49例(23.2%),男女患者比例為3.3∶1,年齡36~88歲,平均(62.43±9.43)歲。見圖1。
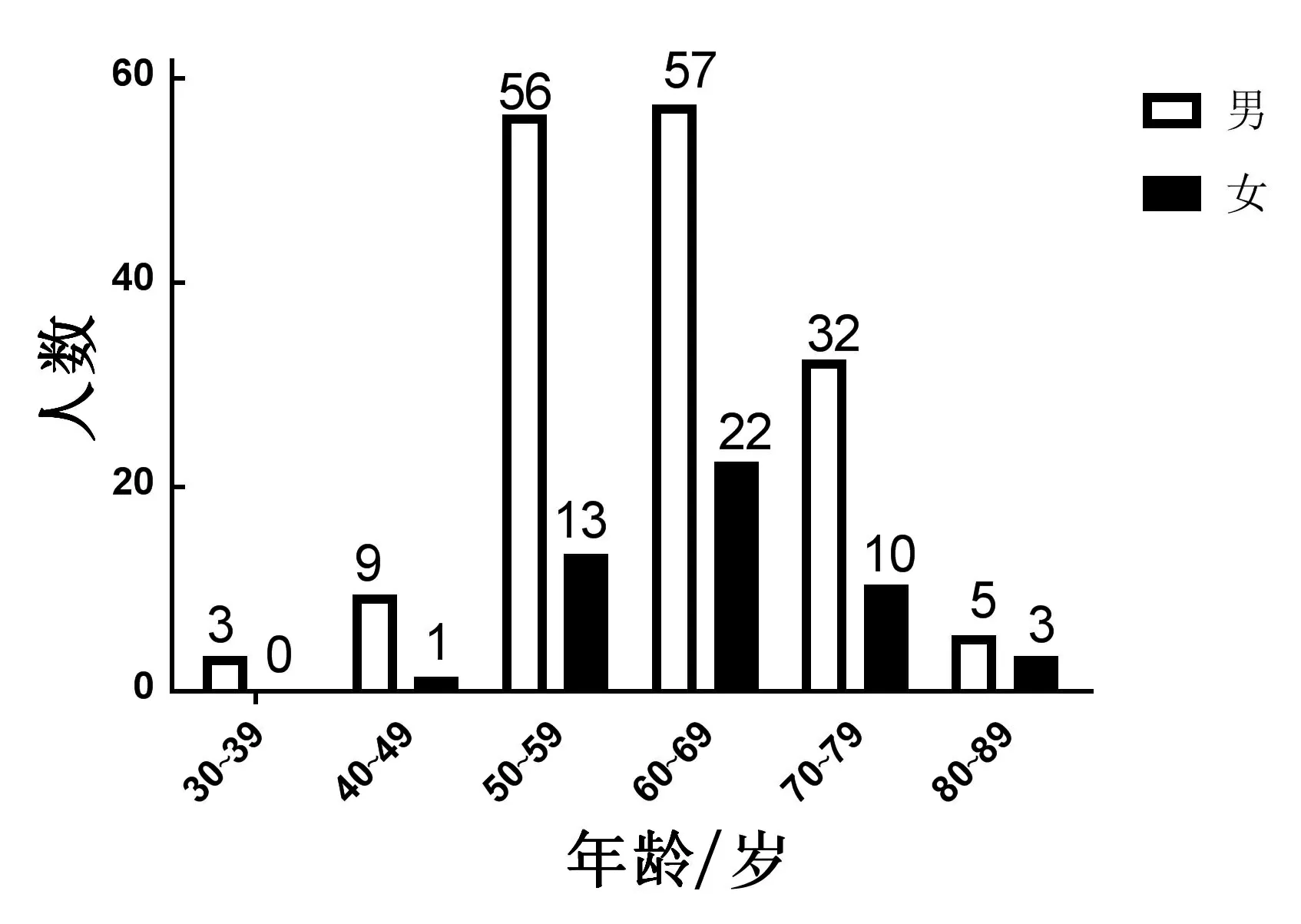
圖1 EGC患者年齡分布
2.2 中青年組與老年組EGC臨床病理特征比較老年組性別、腫瘤位置、內鏡下分型、浸潤深度、組織分化類型、淋巴管浸潤、靜脈浸潤、潰瘍以及切緣情況與中青年組比較,差異無統計學意義(P>0.05)。老年組腫瘤直徑與中青年組比較,差異有統計學意義(P<0.05)。見表1。
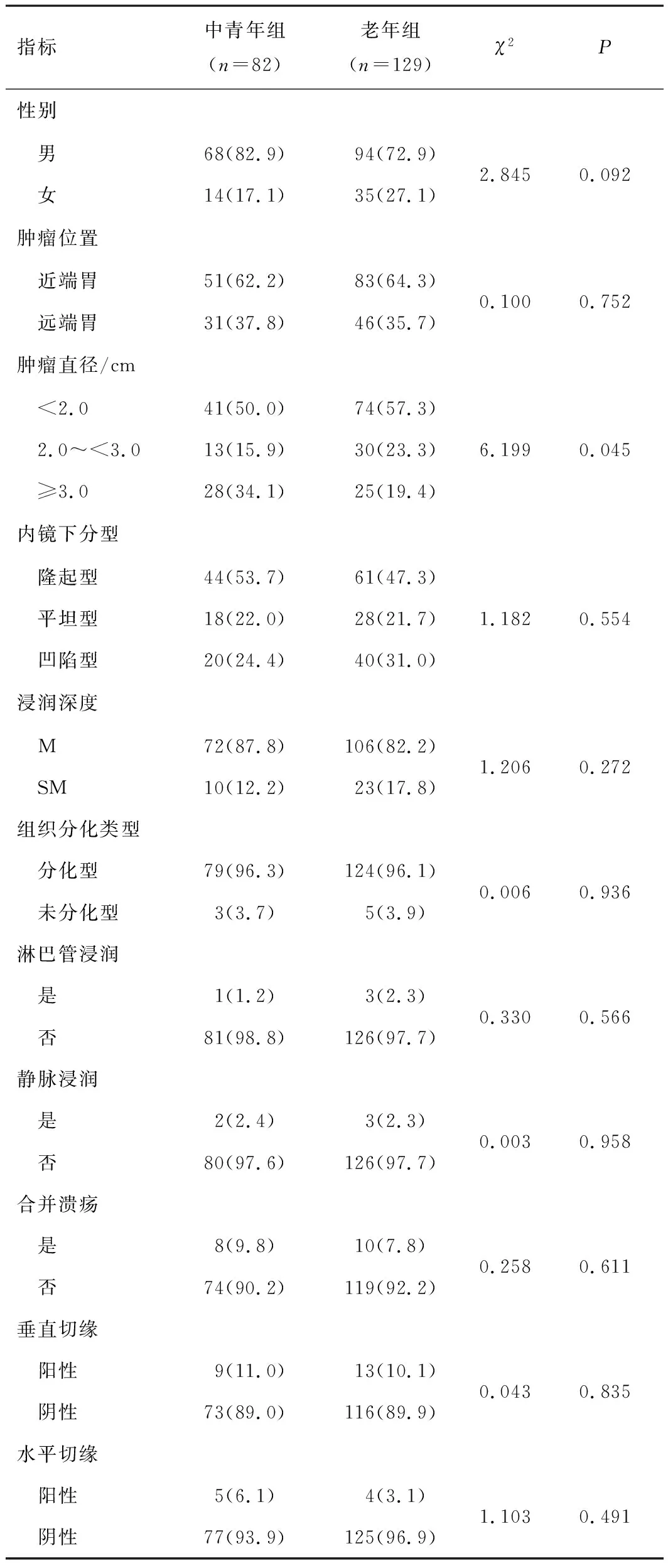
表1 中青年組與老年組EGC患者的臨床特征比較[n(%)]
2.3 中青年組與老年組LNM風險分數分布和風險分類LNM風險分數分布:中青年組患者中,0分55例,1分20例,2分5例,3分1例,4分0例,5分1例,6分0例,7分0例;老年組患者中,0分95例,1分29例,2分2例,3分1例,4分0例,5分1例,6分0例,7分1例。兩組LNM風險分類比較,差異無統計學意義(P>0.05)。見表2。
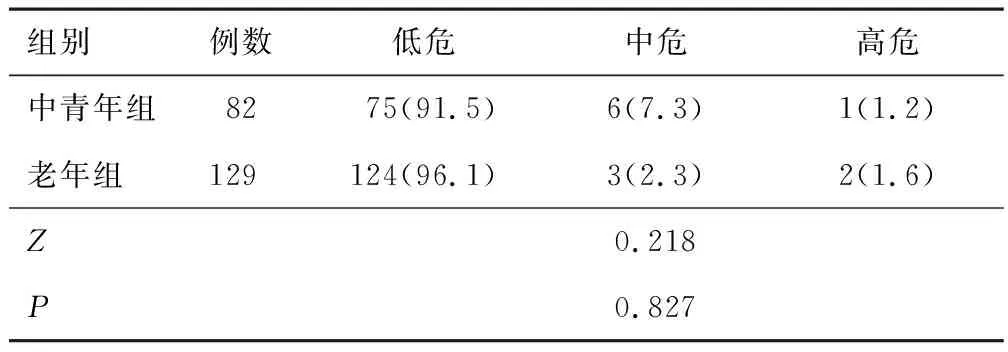
表2 中青年組與老年組LNM風險分類比較[n(%)]
3 討論
中國是胃癌的高發國家,全世界超過40%的胃癌患者來源于中國[1]。早期發現并有效切除病灶可以顯著提高胃癌患者的生存率[17]。與傳統的根治性手術比較,內鏡下切除以微創、并發癥發生率低、恢復快、治療費用低等優點成為治療EGC及癌前病變的首選方法。一項納入617例EGC患者的回顧性研究通過比較手術組與ESD組患者的預后發現,兩組患者5 a生存率無明顯差異,這肯定了ESD治療在EGC中的治愈性作用[18]。
本研究結果顯示,211例EGC患者的男女比例為3.3∶1,年齡多為50~70歲,老年組患者最多,40歲以下患者僅有3例。這可能與40歲以下胃癌發病率較低且多個地區以40歲甚至45歲為胃癌篩查的起始年齡有關[3]。胃癌發生率在一定年齡段(<70歲)隨著年齡的增長呈上升趨勢。男性胃癌發生率較女性高,這可能與男性和女性的生活、工作等差異有關,但老年組女性發病率高于中青年組的原因可能為女性雌孕激素水平隨著年齡的增長而波動[19-20]。目前針對胃癌發生的理論研究更多傾向于幽門螺桿菌感染后繼發一系列黏膜損傷。腸型胃癌的發生一般遵循幽門螺桿菌感染后引起的正常胃黏膜從慢性淺表性胃炎、慢性萎縮性胃炎、腸上皮化生、異型增生最后發展為胃癌的順序演變,而EGC多發于老年患者,這可能與隨著年齡的增長,機體免疫功能減退,幽門螺桿菌繼發的萎縮性胃炎以及后續的病理變化逐漸加重有關[21-22]。
有研究發現,胃癌多發生在遠端胃[23]。但是,本研究發現我國中青年組與老年組胃癌均多發生在近端胃。對高齡患者進行胃鏡檢查時,需要特別注意觀察近端胃,尤其是賁門附近部位,檢查困難且漏診率較高,這也可能導致EGC發現率降低[24]。值得注意的是,近端胃癌比遠端胃癌的預后要差。
在本研究中,中青年組與老年組均以腫瘤直徑<2 cm的患者較多,但老年組患者腫瘤直徑短于中青年組。這說明高齡患者的EGC更難被發現,但只要早期能夠發現病灶,其仍然具有內鏡下治療的可能性。因此內鏡檢查時要仔細觀察病變,尤其對內鏡下不易發現的腫瘤,可運用內鏡窄帶成像術等電子染色系統進一步篩查確認。病灶越大意味著內鏡下切除范圍越廣,切緣陽性率越高。在內鏡分型上,兩組患者均以隆起型最常見,這與既往研究結果[17]一致。本研究結果顯示,中青年組與老年組浸潤深度和脈管浸潤率無明顯差異。針對不同的浸潤深度原則上需要選擇不同的治療手段,如果術前明確有黏膜下深浸潤表現,按照現有數據和指南仍然首選外科手術治療[11-12]。浸潤深度以及靜脈和淋巴管浸潤是評估患者是否發生淋巴管轉移的風險因素,即浸潤程度越深,脈管浸潤發生率越高,則LNM的風險越大,患者的預后也越差[14]。雖然中青年組與老年組組織分化程度無明顯差異,但相較于中青年組,老年組未分化型較多。EGC的腫瘤分化程度即所謂的良惡性程度,分化程度越低,惡性程度越高,預后較差,早發現、早治療成為預防胃癌進展的關鍵環節[25]。
行內鏡下切除或手術切除的EGC的預后主要受LNM的影響。EGC患者發生LNM后的5 a生存率低于無LNM的患者[26]。而EGC行ESD治療后的LNM風險尚不明確。Hatta等[14]建立了一種新穎的、簡單易用的eCura評分系統,用于預測LNM的風險。在本研究中,兩組均以低危患者最常見,兩組LNM風險分類無明顯差異。這表明中青年組與老年組遠期的復發轉移風險類似。有研究顯示,在高危組中,只接受ESD治療的患者的腫瘤復發率高于ESD術后接受根治性手術的患者,而在中危組和低危組中不同手術方式的腫瘤復發率無明顯差異[27]。因此,對未治愈且有高轉移風險的ESD患者,應考慮進行額外的胃切除術,而對于低危組人群,要注意密切隨訪[26]。
總之,50~70歲男性為EGC的高發人群。中青年與老年EGC均多發于男性,病灶多位于近端胃,通常直徑<2 cm,多發于黏膜層,以分化型常見。臨床病理特征及ESD治療后LNM的風險預測可能有助于EGC患者選擇合理的治療方式。但是,本研究仍存在一定的局限性,如未將接受外科手術治療的EGC患者納入分析等。雖然應用eCura系統對LNM風險進行了預測,但未長期隨訪患者的生存情況進行驗證。進一步開展全國性的多中心EGC研究,對于制定最合適的EGC分類以及針對中國EGC患者的規范化、個體化、多學科的管理策略至關重要。

