不同環境因子對真江蘺四分孢子放散和發育的影響
王雨凡 王津果 王靜文 周偉 易樂飛 蔣書英
摘要:真江蘺是我國重要的栽培藻類,具有較高的經濟價值、藥用價值和生態價值。為了優化真江蘺四分孢子放散、附著、萌發和生長等過程的培養條件,選擇溫度、光照度和鹽度3個環境因子,采用單因素試驗研究不同環境因子對真江蘺四分孢子放散和發育的影響。結果顯示:溫度、光照度和鹽度對真江蘺四分孢子放散和發育具有顯著影響(P<0.05),當溫度為20~25 ℃、光照度為15~60 μmol/(m2·s)、鹽度為28‰~36‰時,真江蘺孢子放散量達到最大值2.8~3.3×106個/g;低溫(15~25 ℃)、低光[15~60 μmol/(m2·s)]和低鹽(24‰~32‰)有利于四分孢子的附著和萌發,真江蘺孢子附著率高于85%,萌發率高于90%;中溫(20~25 ℃)、高光[60~100 μmol/(m2·s)]和低鹽(24‰~32‰)有利于真江蘺孢子后期(直立體階段)幼苗的生長發育,線性生長速率最高可達(148.95±4.28) μm/d。研究優化了真江蘺四分孢子放散和培育的條件,為探索真江蘺室內采孢子育苗提供了理論支持。
關鍵詞:真江蘺;江蘺;四分孢子;孢子放散;采孢子育苗
中圖分類號: S968.43+4 ?文獻標志碼: A ?文章編號:1002-1302(2021)14-0160-06
作為世界范圍內廣泛分布的海洋大型藻類,江蘺屬海藻目前已記錄的種類超過100個[1-2],其中國內有30余種[3]。江蘺屬海藻含有豐富的瓊膠,占干質量的20%~30%,是提取瓊膠的重要原料,具有重要的經濟價值。世界瓊膠含量的53%來源于江蘺屬海藻,其所產瓊膠質量好,品質僅次于石花菜[4]。同時,藻體內一些天然生物活性物質,如藻紅素、牛磺酸和抗氧化酶等,可用于保健和食品領域[2,4]。作為重要的藍色碳匯,江蘺生長可吸收海水中大量的CO2,對于維系生態系統中碳氧平衡具有重要的生態意義[5]。
江蘺具有典型的三世代型生活史,包含四分孢子體世代(2n)、果孢子世代(2n)和配子體世代(n)3個交替的世代,其中成熟的四分孢子體形成四分孢子囊,經過減數分裂形成四分孢子(n),通過四分孢子釋放、附著、萌發、盤狀體階段和直立體階段發育為雌雄配子體;配子體成熟后產生不動精子和果胞,通過受精作用形成合子,繼而發育為果孢子體,寄生在雌配子體上;待果孢子體發育成熟后釋放果孢子(2n),最終形成四分孢子體[6]。完成整個生活史需要大概1年左右時間。
我國江蘺規模化栽培開始于20世紀70年代,經過半個世紀的發展,目前全國江蘺產量約35萬t(干質量),栽培規模接近1萬hm2[7],成為全國第二大栽培藻類,栽培物種主要包括龍須菜、真江蘺、脆江蘺、俄羅斯江蘺等。傳統江蘺栽培主要依靠營養繁殖,利用筏式栽培技術,采用藻段夾苗、水平或垂掛養方式。該方式具有生長快速、操作簡單、易于收獲等優勢,然而也存在占用大量起始材料、勞動力和場地等弊端[8]。據估計,收獲藻體的30%將被留作苗種,用作下一季江蘺栽培的苗種[9]。規模化栽培所用苗種的來源成為制約其產業發展的瓶頸之一。采孢子育苗是有效的解決途徑之一,在一些規模化栽培海藻中已被成功應用[8,10-11],在江蘺物種中也有應用的可能性[12-13]。該方法可以利用較少的藻體材料,生產大量均一的材料,有利于改善和緩解江蘺的產業現狀。
采孢子育苗涉及一些重要過程,如孢子放散、附著、萌發、直立體生長等。真江蘺是江蘺屬的典型物種,也是我國規模化栽培的重要藻類之一。目前,有關多因子對其四分孢子放散和孢子影響的研究有待進一步完善。鑒于此,本研究選擇溫度、光照度和鹽度3個環境因子,研究不同環境因子對真江蘺四分孢子放散和發育的影響,以期得到適宜的培養條件,旨在為探索真江蘺室內采孢子育苗提供理論數據支撐。
1 材料與方法
1.1 材料采集及預處理
野生的真江蘺四分孢子體于2019年11月10日采自青島市湛山灣潮間帶礁石(地理位置為36° 03′ N、120° 22′ E),加冰冷藏后帶回實驗室用于下一步試驗。用毛刷清潔藻體、去除泥沙后,在0.7%次氯酸鈉溶液中放置2 min,隨后用滅菌海水沖洗2次。用含有0.1 g/L卡那霉素、0.02 g/L頭孢菌素、0.2 g/L 制霉菌素、1.0 g/L硫酸鏈霉素和0.3 g/L青霉素的滅菌海水處理藻體6 h,預防藻體表面菌對四分孢子放散產生影響。將處理后的藻體在20 ℃、30 μmol/(m2·s)、鹽度32‰、光—暗周期為12 h—12 h 的條件下預培養1周待用,培養過程使用PES培養基[5]。
1.2 試驗設計及處理
選擇3個環境因子(溫度、光照度和鹽度),每個因子設置5個不同水平,其中溫度處理設置為15、20、25、30、35 ℃[其余條件:光照30 μmol/(m2·s)、鹽度32‰、光—暗周期12 h—12 h];光照度處理水平設置為15、30、45、60、100 μmol/(m2·s)(其余條件:溫度20 ℃、鹽度32‰、光—暗周期12 h—12 h);鹽度處理水平設置為24‰、28‰、32‰、36‰、40‰[其余條件:溫度 20 ℃、30 μmol/(m2·s)、光—暗周期 12 h—12 h]。將預培養藻體的一級分枝切成2 cm長的小段,隨機取10段(質量約為0.5 g)放入9 cm玻璃培養皿中,加入30 mL含PES培養基的滅菌海水,置于事先設計的條件組合下培養,每個處理重復3次,每3 d更換1次培養基。
1.3 孢子放散量的統計
每天觀察藻體表面變化,待四分孢子囊發育成熟且開始放散時,逐日統計四分孢子的放散量,直至放散結束,采用加和方式計算每個處理組藻體的總四分孢子放散量(Trel)。
1.4 孢子附著率的統計
利用倒置顯微鏡觀察四分孢子附著情況,統計24 h內四分孢子的附著總量(Tad),用以下公式計算孢子附著率(Rad):Rad=Trel/Tad×100%。
1.5 孢子萌發率的統計
用倒置顯微鏡觀察四分孢子萌發情況,統計附著后開始分裂并長成盤狀體的數目(Tgerm),用以下公式計算孢子附著率(Rgerm):Rgerm=Tgerm/Tad×100%。
1.6 生長速率的測定
當孢子發育為直立體階段時,統計幼苗的長,計算相應的線性生長速度(VL),公式如下[7-9]:
VL(μm/d)=(Ln-L0)/T。
式中:Ln為試驗結束時藻體的長度,μm;L0為試驗開始時藻體的長度,μm;T為培養時間,d。
1.7 數據處理
試驗數據采用SPSS 21.0軟件執行單因素方差分析,用Tukeys HSD法進行組間均值的配對比較,顯著性水平為0.05;所有數據均表示為“x±s”。用OriginPro 9.0繪制數據圖。
2 結果與分析
2.1 溫度對真江蘺四分孢子放散和生長的影響
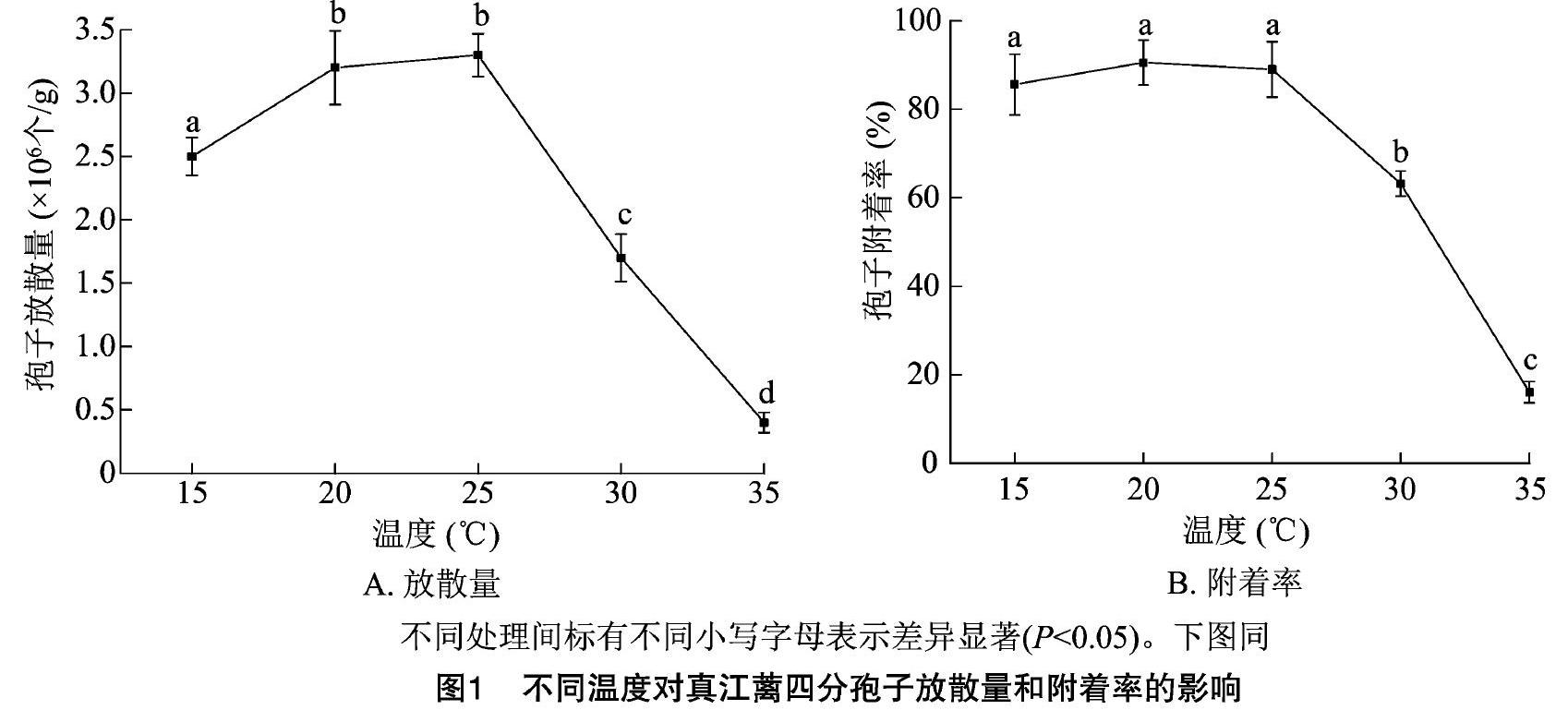
如圖1-A所示,溫度對真江蘺四分孢子的放散具有顯著影響(P<0.05),在15~35 ℃的溫度范圍內,四分孢子總放散量范圍為0.4×106~3.3×106 個/g,隨著溫度升高,呈現先升高后下降的趨勢;當溫度為20、25 ℃時,放散量達到峰值,分別為(3.2±0.3) ×106、(3.3±0.2)×106 個/g,二者之間沒有顯著性差異;當溫度達到30 ℃時,孢子放散量呈現明顯的受抑制現象,并且隨溫度升高受抑制現象明顯增強;當溫度為35 ℃時,孢子放散量達到最低值[(0.4±0.08)×106 個/g],顯著低于其他處理組(P<0.05)。
如圖1-B所示,真江蘺四分孢子放散后24 h內附著,附著率隨著溫度的變化而變化,在15~25 ℃ 溫度范圍內,四分孢子附著率為85.60%~90.56%,顯著高于其他處理(P<0.05);隨著溫度繼續升高,孢子附著率呈現顯著下降趨勢,當溫度為30 ℃時,孢子附著率為(63.20±2.84)%,約為25 ℃時附著率的2/3;附著率最低值出現在35 ℃時,為(16.10±2.42)%,顯著低于其他處理組(P<0.05)。
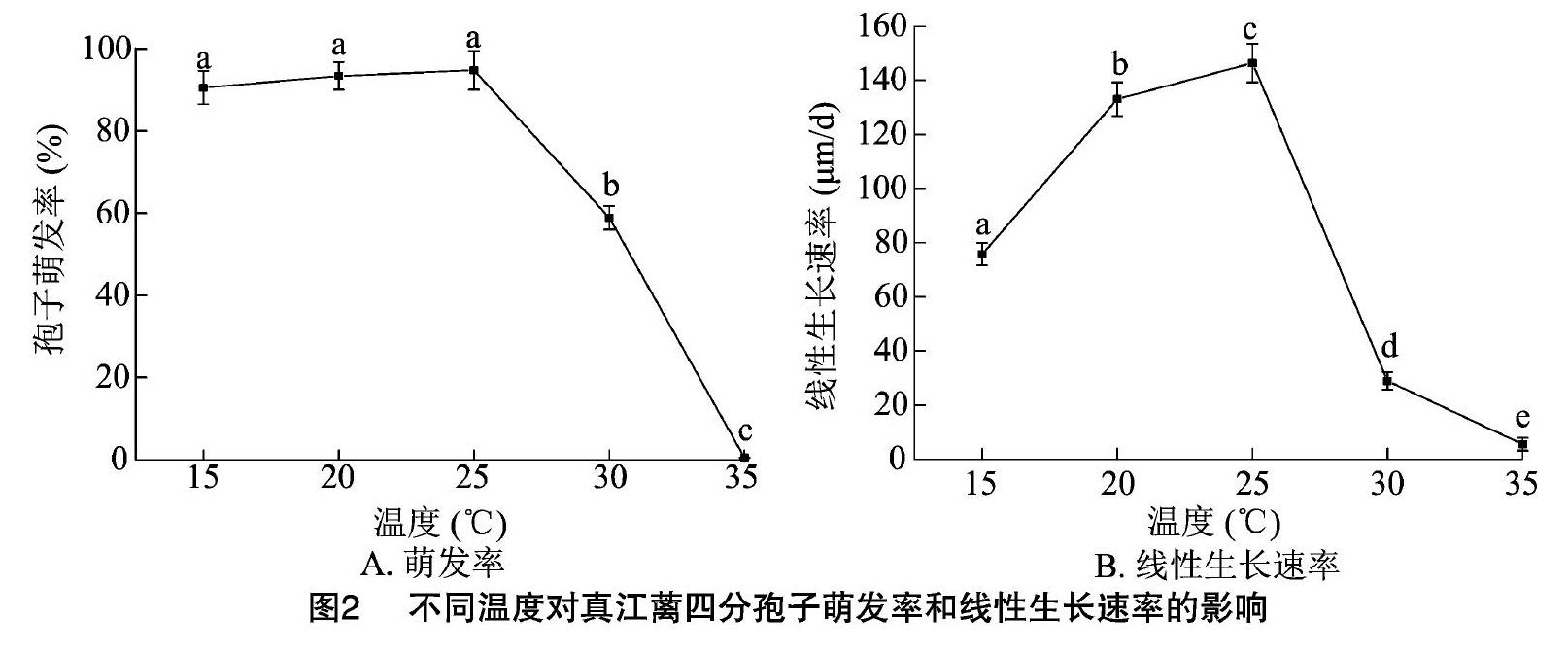
真江蘺孢子放散后不經休眠立即分裂,經多次分裂發育成盤狀體,繼而生長為直立體幼苗。溫度對附著后孢子的發育具有明顯影響,萌發率出現顯著變化(P<0.05),趨勢與附著率高度相似。如圖
2-A所示,在15~25 ℃溫度范圍內,四分孢子的萌發率為90.55%~94.80%,顯著高于其他處理(P<0.05);隨著溫度繼續升高,孢子附著率呈現顯著下降趨勢,當溫度為30 ℃時,孢子萌發率為(58.90±2.92)%,約為20 ℃時萌發率的63.1%;萌發率最低值出現在溫度為35 ℃時,為(0.50±0.03)%,顯著低于其他處理組(P<0.05)。
如圖2-B所示,溫度對萌發后的幼苗生長具有明顯影響,幼苗線性生長速率呈現先升高后降低的趨勢,具有明顯的峰值,在15~25 ℃溫度范圍內,幼苗線性生長速率隨溫度升高逐漸升高,當溫度為25 ℃時達到最大值,為(146.39±7.16) μm/d,顯著高于其他處理組(P<0.05);隨著溫度的繼續升高,生長速率呈顯著下降趨勢,35 ℃時達到最低值,為(5.47±2.38) μm/d,僅為最高值的3.7%。
2.2 光照度對真江蘺四分孢子放散和生長的影響
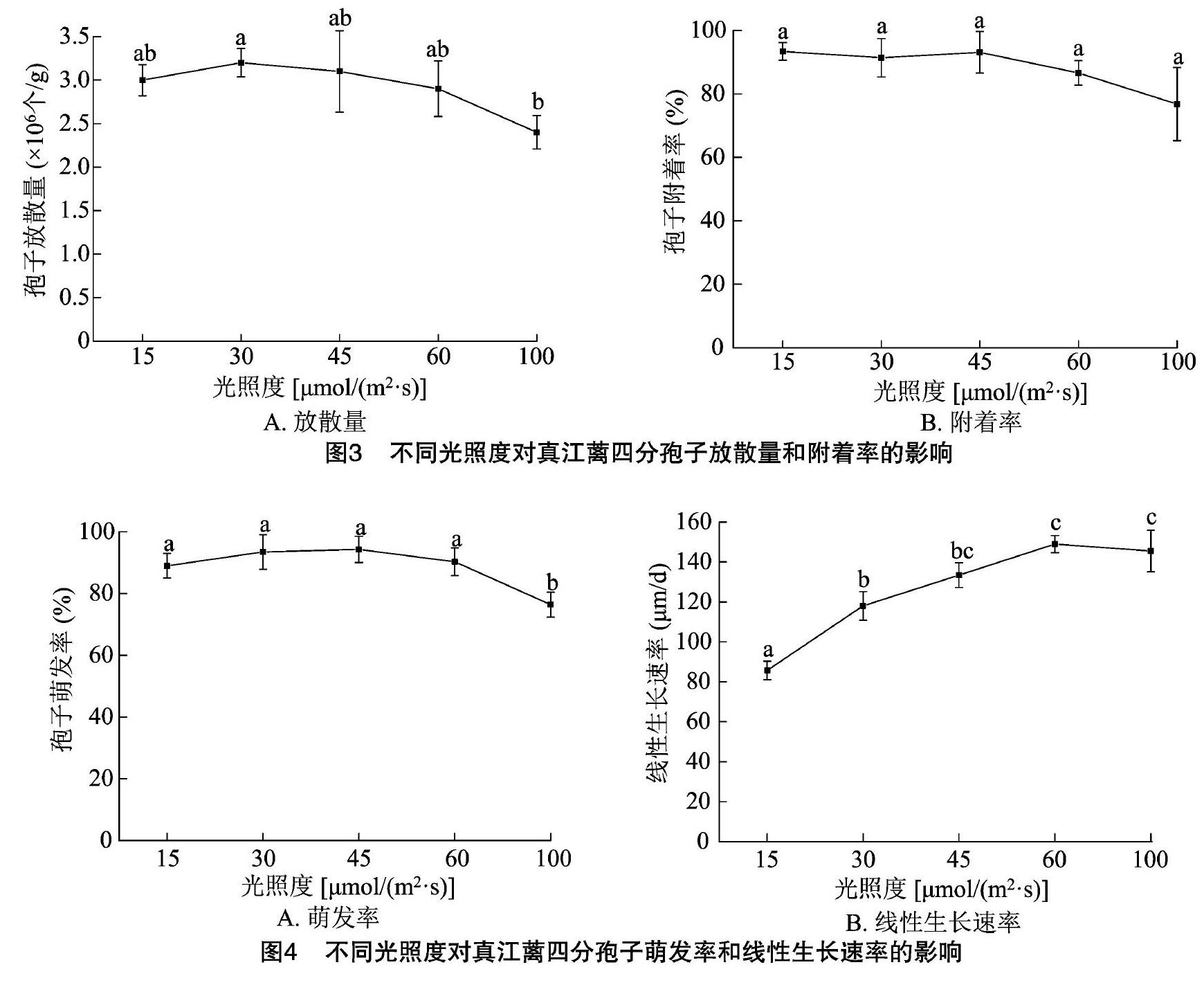
如圖3-A所示,真江蘺四分孢子的放散受光照的影響,在光照度為15~60 μmol/(m2·s)范圍內,四分孢子總的放散量為2.9×106~3.2×106 個/g,區間內各處理組間孢子放散量的變化無顯著差異;當光照度升高至100 μmol/(m2·s)時,光照顯著抑制了真江蘺孢子放散,放散量為(2.4 ± 0.192)×106 個/g,達到最低值,顯著低于其他處理組(P<0.05)。在不同光照度下,真江蘺四分孢子的附著率為76.8%~93.4%,各處理組間沒有顯著性差異(圖3-B)。
光照度對真江蘺孢子萌發的影響趨勢與光照度對孢子放散的影響趨勢相類似,表現為在高光照度下抑制孢子萌發的現象。如圖3-A和圖4-A所示,在 15~60 μmol/(m2·s)光照度范圍內,孢子萌發率為89.00%~94.30%,各處理組之間沒有顯著性差異;當光照度升高至100 μmol/(m2·s)時,孢子萌發受到顯著抑制(P<0.05),萌發率為(76.40±4.05)%,達到最低值。
如圖4-B所示,隨著光照度的升高,幼苗生長呈逐漸增快的趨勢,當光照度為15 μmol/(m2·s)時,幼苗線性生長速率出現最低值,為(85.75±4.60) μm/d,顯著低于其他處理組(P<0.05);當光照度升高至30 μmol/(m2·s)時,幼苗生長速率增加了37.6%,為(118.02±7.19) μm/d,與 45 μmol/(m2·s) 光照度處理間無顯著性差異; 當光照度為60、100 μmol/(m2·s) 時幼苗生長速率達到最大值,分別為(148.95± 4.28)、(145.47± 10.38) μm/d,2組之間無顯著性差異,但顯著高于其他處理組(P<0.05)。
2.3 鹽度對真江蘺四分孢子放散和生長的影響
如圖5-A所示,鹽度對真江蘺四分孢子放散具有明顯影響,在鹽度為24‰~36‰范圍內,真江蘺孢子放散量為2.8×106~3.2×106 個/g,各處理組間沒有顯著性差異;隨著鹽度繼續升高,孢子放散量急劇下降,當鹽度為40‰時,放散量達到最低值(1.8±0.576)×106個/g,顯著低于其他處理組(P<0.05)。鹽度對真江蘺孢子附著率的影響也呈現相似的變化(圖5-B),當鹽度為24‰~36‰時,附著率為83.5%~92.5%,顯著高于鹽度為40‰時的孢子附著率(42.1 ± 6.32)%(P<0.05)。
如圖6所示,真江蘺孢子萌發率和生長速率隨鹽度的變化而發生顯著變化(P<0.05),當鹽度為24‰~32‰時,孢子萌發率、生長速率分別為92.4%~94.2%、129.43~138.02 μm/d,各處理組間無顯著性差異;當鹽度為36‰ 時,萌發率為(76.4±3.78)%,約為鹽度為32‰時的80%,顯著低于鹽度為24‰~32‰時的處理組,此時生長速率為(118.95±5.44) μm/d,也受到高鹽度抑制;生長速率和萌發率在鹽度為40‰時達到最低值,分別為(35.47±5.38) μm/d、(2.40±0.13)%,顯著低于其他處理組(P<0.05)。
3 結論與討論
主要環境因子對海洋大型經濟海藻孢子放散的影響已有報道[2,5,10,14-15]。本研究結果顯示,溫度、光照度和鹽度等對真江蘺四分孢子放散均具有顯著影響。當溫度為20~25 ℃、光照度為15~60 μmol/(m2·s)、鹽度為24‰~36‰時,真江蘺四分孢子放散量達到最大值2.8~3.3×106個/g,高達106個/g數量級,與龍須菜(2.70×106個/g)[2,14]、皮江蘺[16]的放散量相當。孢子是全人工育苗的重要材料,大量孢子為新個體的產生提供了種源,并在海帶、裙帶菜、條斑紫菜和壇紫菜中有大量應用。目前,江蘺主要的繁育方式是營養繁殖,采用人工夾段的方式實現,栽培季節大量苗種的來源成為制約產業發展的瓶頸環節。真江蘺具有典型的三世代型生活史,其中四分孢子體世代(2n)在表皮可形成大量四分孢子囊,完全發育成熟后釋放四分孢子繼而發育成雌雄配子體新個體[6]。Destombe等研究發現,在脅迫條件下,真江蘺雌雄配子體(n)在生長穩定性方面更勝于四分孢子體(2n)[17]。Zhou等利用四分孢子實現了龍須菜的室內采孢子育苗,并在小規模試驗中取得了成功[8]。真江蘺與龍須菜屬于近緣物種,具有相似的生物學特性和相似的四分孢子放散誘導條件,如具有相同的溫度、相似的鹽度和相近的光照度[8,16],結合本研究結果發現,真江蘺釋放的大量孢子可作為實現室內采孢子育苗的重要原料,為實現真江蘺有性生殖育苗提供了可能。
在采孢子育苗過程中,孢子附著率、萌發率和生長速率是重要的3個指標。本研究結果顯示,低溫(15~25 ℃)、低光照度[15~60 μmol/(m2·s)]和低鹽(24‰~32‰)有利于四分孢子的附著和萌發,真江蘺孢子附著率高于85%,萌發率高于90%,與龍須菜四分孢子的發育較為類似[5,14],表明真江蘺四分孢子具有較高的活性和適應性,可在較寬的溫度、光照度和鹽度范圍內生存,為保障孢子發育成新個體提供了良好的基礎。中溫(20~25 ℃)、高光照度[60~100 μmol/(m2·s)]和低鹽度(24‰~32‰)有利于真江蘺孢子后期(直立體階段)幼苗的發育。本研究結果顯示,在適宜環境下真江蘺的線性生長速率高達(148.95±4.28) μm/d,與龍須菜較為類似[14],這暗示真江蘺采孢子育苗暫養時間可在較短時間(不超過10 d)內完成。
我國江蘺的栽培以龍須菜、真江蘺和脆江蘺等為主,調研發現,受營養繁殖方式的影響,產業上江蘺栽培存在長期單一苗種使用的現象,這為產業的發展帶來了諸多弊端。在智利共和國沿海,單一智力江蘺苗種的使用會導致江蘺栽培產量的急劇下滑,Buschman等分析認為,多年營養繁育導致的藻齡偏高是減產的重要原因,并提出采孢子育苗是重要的解決途徑之一[18]。傳統的育苗占用大量的起始材料、勞動力和場地,在育苗成本上,采孢子育苗比傳統的營養繁殖育苗更具優勢[19]。目前,基于采孢子育苗等技術手段的遺傳育種,已應用在多個海洋藻類物種中,如智力江蘺[18]、龍須菜[5]。在野生生物資源的修復中,采孢子繁育也發揮了重要作用,采用混合采孢子方式,可在短期內恢復可自我繁殖的自然群體[20]。諸多優勢為探索真江蘺采孢子育苗及優化過程中的培育條件等提供了更加廣闊的空間。本研究中,筆者選擇了溫度、光照度和鹽度3個環境因子,重點探討了單因素對采孢子重要過程包括孢子放散、附著、萌發和生長等階段的影響,得到了較優的培養條件,并為真江蘺采孢子育苗提供了可行性和理論支持。
參考文獻:
[1]Fei X G,Lu S,Bao Y,et al. Seaweed cultivation in China[J]. World Aquaculture,1998,29:22-24.
[2]Wang Z Y,Wang G C,Niu J F,et al. Optimization of conditions for tetraspore release and assessment of photosynthetic activities for different generation branches of Gracilaria lemaneiformis Bory[J]. Chinese Journal of Oceanology and Limnology,2010,28(4):738-748.
[3]Wu C Y. The seaweed resources of China[M]//Critchley A T,Ohno M. Seaweed resources of the world. Japan:Japan International Cooperation Agency,1998:34-46.
[4]隋正紅,胡依依,周 偉,等. 龍須菜栽培與遺傳育種[J]. 中國海洋大學學報(自然科學版),2020,50(9):98-104.
[5]Provasoli L. Media and prospects for the cultivation of marine algae[M]//Watanabe A,Hattori A. Cultures and collections of algae. Hakone:Japanese Society for Plant Physiology,1968:63-75.
[6]張學成,秦 松,馬家海,等. 海藻遺傳學[M]. 北京:中國農業出版社,2005:34-126.
[7]農業農村部漁業漁政管理局,全國水產技術推廣總站,中國水產學會. 2020中國漁業統計年鑒[M]. 北京:中國農業出版社,2020:17-50.
[8]Zhou W,Sui Z H,Wang J G,et al. Mass cultivation of economically important red alga Gracilariopsis lemaneiformis (Gracilariaceae,Rhodophyta) from tetraspores and carpospores[J]. Aquaculture,2016,460:25-31.
[9]Hurtado Ponce A Q,Samonte G P,Luhan M R,et al. Gracilaria (Rhodophyta) farming in Panay,Western Visayas,Philippines[J]. Aquaculture,1992,105(3):233-240.
[10]Ye N H,Wang H X,Wang G C. Formation and early development of tetraspores of Gracilaria lemaneiformis (Gracilaria,Gracilariaceae) under laboratory conditions[J]. Aquaculture,2006,254(1/2/3/4):219-226.
[11]Chen N C,Tang L,Guan X W,et al. Thallus sectioning as an efficient monospore release method in Pyropia yezoensis (Bangiales,Rhodophyta)[J]. Journal of Applied Phycology,2020,32:2195-2200.
[12]Polifrone M,de Masi F,Gargiulo G M. Alternative pathways in the life history of Gracilaria gracilis (Gracilariales,Rhodophyta) from north-eastern Sicily (Italy)[J]. Aquaculture,2006,261(3):1003-1013.
[13]Mantri V A,Thakur M C,Kumar M,et al. The carpospore culture of industrially important red alga Gracilaria dura (Gracilariales,Rhodophyta)[J]. Aquaculture,2009,297(1/2/3/4):85-90.
[14]Zhou W,Sui Z H,Wang J G,et al. An orthogonal design for optimization of growth conditions for all life history stages of Gracilariopsis lemaneiformis (Rhodophyta)[J]. Aquaculture,2013,392/393/394/395:98-105.
[15]Ramlov F,de Souza J M C,Farias A V F,et al. Effects of temperature,salinity,irradiance,and nutrients on the development of carposporelings and tetrasporophytes in Gracilaria domingensis (Kütz.) Sonder ex Dickie (Rhodophyta,Gracilariales)[J]. Botanica Marina,2012,55(3):253-259.
[16]Subba Rangaiah G. Growth,reproduction and spore shedding in Gracilaria textorii (Sur.) J. Agardh of the Visakhapatnam coast[J]. Proceedings of the Indian National Science Academy B,1983,49(6):711-718.
[17]Destombe C,Godin J,Nocher M,et al. Differences in response between haploid and diploid isomorphic phases of Gracilaria verrucosa (Rhodophyta:Gigartinales) exposed to artificial environmental conditions[J]. Hydrobiologia,1993,260/261:131-137.
[18]Buschmann A H,Correa J A,Westermeier R,et al. Red algal farming in Chile:a review[J]. Aquaculture,2001,194(3/4):203-220.
[19]Alveal K,Romo H,Werlinger C,et al. Mass cultivation of the agar producing alga Gracilaria chilensis (Rhodophyta) from spores[J]. Aquaculture,1997,148(2/3):77-83.
[20]Glenn E P,Moore D,Brown J J,et al. A sustainable culture system for Gracilaria parvispora (Rhodophyta) using sporelings,reef growout and floating cages in Hawaii[J]. Aquaculture,1998,165(3):221-232.

