基于生物信息學探討芍藥甘草湯作用機制
劉嫣然 施春英 李玲



摘要:基于生物信息學方法,探究了芍藥甘草湯治療疾病關鍵基因和通路。采用中藥網絡數據庫平臺(TCMSP)、GeneCards數據庫搜索芍藥甘草湯的靶點和TN(三叉神經痛)對應的所有靶點;利用細胞圖譜3.7.2軟件構建了“藥物—成分—疾病—靶點”網絡圖并對關鍵靶點進行GO和KEGG分析。研究結果表明,TCMSP數據庫共檢索得到芍藥甘草湯活性成分106個,IL1B、VEGFA、MAPK8等是芍藥甘草湯治療三叉神經痛的核心靶點,揭示了芍藥甘草湯治療三叉神經痛的作用機制。
關鍵詞:生物信息學;網絡藥理學;芍藥甘草湯;潛在機制
中圖分類號:R285.5 文獻標志碼:A
文章編號:1006-1037(2021)03-0063-08
芍藥甘草湯是由白芍、甘草組成,具有柔肝、緩急止痛的功效,其中白芍具有養血調經、柔肝止痛、平抑肝陽的功效,甘草具有健脾益氣、清熱解毒、化痰止咳、止痛的功效[1]。現代臨床研究表明,芍藥甘草湯具有顯著的解痙、抗炎、鎮痛、止咳、平喘、抗過敏、抗病毒、保肝利膽的功效,在臨床中常應用治療多種疼痛性疾病、痙攣性疾病、炎癥性疾病、帕金森病及支氣管哮喘[2]。張傳江[3]運用芍藥甘草湯治療90例三叉神經痛患者疼痛及睡眠質量的影響,有效改善三叉神經痛患者疼痛情況,提高睡眠質量。隨著中醫藥的不斷深入研究和發展[4],芍藥甘草湯在臨床中用于治療三叉神經痛的療效和應用價值逐漸被認可[5]。生物信息學是一門利用生物學、信息學、計算機科學等技術將生物信息進行采集、處理、存儲、傳播,分析和解釋生物信息以探索生命的學科[6]。網絡藥理學是綜合基因組學、蛋白質組學和系統生物學的一門新興的學科[7]。網絡藥理學為搜索和檢索傳統中藥提供了一整套系統的方法,在搜集活性成分、預測中藥靶點及機制、創新藥物等方面產生重要影響[8]。利用生物信息學和網絡藥理學技術對中藥的復方和單體進行研究成為了近年來研究熱點和國自然基金重點扶持領域。本文運用網絡藥理學和生物信息學的方法分析出了藥物的活性成分并預測其關鍵靶點[9],揭示了芍藥甘草湯治療三叉神經痛的關鍵通路及潛在作用機制,為后續的實驗驗證提供參考。
1 方法
1.1 芍藥甘草湯活性成分檢索
通過TCMSP數據庫檢索芍藥甘草湯的活性成分,在TCMSP數據庫設定口服利用度(OB)≥30、類藥性(DL)≥0.18為篩選標準;在Swiss Target Prediction數據庫(http://www.swisstargetprediction.ch/)預測芍藥甘草湯的潛在靶點;將上述得到的芍藥甘草湯的靶點導入至Uniprot(https://www.unitprot.org/)數據庫對基因進行標準化處理。
1.2 TN疾病相關靶點獲取
以“trigeminal neuralgia”為關鍵詞在OMIM(http://www.omim.org/)和GeneCards(https://www.genecards.org/)數據庫進行檢索,得到與TN有關的疾病靶點。
1.3 芍藥甘草湯治療TN的潛在靶點
運用Venn(https://bioinfogp.cnb.csic.es/tools/venny/)在線平臺獲取芍藥甘草湯與TN靶點的交集部分,得到芍藥甘草湯治療TN的潛在作用靶點。
1.4 藥物—成分—疾病—靶點網絡圖
將芍藥甘草湯的活性成分及靶點、以及“藥物—疾病”交集靶點導入Cytoscape3.7.2軟件,構建“藥物—成分—疾病—靶點”網絡圖,其中節點代表藥物、活性成分、靶點、疾病,邊代表芍藥甘草湯活性成分與疾病、疾病與靶點之間的相互作用關系。
1.5 PPI網絡圖構建及核心靶點網絡圖構建
將上述得到的“藥物—疾病”交集靶點導至STRING(http://string-db.org)數據庫,并將物種限定為人(Homo sapiens),運用String數據庫預測蛋白與蛋白之間的相互作用關系。將STRING數據庫得到的數據以tsv格式導入至Cytoscape3.7.2軟件中,根據節點度值(Degree)大于平均值作為篩選條件,得到芍藥甘草湯治療TN的核心靶點。
1.6 GO生物過程和KEGG通路富集分析
運用David(https://david.ncifcrf.gov/)在線平臺對“藥物—疾病”的交集靶點進行GO生物過程和KEGG通路的富集分析。并以P<0.05為篩選標準,然后將篩選得到的生物過程導入至OmicShare平臺,進行數據的可視化處理。
2 結果
2.1 芍藥甘草湯活性成分收集
通過TCMSP在線平臺檢索得到芍藥甘草湯的所有活性成分,以OB≥30%、DL≥0.18為篩選標準,篩選得到芍藥甘草湯活性成分106個,其中白芍13個,甘草93個,具體見表1,刪除重復值后得到芍藥甘草湯靶點共計130個。
2.2 芍藥甘草湯與TN交集靶點Venn圖
通過OMIM和GeneCards數據庫檢索TN的靶點刪除重復值后共249個,將得到的藥物靶點映射到疾病靶點中,獲得25個交集靶點,制成Venn圖,如圖1,說明芍藥甘草湯可能通過以上靶點參與治療TN。
2.3 藥物—成分—疾病—靶點網絡圖構建
將上述得到的藥物活性成分及靶點、“藥物—疾病”的交集靶點導入至Cytoscape3.7.2軟件中,構建“藥物—成分—疾病—靶點”網絡圖。圖2中共有243個節點,其中“菱形”代表白芍的活性成分,“圓形”代表甘草的活性成分,“V形”代表靶點。
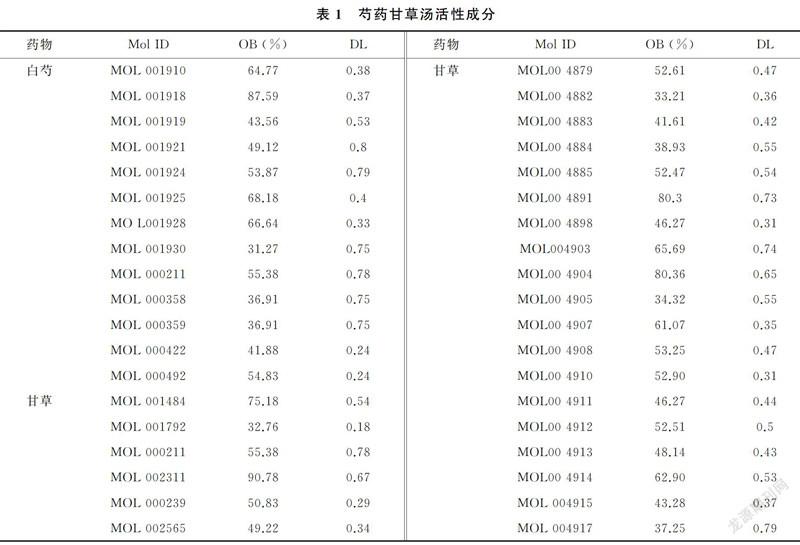
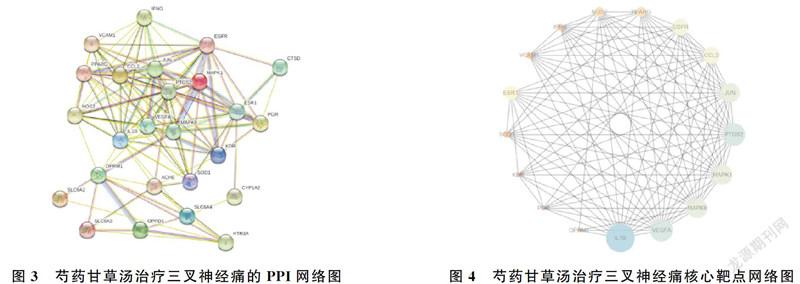
2.4 PPI網絡圖構建及核心靶點篩選
將Venn圖獲得的交集靶點導入至STRING數據庫,將物種限定為“人”(homo sapiens),得到25個節點,129條邊,平均節點數為10.3,制成PP2網絡圖,見圖3;將STRING數據以TSV格式導入Cytoscape3.7.2軟件中,以Degree值大于11作為篩選標準條件得藥物治療疾病的核心靶點網絡圖,見圖4,主要包括IL1B、VEGFA、MAPK8、MAPK1、PTGS2、JUN、CCL2等,提示芍藥甘草湯中的主要活性成分芍藥苷、谷甾醇、β-谷甾醇、山奈酚、槲皮素、苯甲酰芍藥苷、甘草黃酮可能通過以上靶點參與治療三叉神經痛。
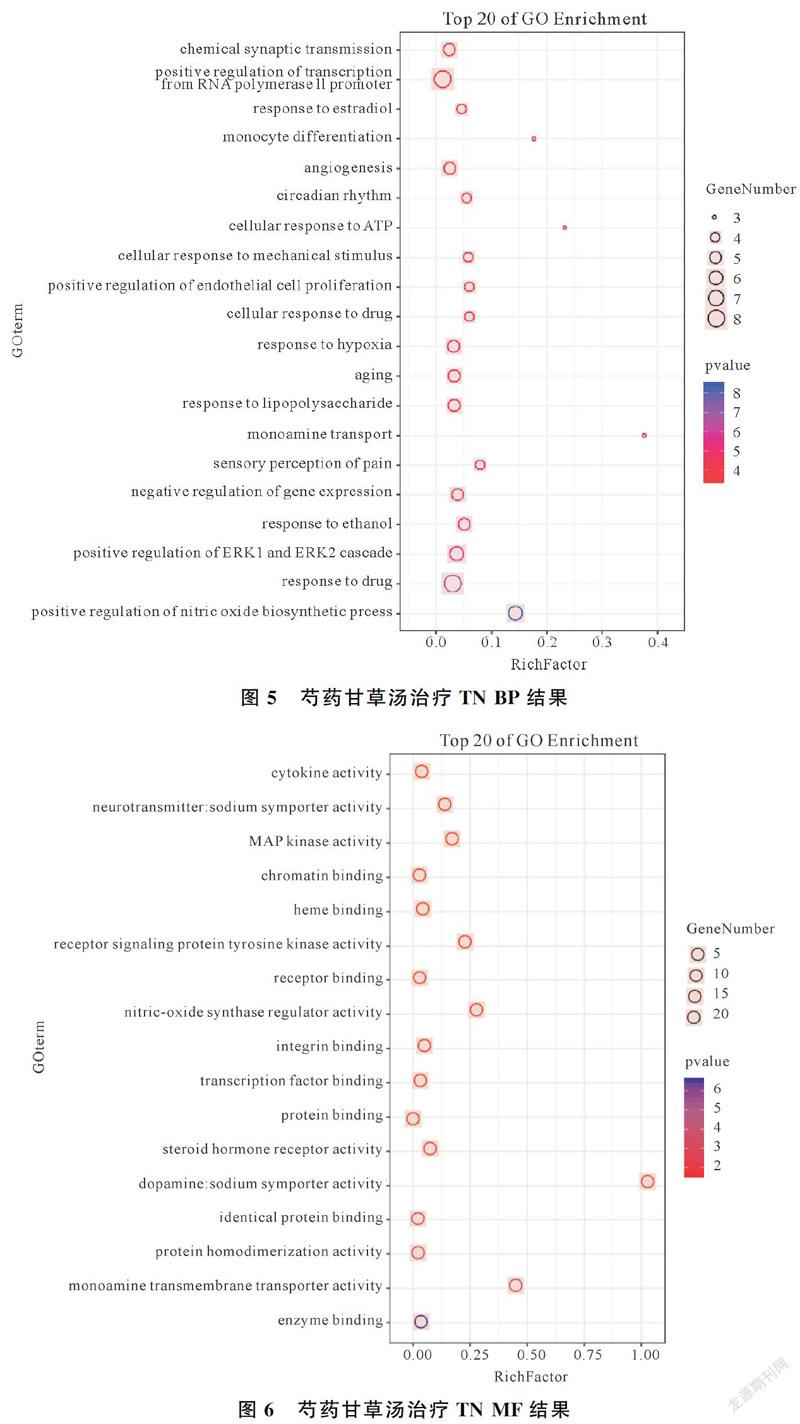
2.5 GO富集結果分析
對芍藥甘草湯治療TN的潛在靶點進行GO生物功能分析,以P<0.05和FDR<0.05為篩選標準,得到GO生物條目148條,其中生物過程109條,分子功能23條,細胞組分16條,其中BP主要涉及一氧化氮生物過程的正調控(positive regulation of nitric oxide biosynthetic process)、對藥物的反應(response to drug)、ERK1和ERK2級聯的正向調節(positive regulation of ERK1 and ERK2 cascade)等,CC主要涉及神經元投射(neuron projection)、細胞外空間(extracellular space)等,MF主要包括酶結合(enzyme binding)、單胺跨膜轉運蛋白活性(monoamine transmembrane transporter activity)、蛋白質同二聚活性(protein homodimerization activity)等。說明芍藥甘草湯的活性成分可能通過以上生物過程參與治療TN。按P值降序排列,制成氣泡圖展示,見圖5、6、7。
2.6 KEGG通路富集分析
采用2.5節同樣的方法富集分析得到44條KEGG通路(P<0.05,FDR<0.05),靶基因主要富集在癌癥信號通路、TNF信號通路、VEGF信號通路、HIF-1信號通路、雌激素信號通路、NOD樣受體信號通路以及ErbB信號通路等信號通路中,說明芍藥甘草湯的潛在靶點可能通過調控以上通路參與治療TN。按P值降序排列,將篩選出的前20條信號通路制成表格展示見表2。
3 討論
三叉神經痛被歸屬于“頭風”、“偏頭痛”范疇[10],病因多由于外感風寒或風熱,肝郁氣滯阻滯經絡,不通則痛[11],芍藥甘草湯具有滋陰柔肝、緩慢急迫止痛的功效,在臨床中常用于治療各種緩急疼痛[12]。李伯英[11]利用芍藥甘草湯加減治療三叉神經痛患者,其臨床總有效率97.1%,說明芍藥甘草湯加減能夠有效減輕三叉神經痛患者的臨床癥狀,且疾病肺的復發率低,值得推廣和應用。但由于中藥復方具有多成分、多靶點的特點,作用機制較為復雜,因此本文運用生物信息學方法探討芍藥甘草湯治療TN的作用機制,以期為實驗驗證提供理論依據。
本文通過檢索TCMSP得到芍藥甘草湯活性成分106個,包括芍藥苷、谷甾醇、β-谷甾醇、山奈酚、槲皮素、苯甲酰芍藥苷、甘草黃酮等。洪嘉琪等[13]通過實驗研究發現芍藥苷可以通過抑制炎癥因子的釋放和抑制Akt-NF-κB信號的激活減輕疼痛,且具有助眠作用[14],因此芍藥苷可以有效減輕三叉神經痛患者的疼痛及疼痛帶來的失眠癥狀。神經性疼痛多與炎癥反應有關,槲皮素可以通過調控Wnt/β-catenin信號通路,影響脊髓中炎癥因子的水平發揮鎮痛作用[15],因此槲皮素可以抑制相關炎癥因子的激活治療三叉神經痛。芍藥中的芍藥總苷和甘草中的甘草黃酮協同作用可以下調Sirt1蛋白的表達[16],減輕神經疼痛。說明芍藥甘草湯中的多個活性成分可以協同參與治療三叉神經痛。
通過圖4分析發現,芍藥甘草湯中的活性成分主要通過IL1B、VEGFA、MAPK8、MAPK1、PTGS2、JUN、CCL2等核心靶點治療三叉神經痛。IL1B是一種可以調節肌肉疼痛的炎性因子,可以誘導前列腺素的產生而發生疼痛反應,因此抑制ILIB炎癥因子可以拮抗疼痛癥狀[17]。VEGFA是血管內皮生長因子,其參與血管新生[18],可以與VEGFA-2受體結合激活TRPV1和TRPA1通路,保護感覺神經元的疼痛信號傳遞[19]。前列腺素內過氧化物合成酶2(PTGS2)可以參與調節疼痛生理病理過程,IRE1αlpha-XBP1可以通過調節PTGS2的表達參與調節疼痛反應[20]。研究發現趨化因子2(CCL2)參與慢性疼痛,巨噬細胞病理性神經疼痛的發生發展發揮重要作用,CCL2可能引起致痛因子的釋放,作用于感覺神經元。因此,提前去除巨噬細胞可以緩解由CCL2引起的熱痛覺過敏和機械痛覺過敏[21]。以上研究證實芍藥甘草湯中的多個活性成分可以通過多靶點參與治療三叉神經痛。
通過富集分析發現芍藥甘草湯主要通過一氧化氮生物過程的正調控、對藥物的反應、ERK1和ERK2級聯的正向調節、神經元投射、細胞外空間、酶結合、單胺跨膜轉運蛋白活性、蛋白質同二聚活性等GO生物過程協同參與治療三叉神經痛。KEGG通路富集發現靶基因主要富集于癌癥信號通路、TNF信號通路、VEGF信號通路、HIF-1信號通路、雌激素信號通路、NOD樣受體信號通路、E rbB信號通路等信號通路中。TNF信號通路中炎癥因子主要是TNF-α,研究表明TNF-α是參與疼痛的重要炎癥介質,白芍能在一定程度上抑制TNF-α的表達[22],因此芍藥甘草湯能在一定程度減輕三叉神經痛。ErbB信號通路在分子水平上參與疼痛的形成和發展,因此阻斷ErbB信號通路可以干擾疼痛的產生[23]。疼痛的產生與炎癥反應密切相關,研究表明HIF-1信號通路、NOD樣受體信號通路等信號通路參與炎癥反應[24],因此抑制上述信號通路相關因子的表達可以在一定程度減輕三叉神經痛的癥狀。進一步證實芍藥甘草湯可以通過多成分、多靶點、多通路參與治療三叉神經痛。
4 結論
研究通過生物信息學的網絡藥理學方法系統對芍藥甘草湯治療三叉神經痛的作用機制進行了分析。芍藥甘草湯中的成分復雜,主要通過多成分、多靶點、多通路參與治療TN,為后續用藥和后續實驗驗證提供理論基礎和理論依據。
參考文獻
[1]曲緣章, 馬生軍, 朱廣偉, 等. 芍藥甘草湯的歷史沿革與現代研究[J]. 中國實驗方劑學雜志, 2020, 26(6): 216-225.
[2]張保國, 劉慶芳. 芍藥甘草湯方劑學實驗研究[J]. 中成藥, 2012, 34(7): 1354-1358.
[3]張傳江. 芍藥甘草湯加減治療對三叉神經痛患者疼痛及睡眠質量的影響[J]. 國際醫藥衛生導報, 2018, 24(18): 2809-2812.
[4]宗彥霞. 熄風通絡止痛湯聯合針灸治療三叉神經痛療效觀察[J/OL].實用中醫內科雜志,(2020-04-14)[2020-11-14]. https://doi.org/10.13729/j.issn.1671-7813.Z20190630.
[5]胡博路, 孟潔, 胡迎芬, 等. 30種中草藥清除自由基的研究[J]. 青島大學學報(自然科學版), 2000,13(2): 38-40.
[6]臧凝子, 李品, 龐立健, 等. 基于網絡藥理學和生物信息學小青龍湯治療支氣管哮喘的關鍵基因和通路篩選[J/OL]. 中國實驗方劑學雜志(2020-10-22)[2020-11-03].https://doi.org/10.13422/j.cnki.syfjx.20202313.
[7]DUAN S, NIU L, YIN T, et al. A novel strategy for screening bioavailable quality markers of traditional Chinese medicine by integrating intestinal absorption and network pharmacology: Application to Wu Ji Bai Feng Pill[J]. Phytomedicine, 2020, 76:153226.
[8]LI S, ZHANG B. Traditional Chinese medicine network pharmacology: Theory, methodology and application[J]. Chinese Journal of Natural Medicines, 2013, 11(2): 110-120.
[9]馮鶴翔, 涂軼. 木質素生物合成的研究[J]. 青島大學學報(自然科學版), 2018, 31(1): 46-54.
[10] 曾強, 吳珍霞, 張勇, 等. 活血逐瘀解攣湯結合扳機點注射A型肉毒桿菌毒素對三叉神經痛患者TNF-α、IL-6水平的影響[J]. 廣州中醫藥大學學報, 2020, 37(8): 1421-1425.
[11] 李伯英. 芍藥甘草湯加減聯合針刺療法治療原發性三叉神經痛的效果觀察[J]. 承德醫學院學報, 2018, 35(2): 129-131.
[12] 寧云紅, 郭承偉. 以21篇臨床文獻綜述芍藥甘草湯應用概況[J]. 中醫藥導報, 2017, 23(3): 83-84+88.
[13] 洪嘉琪, 史家欣, 敖歡, 等. 芍藥苷通過抑制脊髓Akt-NF-kB信號通路及小膠質細胞激活緩解炎癥性疼痛[J]. 中國生物化學與分子生物學報, 2018, 34(3): 325-333.
[14] 孟勝喜, 霍清萍. 芍藥苷對神經系統的作用及其機制的研究[J]. 西部中醫藥, 2020, 33(4): 150-153.
[15] 嚴進紅, 韓克躍, 夏杰,等. 槲皮素減輕紫杉醇致神經病理性大鼠疼痛的作用與機制[J]. 天然產物研究與開發, 2019, 31(12): 2065-2070+2181.
[16] ZHOU D L, ZHANG S Q, HU L, et al. Inhibition of apoptosis signal-regulating kinase by paeoniflorin attenuates neuroinflammation and ameliorates neuropathic pain[J]. Journal of Neuroinflammation, 2019, 16(1):doi: 10.1186/s12974-019-1476-6.
[17] MANJAVACHI M N, MOTTA E M, MAROTTA D M, et al. Mechanisms involved in IL-6-induced muscular mechanical hyperalgesia in mice[J]. Pain, 2010, 151(2): 345-355.
[18] HULSE R P. Role of VEGF-A in chronic pain[J]. Oncotarget, 2017, 8(7):10775-10776.
[19] 褚雪鐳, 侯成志, 毛昀,等. 芍藥甘草湯治療癌性疼痛作用機制的網絡藥理學研究[J]. 海南醫學院學報, 2019, 25(22): 1686-1692.
[20] SARAH M R, GONZALEZAD B, MATTHEW M C, et al. SNPs in PTGS2 and LTA predict pain and quality of life in long term lung cancer survivors[J]. Lung Cancer, 2012, 77(1):217-223.
[21] 沈怡佳, 陳輝, 熊源長. 趨化因子在慢性疼痛中的作用研究進展[J]. 中國疼痛醫學雜志, 2017, 23(11): 846-850.
[22] LI Q S, ZHANG X. Epigallocatechin-3-gallate attenuates bone cancer pain involving decreasing spinal Tumor Necrosis Factor-α expression in a mouse model[J]. International Immunopharmacology, 2015, 29(2):818-823.
[23] 熊瓊, 王龍, 王晞. NRG-ErbB信號在神經病理性疼痛中的研究進展[J]. 醫學綜述, 2017, 23(5): 877-881+886.
[24] 朱培, 唐夢燕, 閆東梅. HIF-1α及其相關信號轉導通路在疾病中的研究進展[J]. 中國免疫學雜志, 2020, 36(13): 1650-1653+1657.

