楊梅黃酮對皮膚光老化及NF-κB信號通路表達的抑制作用
謝璟 鄭炎焱 徐曉敏 朱莉
皮膚光老化是指長期日光中的紫外線照射皮膚后引起的皮膚老化現象[1]。引起光老化的紫外線主要是長波紫外線(ultraviolet A,UVA),中波紫外線(ultraviolet B,UVB),其中,大部分UVB被皮膚表皮吸收,小部分UVB可到達真皮淺層,而UVA可穿透表皮直達真皮深處,并在細胞中長期累積[2]。長期紫外線輻射可導致機體產生大量的活性氧(reactive oxygen species,ROS),由于ROS的產生,體內氧化應激通路被啟動,進一步激活核轉錄因子κB(NF-kappaB,NF-κB)信號通路表達,引起炎癥損傷、膠原蛋白降解,甚至誘發皮膚癌[3]。當前,開發具有抗氧化活性的藥物來抵抗紫外線的輻射并預防和延緩皮膚老化,已成為皮膚醫學領域的研究熱點。楊梅黃酮(Myricetin,Myr)是楊梅樹中提取的黃酮類抗氧化劑,可以與金屬形成螯合物,減少金屬離子對氧化作用的催化活性、抑制氧化酶活性、減少α-生育酚自由基等方式發揮抗氧化作用。此外,Myr還具有多種生物學活性,包括抗癌、防癌、抗菌、抗病毒、抗炎等[4]。但目前,Myr對紫外線誘導的皮膚光老化保護作用及潛在機制尚不清楚。本研究旨在通過建立小鼠和角質細胞光老化模型,初步探討Myr對皮膚光老化及NF-κB通路表達的抑制作用,現報道如下。
1 材料和方法
1.1 實驗動物和材料 選取雄性健康SPF級昆明小鼠50只,體重(30±2)g,鼠齡6~8周,購自溫州醫科大學實驗動物中心。小鼠飼養在SPF級動物房內,每籠10只,自由攝食攝水,動物房室溫控制在20~25℃,濕度60%,12 h明暗周期循環。本實驗經溫州醫科大學動物倫理委員會批準。人皮膚角質形成(human keratinocytes,HaCaT)細胞購自中國典型培養物保藏中心;紫外線照射計和SS-03AB型紫外線光療儀(UVA燈管6支≤20J/cm2;UVB燈管4支,≤5 J/cm2)購自中國上海SIGMA高技術有限公司;細胞培養基和FBS均購自美國Gibco公司;Myr購自中國西安開來生物技術工程有限公司;核轉錄因子κB抑制蛋白(inhibitor of nuclear factor kappa-B kinase,IκB)-α和環氧化酶(cyclooxygenase,COX)-2抗體購自中國Proteintech公司;MTT試劑盒和BCA蛋白檢測試劑盒購自中國碧云天生物技術有限公司;青霉素、鏈霉素和胰酶購自美國Sigma公司;抗氧化指標檢測試劑盒購自中國Solarbio公司;引物序列由上海吉瑪制藥技術有限公司合成。
1.2 方法
1.2.1 小鼠光老化模型構建 光老化小鼠模型構建參考文獻[5]:將光療儀固定于暗室頂部,照射高度為30 cm;采用嬰兒理發器剃除小鼠背部的絨毛,再用脫毛膏二次脫毛,然后采用隨機數字表法分為5組,即空白對照組(未經紫外線照射和藥物處理)、模型對照組(背部涂抹0.9%氯化鈉溶液2 ml)、低劑量組(背部涂抹5 mg/ml Myr 2 ml)、中劑量組(背部涂抹20 mg/ml Myr 2 ml)、高劑量組(背部涂抹50 mg/ml Myr 2 ml),每組各10只;除空白對照組外,每組均隔日照射紫外線,照射前l h涂抹藥物或0.9%氯化鈉溶液,30 min后用棉簽拭去殘留藥物;照射強度為UVB 0.18 mW/cm2,UVA 1.25 mW/cm2,第1周至第7周每次照射時間為30 min,以后每周照射時間延長10 min,12周時每次照射時間為80 min,直至14周終止(建模期間UVA照射計量累計達148.5 J/cm2,UVB照射計量累計達21.38 J/cm2);定期觀察各組小鼠背部皮膚皺紋生成、色素沉著、皮膚角化、毛細血管擴張等現象。
1.2.2 小鼠皮膚組織形態學檢測 小鼠末次造模實驗結束24 h后,采用戊巴比妥鈉腹腔注射處死,取照射區部分皮膚組織,中性甲醛固定,乙醇系列脫水,二甲苯透明,常規石蠟包埋,制成切片后分別進行HE染色和膠原纖維染色。
1.2.3 HaCaT細胞光老化模型構建 采用含10%FBS,100 U/ml青霉素和100μg/ml鏈霉素的DMEM培養基,在37℃、5%CO2和20%O2條件下培養HaCaT細胞。將HaCaT細胞按2.5×106個/ml接種在6孔板中,2 ml/孔,培養24 h后,用PBS清洗細胞2次后并向每孔加入2 ml PBS,分別采用0、15、20、25、30 mJ/cm2UVB(發射峰為313 nm)處理細胞,每種劑量設8個復孔。采用MTT試劑盒檢測各組細胞活性(操作嚴格按照試劑盒說明書),確定細胞半數致死劑量。按5×104個/孔接種細胞,培養24 h后,分別采用含0、5、15、25、35、50μM Myr的培養基(分別為0、5、15、25、35、50μM Myr組)培養細胞24 h,每個Myr濃度組做8個復孔。用PBS清洗細胞2次后并加入1 ml PBS,采用半數致死UVB劑量處理細胞,并以未經紫外線照射和藥物處理細胞作為對照組,檢測各組細胞活性。
1.2.4 抗氧化能力檢測 去除小鼠背部照射區皮膚皮下脂肪并稱重,制成10%組織勻漿,3 000 r/min離心10 min,取上清液進行ROS水平測定。皮膚組織抗氧化能力檢測指標包括超氧化物歧化酶(superoxide dismutasea,SOD)水平、總抗氧化力(total antioxidant capacity,T-AOC)和羥脯氨酸(hydroxyproline,HYP)水平,嚴格按照試劑盒說明書操作。采用流式細胞術測定細胞內ROS水平,即各組細胞經胰酶消化并用1ml PBS重懸后,添加ROS細胞滲透性指示劑CM-H2DCFDA至終濃度1μM/ml,37℃暗室孵育30 min后,流式細胞儀檢測活細胞內的ROS積聚情況。
1.2.5 IκBα和COX-2表達水平檢測 采用Western blot法檢測。使用細胞裂解液將細胞裂解后,取上清液,BCA法測定總蛋白濃度;30μg蛋白上樣,經15% SDSPAGE電泳分離后將蛋白轉移至PVDF膜上,5%脫脂奶粉封閉1.5 h;按照磷酸化(p)-IκBα、IκBα、COX-2和βactin說明書中建議的使用濃度,4℃過夜孵育PVDF膜;漂洗PVDF膜,加入二抗,室溫孵育1.5 h后漂洗,并進行顯影,Quantity One軟件掃描各條帶的光密度并分析結果。
1.2.6 IκBα和COX-2 mRNA表達水平檢測 提取細胞和組織RNA后,逆轉錄合成cDNA,以cDNA為模板,qRT-PCR檢測樣本中的COX-2表達量。IκBα上游引物:5'-TGAGGACCAGCAGTGTCTTG-3',下游引物:5'-CATCGTTGATCACAAGTCGG-3'。COX-2上游引物:5'-TAAGTGCGATTGTACCCGGAC-3',下游引物:5'-TTTGTAGCCATAGTCAGCATTGT-3'。
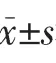
2 結果
2.1 紫外線照射后小鼠皮膚外觀及組織形態 空白對照組小鼠背部皮膚細膩光滑,皮膚色澤正常,富有彈性;皮膚結構、層次清晰,毛囊汗腺等完整可見,膠原纖維呈波浪狀緊密排列,整齊有序,分布均勻,膠原束的走向大多與皮面平行。其余各組經紫外線照射8周后,均出現不同程度的皮膚粗糙增厚,紋理加深加寬,鱗屑增加,皮膚皺褶明顯,毛細血管擴張現象。模型對照組表皮不規則增厚,伴有角化過度,真皮膠原纖維排列紊亂,膠原束散開,彈力纖維增多、扭曲,以毛囊周圍增多較明顯;不同劑量的Myr處理后,表皮厚度不一,與模型對照組比較,真皮膠原纖維變性程度輕,排列呈現不同程度的紊亂,彈力纖維有所減少。其中,以中劑量組光老化反應和組織病變程度最輕,皮膚稍粗糙增厚,表面有少許鱗屑,皮膚可見淺皺褶,毛細血管輕微擴張。組織病理顯示表皮不規則增厚,伴有角化過度,真皮膠原纖維排列較紊亂,膠原束部分散開。見圖1(插頁)。
2.2 紫外線照射后各組小鼠皮膚抗氧化能力及IκBα和COX-2 mRNA表達水平比較 見表1。
由表1可見,經紫外線照射后,各組小鼠皮膚組織抗氧化指標(SOD、T-AOC和HYP)及NF-κB信號通路相關指標(IκBα mRNA、COX-2 mRNA)差異均有統計學意義(均P<0.05)。與模型對照組比較,低劑量組和高劑量組T-AOC活性升高,中劑量組SOD活性升高,低劑量組COX-2 mRNA表達水平降低(均P<0.05);與空白對照組比較,中劑量組SOD活性、T-AOC活性和HYP水平均升高,而IκBα mRNA表達水平降低(均P<0.05)。
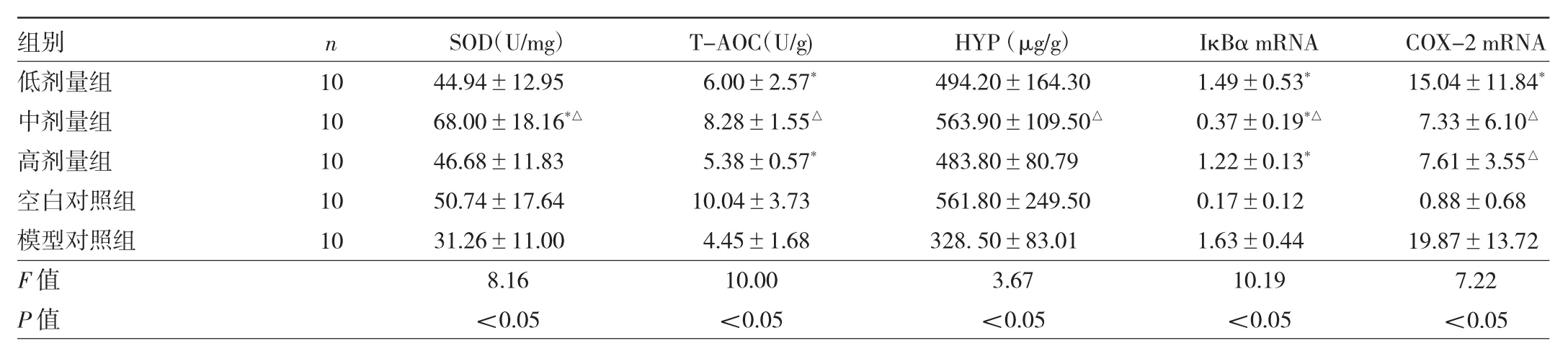
表1 紫外線照射后各組小鼠皮膚抗氧化能力及IκBα mRNA和COX-2 mRNA表達水平比較
2.3 紫外線照射后各組小鼠HaCaT細胞活性和ROS水平比較 見圖2。
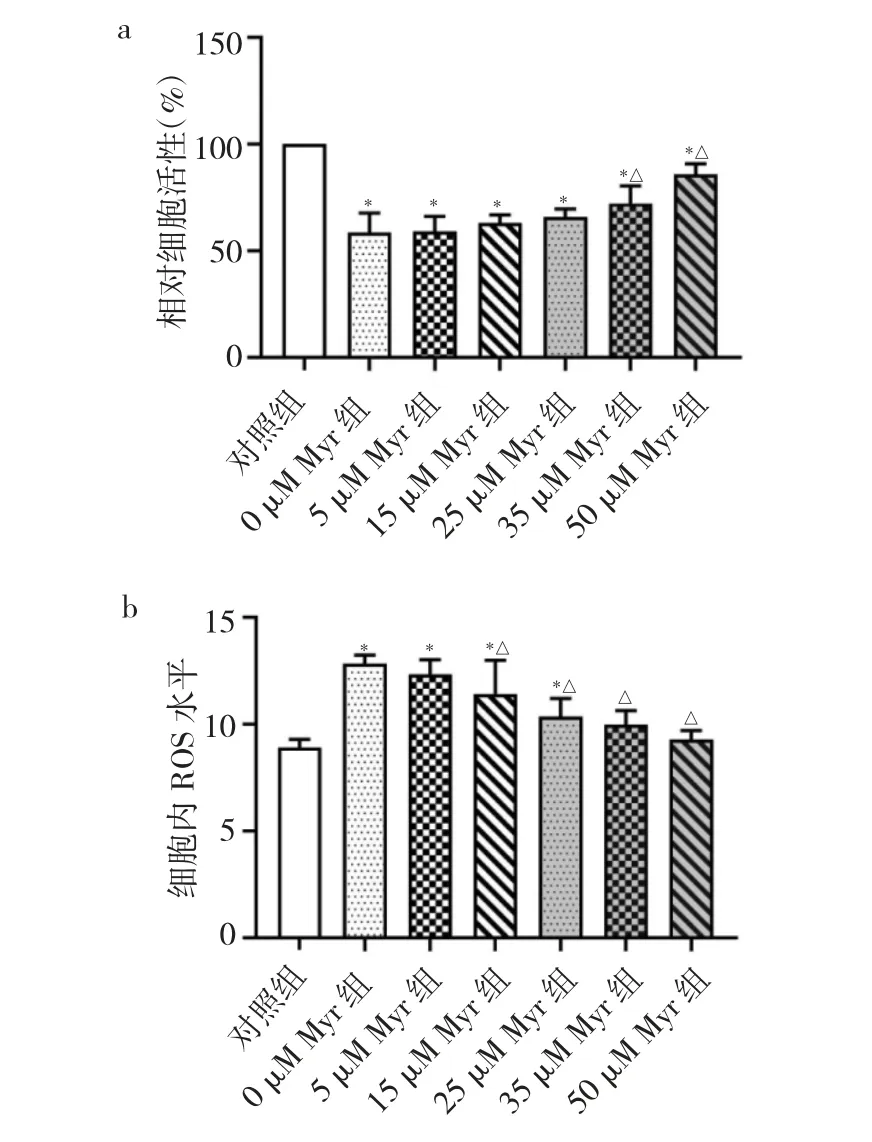
圖2 紫外線照射后各組小鼠人角質形成(HaCaT)細胞活性和活性氧(ROS)水平比較(a:各組小鼠HaCaT細胞活性比較;b:各組小鼠細胞內ROS積聚水平比較;與對照組比較,*P<0.05;與0μM Myr組比較,△P<0.05)
由圖2可見,隨著UVB劑量的增加,HaCaT細胞的活性逐漸降低,半數致死劑量約為20 mJ/cm2,其細胞活力為無UVB照射時的(58.60±9.07)%。在20 mJ/cm2UVB照射條件下,HaCaT細胞的活力隨著Myr處理濃度升高而上升,當Myr濃度達到35、50μM時,細胞活性分別為對照組的(72.20±8.26)%和(85.80±4.97)%,與0μM Myr組比較,差異均有統計學意義(均P<0.05)。UVB照射后,細胞內ROS水平均不同程度升高,但Myr可抑制ROS上調,與對照組比較,當Myr濃度為35、50μM時,組間ROS水平差異無統計學意義(P>0.05)。
2.4 紫外線照射后各組小鼠HaCaT細胞IκBα和COX-2表達水平比較 見表2、圖3。
由表2、圖3可見,經紫外線照射后,與對照組比較,0μM Myr組p-IκBα、IκBα蛋白、IκBα mRNA、COX-2蛋白及COX-2 mRNA表達水平均升高(均P<0.05),50μM Myr組p-IκBα蛋白、IκBα mRNA、COX-2蛋白及COX-2 mRNA表達水平均降低(均P<0.05)。
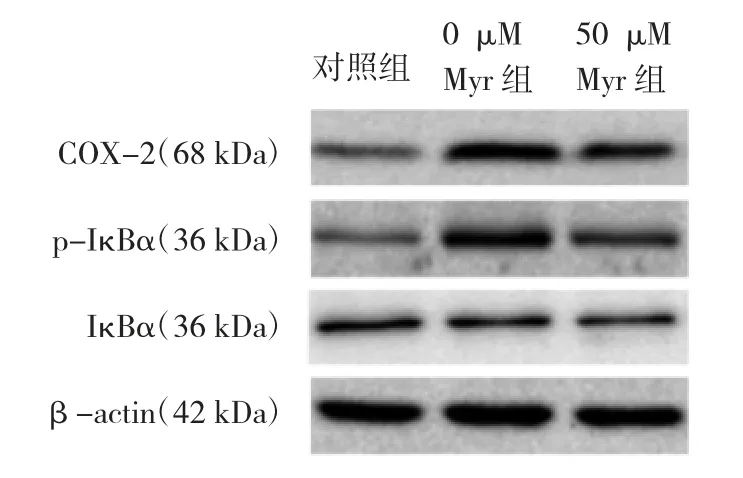
圖3 加入楊梅黃酮(Myr)紫外線照射后皮膚磷酸化核轉錄因子κB抑制蛋白(p-IκBα)、核轉錄因子κB抑制蛋白(IκBα)和環氧化酶(COX)-2蛋白表達的電泳圖
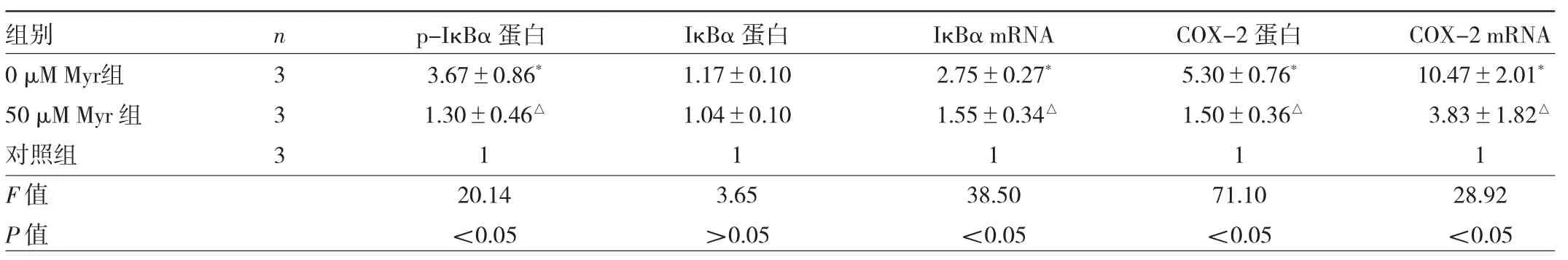
表2 紫外線照射后各組小鼠HaCaT細胞IκBα和COX-2表達水平比較
3 討論
高達80%~90%的皮膚老化是由于環境和外來生物制劑(外部老化)造成的,而長期紫外線照射是皮膚老化的主要原因[6-7]。紫外線照射皮膚數小時后,炎性細胞在皮膚表皮和真皮局部浸潤,并產生大量的ROS。ROS細胞內聚積可以破壞細胞膜結構、引起DNA突變和蛋白變性,進而影響細胞結構并導致功能障礙[8]。而長期由ROS誘導的氧化應激反應不僅會導致機體氧化損傷,還將通過DNA損傷和激活癌基因的方式促進基底細胞癌、鱗狀細胞癌、黑色素瘤等疾病發生[9]。尋找一種安全、高效的抗氧化劑,對于預防和延緩皮膚光老化有著重要意義。
Myr又稱3,5,7,3',4',5'-六羥基黃酮,是一種天然安全的黃酮類化合物,相較于其他同類化合物,具有更強的抗菌、抗病毒、抗炎、抗氧化活性[10-11]。現有的Myr研究主要集中于腫瘤[12]、神經退行性病變[13]、心血管疾病[14]等領域,在皮膚光老化的防治方面研究仍較為缺乏。本文結果顯示,Myr可有效抑制紫外線對小鼠皮膚的組織學病變和膠原纖維變性,并上調膠原蛋白特征性氨基酸HYP水平。ROS在皮膚聚集將持續消耗皮膚抗氧化物質,其中SOD是體內主要的抗氧化酶,其作用主要是清除超氧化物自由基,而T-AOC代表了機體清除ROS的能力[15-16]。本研究通過對不同劑量Myr處理后的皮膚組織檢測發現,Myr不同程度提高組織SOD和T-AOC活性。其中,相比模型對照組,20 mg/ml Myr可顯著提高小鼠皮膚抗氧化能力。角質形成細胞是皮膚抵抗紫外線的首要屏障,在光老化的發生和發展中起重要作用。本文通過角質形成細胞光老化模型也證實,Myr可有效抑制UVB對HaCaT細胞的殺傷作用和ROS細胞內聚集。提示Myr可通過提高皮膚抗氧化的能力來延緩皮膚光老化。
當細胞受到外界的刺激使其會發生反應,首先通過細胞表面的一些受體或者蛋白將細胞外信息傳遞到細胞內,隨后細胞根據傳遞到細胞內部的信息,細胞內部一系列的蛋白分子與生理功能被激活,稱這些蛋白分子構成的網絡為信號通路。紫外線照射后NF-κB信號通路被激活是曬傷引起炎癥反應的第一步。COX-2是NF-κB的一個下游靶點,因此,筆者推測Myr可能是通過NF-κB信號通路來發揮抑制紫外線輻射對人角質細胞的損傷作用。為了驗證這一假設,本研究將HaCaT細胞用20 mJ/cm2紫外線照射,然后用Myr處理細胞,之后收集細胞蛋白,用Western blot檢測細胞p-IκBα和IκBα蛋白表達。結果發現,紫外線照射后細胞內的p-IκBα水平表達顯著上調,IκBα未產生明顯變化,當采用50μM的Myr處理細胞,發現p-IκBα表達被抑制,IκBα仍未產生顯著的變化。因此,筆者得出結論Myr可能是通過NF-κB信號通路來發揮抑制紫外線照射對細胞的損傷作用。多種信號通路都可通過降解IκBα的方式活化NF-κB,主要是使IκBα的絲氨酸殘基發生磷酸化。活化后的NF-κB可以入核與DNA結合發揮其轉錄調控功能。IκBα首先是在IκBα激酶的作用下發生絲氨酸殘基磷酸化,接下來IκBα在E3泛素化酶復合體催化下進行泛素化而被蛋白酶降解。活化后的NFκB參與機體多種調控機制,主要是發揮轉錄活性功能,誘導下游基因的轉錄。經典的NF-κB信號通路主要由p50/p65介導,在未激活狀態下,p50/p65與抑制因子IκBα結合形成蛋白復合體存在于細胞質中,當蛋白復合體受ROS、TNF、IL-1等刺激,將引起IκBα磷酸化并與p50/p65解離,進一步誘導p50/p65入核,啟動下游炎癥相關蛋白COX-2的表達[17-18]。本研究進一步檢測Myr對小鼠和細胞IκBα和COX-2的作用表明,Myr可有效抑制紫外線對皮膚組織和細胞的IκBα和COX-2的上調作用,下調IκBα磷酸化水平,提示Myr可通過NF-κB信號通路抑制紫外線照射的損傷作用。
綜上所述,本研究通過動物和細胞實驗證實,Myr可提高皮膚抗氧化能力,通過調控NF-κB信號通路發揮抗炎活性,具有抑制紫外線誘導的皮膚光老化作用。

