蘆竹屬菌草內生固氮菌nifH基因的表達研究
李 曼,李巧琪,廖 真,林標聲,魯國東,林占熺
(1.福建農林大學生命科學學院, 福建 福州 350002; 2.國家菌草工程技術研究中心,福建 福州 350002; 3.龍巖學院生命科學學院,福建 龍巖 364012; 4.福建農林大學植物保護學院,福建 福州 350002)
【研究意義】植物內生固氮菌是指能夠在玉米、水稻、牧草等許多植物體內定殖并進行聯合固氮作用的一類微生物[1],其在植物體內占據著重要生態位,通過聯合固氮作用為宿主植物提供氮素或其他促生長物質[2-4]。植物內生固氮菌的種類不同,為寄主提供氮源的效率、產生植物激素類物質、促進宿主的生理變化也不同[5]。nifH基因是固氮微生物菌株最保守的功能基因[6-7],是固氮微生物研究的理想遺傳標記,nifH基因作為編碼固氮酶的結構基因在生物固氮中發揮著重要作用[8]。蘆竹屬菌草(Arundosp.)綠洲屬多年生禾本科植物,其有粗而多節的根莖,莖稈直立、根系發達,綠洲不僅可以避免大面積水土流失,而且能大量吸收保持地表水,生長快,覆蓋性強,具有耐寒、耐高溫、耐旱、耐鹽堿及抗逆性強等優良特點。開發內生固氮菌不僅可以作為微生物制劑或菌肥應用于農業中,也可以為進一步豐富和完善禾本科植物內生固氮菌種質資源庫奠定理論基礎。【前人研究進展】實時熒光定量PCR(Real-time quantitative reverse transcription PCR, qRT-PCR)技術于1996年由美國Applied Biosystems公司推出 ,由于該技術不僅實現了 PCR 從定性到定量的飛躍 ,而且與常規 PCR技術相比,它具有特異性強、靈敏度高、重復性好、定量準確等優點, 目前廣泛應用于研究mRNA的表達、各種基因定量分析、單核苷酸多態性分析、DNA甲基化的檢測及對各種傳染病進行定量定性分析等[9]。目前已有不少學者研究禾本科植物內生固氮菌nifH基因,但關于蘆竹屬菌草綠洲固氮基因nifH的報道較少。【本研究切入點】本研究將qRT-PCR技術應用于蘆竹屬菌草樣本固氮基因nifH的定性定量分析,旨在豐富和完善禾本科植物內生固氮菌種質資源庫。【擬解決的關鍵問題】通過qRT-PCR技術快速準確的檢測到5種蘆竹屬菌草成熟期根部內生固氮菌nifH基因的拷貝數及相對表達量的變化情況。
1 材料與方法
1.1 樣本的采集及處理
樣本采集于福建農林大學城菌草種植基地,分5個樣區采集5種綠洲,每個樣區分3個樣點,每個樣點隨機選取1株菌草,5個樣區共采集15株菌草綠洲成熟期的根部帶回實驗室處理。
1.2 培養基及主要儀器
1.2.1 培養基 LB 液體培養基[10],LB固體培養基[11]。
1.2.2 主要儀器 主要儀器如表1所示。

表1 主要儀器及型號
1.3 樣品的表面消毒
樣本采集結束后,先用流水沖洗1~2 h,再依次用75%乙醇浸泡2 min,2%次氯酸鈉浸泡5 min后,用無菌水沖洗4次,再將最后一次沖洗后的無菌水洗滌液涂布于LB培養基中培養1~2 d,以此檢驗消毒是否徹底[12]。
1.4 基因組DNA的提取、固氮基因nifH可變區擴增及qRT-PCR
采用快速無毒DNA提取試劑盒,提取5種綠洲成熟期根部DNA,提取完成后,使用1%瓊脂糖凝膠電泳觀察提取的基因組DNA片段并測其OD值。以提取的基因組DNA為模板,采用PCR儀擴增固氮功能基因nifH的片段。引物序列為nifH-F5′-AAAGGYGGWATCGGYAARTCCACCAC-3′,nifH-R5′-T TGTTSGCSGCRTACATSGCCATCAT-3′[13]。PCR,qRF-P CR反應體系及程序如表2所示。1%瓊脂糖凝膠電泳檢測擴增結果,使用Axy Prep DNA 凝膠回收試劑盒回收目的片段。向PCR管中加入4 μL膠回收片段,從表面小心吸取1 μL質粒,加入管中,用稍大的槍,輕輕混勻20次左右,用手加熱5 min至30 ℃左右。向1.5 mL EP管中加入感受態的大腸桿菌50 μL,再加入連接產物5 μL,輕輕混勻,冰浴30 min,42 ℃熱激90 s,水浴5 min,結束后向EP管中加入600 μL LB液體培養基(此過程須在超凈工作臺中進行),37 ℃,150 r/min,培養2 h。轉化成功后涂布于含有氨芐卡那霉素的LB平板上,培養24 h后觀察平板菌落生長狀況,挑選白色菌落作為陽性轉化子進行PCR鑒定,用1%瓊脂糖凝膠電泳檢測擴增結果,并提取質粒作為樣本nifH基因絕對定量的標準品。提取質粒標準品從101~105進行10倍梯度稀釋,每個梯度取2 μL作為反應模板建立標準曲線。
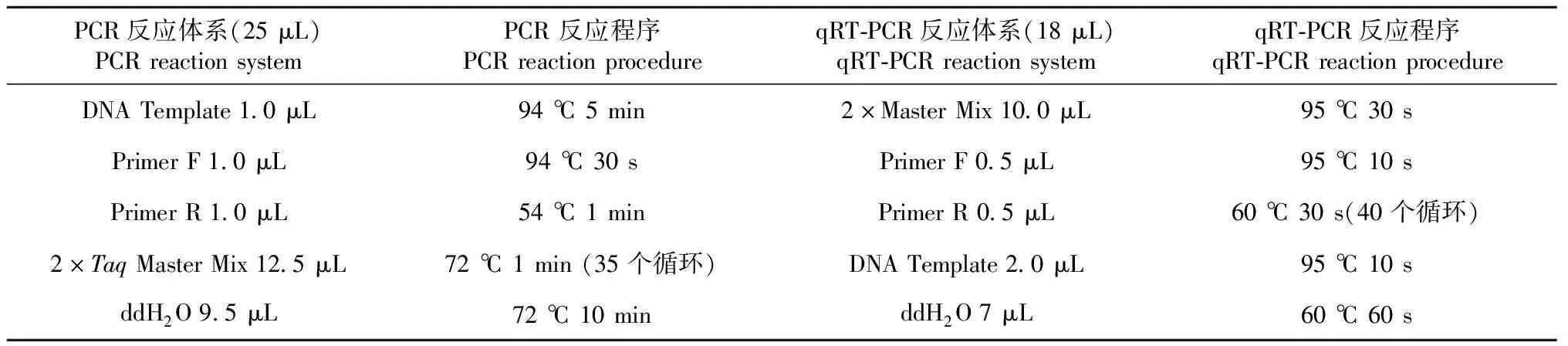
表2 PCR、qRT-PCR反應體系及程序
1.5 RNA的提取、反轉錄、nifH基因的擴增及qRT-PCR
使用TRIzol Reagent提取各樣本RNA,用1%瓊脂糖凝膠電泳檢測及微量核酸測定儀測其OD值。隨后將提取的RNA反轉錄成cDNA。反轉錄總體系 20 μL,其中Master Mix 10 μL、SUPERSCRIPT Ⅱ Reverse Transcriptase 1.0 μL、RT Primer Mix 1.0 μL、5×PrimerScript Buffer2 4.0 μL、RNase-free H2O 4.0 μL。將各樣本的反轉錄產物作為模板,設計nifH(目的基因)及16S(內參基因)兩對引物分別進行PCR反應。引物序列分別為nifH如表2所示,16S-F5′-CAGCAGCCGCGGTAATAC-3′;16S-R5′-CCGTCAATTCCTTTGAGTTT-3′。PCR反應總體系如表2所示,建立溶解曲線后,將cDNA樣品模板進行10倍稀釋,5梯度,各檢測3個復孔。選用16S作為內參基因,與目的基因nifH分別進行Realtime PCR反應,獲取兩個基因的擴增曲線、溶解曲線及Ct值,按2-ΔΔCt法分析所獲得的數據。
2 結果和分析
2.1 蘆竹屬菌草成熟期根樣本nifH基因定量分析
如圖1-a所示,5個質粒標準品擴增曲線較光滑,傾斜度較大,呈現典型的S型曲線,且各循環閾值間隔較均勻。根據擴增曲線提供的標準品各梯度稀釋濃度反應的循環閾值(Ct值),繪制出反應的標準曲線(圖1-b)。該標準曲線方程為Y=-3.053X+40.509,相關系數R2=0.99,斜率K=-3.053。樣本擴增曲線各線后期均趨于平穩;溶解曲線中各樣本曲線均為單一尖銳峰,未出現其他雜峰,Tm為81.47 ℃,故不存在非特異擴增產物或引物二聚體。
通過qRT-PCR技術測定了5種蘆竹屬菌草成熟期根樣本nifH基因的拷貝數(圖2),5種蘆竹屬菌草成熟期根nifH基因拷貝數逐步遞減,拷貝數差異較大,其中,綠洲1號nifH基因拷貝數最高,達8.84×1011/g;綠洲5號nifH基因拷貝數最低,達1.54×1011/g,各樣本差異均達到顯著水平(P<0.05)。
2.2 蘆竹屬菌草成熟期根樣本的nifH基因相對表達量分析
通過qRT-PCR技術測定5種蘆竹屬菌草內生固氮菌nifH基因的相對表達量(圖3),所得原始數據采用2-ΔΔCt法定量計算公式進行相對定量分析,即綠洲2、3、4、5號樣品目的基因nifH相對于參照樣品綠洲1號相對表達量的差異(圖4),結果表明,綠洲2號成熟期根樣本固氮nifH基因表達量最高,約為15.69,已達到過表達水平;而綠洲1號nifH基因表達量最低,其數值為0.84,綠洲2號nifH基因相對表達量為綠洲1號的18倍。其中,綠洲2號差異達到顯著水平(P<0.05),其余各樣本差異均不顯著。
3 討 論
本文采用實時熒光定量PCR技術測定了5種蘆竹屬菌草內生固氮菌nifH基因的拷貝數及相對表達量,結果表明,5種蘆竹屬菌草成熟期根樣本固氮基因nifH的拷貝數及相對表達量均存在較大的差異。在定量分析中,樣本拷貝數的變化呈逐步遞減趨勢,綠洲1號樣本nifH基因拷貝數最高,且各樣本nifH基因拷貝數差異均達到顯著水平(P<0.05);在定性分析中,綠洲2號樣本nifH基因相對表達量則最高,呈過表達水平,且差異達到顯著水平,而綠洲1號固氮基因nifH的表達量最低。
由于絕大多數實驗表明禾本科植物內生固氮菌大部分來自成熟期根部,侯偉等[14]研究發現分離得到的 40 株內生固氮菌絕大多數來源于根內,這種分布趨勢與固氮菌本身屬性有關。林標聲等[15]研究發現巨菌草在同一生長時期的內生固氮菌群豐度和多樣性均是根>葉>莖,且根的固氮酶活性在成熟期達到最高。毛曉潔[16]研究發現,對分離到的玉米內生固氮菌從門、綱、目、屬、種5個分類學等級進行統計分析,結果表明其多樣性為根部>葉部>莖部,與林標聲等[15]的研究結果一致。因此,本研究選擇5種蘆竹屬菌草成熟期根部內生固氮菌作為研究對象,以檢測其固氮基因nifH在mRNA水平上的表達情況和定量變化情況。
綜上所述,結果表明,該5種蘆竹屬菌草成熟期根樣本內生固氮菌nifH基因的拷貝數及表達量均存在較大差異,綠洲1號nifH基因拷貝數最高,達8.84×1011/g;而固氮基因nifH相對表達量則是綠洲2號最高,且呈過表達水平。蘆竹屬菌草作為栽培食藥用菌的栽培料,是荒漠化地區恢復植被的優良草種[17],是喂養食草性動物適口的飼料,且植物內生菌的研究已經成為當前微生物學的熱點之一,是待開發的資源寶庫[18-19]。因此,利用qRT-PCR技術檢測5種菌草成熟期根部nifH基因的拷貝數及相對表達量,檢測結果表明,綠洲1號根部固氮菌的數量較多,綠洲2號根部固氮酶活性較強,該結果為今后植物固氮領域的研究及內生固氮菌的應用提供理論依據。

