FGD5-AS1 調控miR-133a-3p 對膿毒癥血管內皮細胞的細胞活性、凋亡及炎癥因子表達的影響
楊 燕 劉德智 (新鄉市中心醫院,新鄉醫學院第四臨床學院重癥醫學科二區,新鄉453000)
膿毒癥是一種由感染引起的全身炎癥反應綜合征,而血管內皮細胞在膿毒癥發生過程中發揮重要作用[1-2]。脂多糖(lipopolysaccharide,LPS)可促進血管內皮細胞炎癥反應從而誘導細胞凋亡最終造成細胞損傷[3-4]。目前關于膿毒癥血管內皮細胞損傷發生的分子機制尚未完全闡明,因而深入探究膿毒癥血管內皮細胞損傷機制有助于提高診斷及治療效果。長鏈非編碼RNA FGD5-AS1(long non-coding RNA FGD5-AS1,LncRNA FGD5-AS1)在牙周炎中呈低表達,并可影響牙周炎發生及發展過程[5]。生物信息學分析顯示微小RNA-133a-3p(microRNA-133a-3p,miR-133a-3p)可能是 FGD5-AS1 的靶基因,研究表明miR-133a-3p 在膿毒癥患者血清中表達上調,并可能作為診斷膿毒癥的分子標志物[6]。但FGD5-AS1 是否可通過調控miR-133a-3p 的表達從而影響膿毒癥發生及發展過程尚未可知。本研究通過LPS 誘導血管內皮細胞構建膿毒癥模型,觀察FGD5-AS1 與miR-133a-3p 在細胞模型中的表達變化,分析其對細胞增殖、凋亡及炎癥因子表達水平的影響,為揭示膿毒癥血管內皮細胞損傷的分子機制提供新方向。
1 材料與方法
1.1 材料 20只清潔級SD大鼠體重200~220 g,購自湖南斯萊克景達實驗動物有限公司,動物許可證號:SCXK(湘):2016-0013;LPS 購自美國 Sigma 公司(貨號:I2880,生產批號:20170320);膜聯蛋白V(An?nexin V)-異硫氰酸熒光素(FITC)/碘化丙啶(propid?ium iodide,PI)細胞凋亡試劑盒購自武漢博士德生物工程有限公司(貨號:MK1025,生產批號:2017-0410);TNF-α、IL-1、IL-6 ELISA 檢測試劑盒購自欣博盛生物科技有限公司;杜氏改良培養基(DMEM)、胰蛋白酶、胎牛血清購自美國Thermo Fisher 公司;Lipofectamine 2000 購自美國 Invitrogen 公司(貨號:11668,生產批號:20170316);pcDNA3.1購自上海遠慕生物科技有限公司;miR-133a-3p寡核苷酸模擬物(miR-133a-3p mimics)及陰性對照 mimic NC 序列(miR-NC)、FGD5-AS1 小干擾 RNA(si-FGD5-AS1)、亂序無意義陰性序列(si-NC)購自廣州銳博生物科技有限公司;Trizol、反轉錄試劑盒、熒光定量PCR試劑盒購自日本TaKaRa 公司;甲基噻唑基四唑(me?thylthiazolyl tetrazolium,MTT)購自上海澤葉生物科技有限公司(貨號:ZY111105-500,生產批號:20170412);雙熒光素酶活性檢測試劑盒購自北京威格拉斯生物技術有限公司;RIPA、二喹啉甲酸(BCA)蛋白定量檢測試劑盒、增強型化學發光試劑(ECL)購自北京全式金生物技術有限公司;兔抗鼠P21、含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)抗體購自美國Santa Cruz公司;辣根過氧化物酶(HRP)標記的山羊抗兔二抗購自美國Abcam公司。
1.2 方法
1.2.1 原代培養大鼠血管內皮細胞[7]取20只SD大鼠,麻醉后處死,將大鼠頭部置于75%酒精,切除腦組織,去除顱骨,分離腦組織,PBS洗滌,剝離軟腦膜與大血管,去除大腦蛋白質,PBS洗滌,使用75 μm濾網過濾,取濾網上的血管段,PBS 洗滌,4℃下1 500/rmin 離心8 min,加入Ⅱ型膠原酶,37℃恒溫水浴鍋孵育 15 min,1 500/rmin 離心 5 min,吹打混勻,1 500/rmin離心5 min,加入DMEM完全培養基,接種于培養皿中,置于37℃恒溫培養箱培養,待細胞生長融合度達到90%時進行傳代培養。
1.2.2 實驗分組 取對數期血管內皮細胞,0.25%胰蛋白酶消化,加入培養基制備細胞懸液,調整細胞密度2×105個/ml,接種于6孔板(100 μ/l孔),使用含有10 mg/ml的LPS處理細胞24 h(LPS組),以此模擬膿毒癥環境[8]。未經處理的細胞作為control組。待細胞生長融合度達到70%時將培養基更換為不含血清的培養基,分別將pcDNA3.1、pcDNA3.1-FGD5-AS、pcDNA3.1-FGD5-AS1 與 miR-NC、pcDNA3.1-FGD5-AS1及miR-133a-3p轉染至血管內皮細胞,轉染6 h后將培養基更換為DMEM完全培養基,轉染方法與步驟參照Lipofectamine 2000說明書,繼續培養48 h,隨后使用含有10 mg/ml LPS 的培養基繼續培養24 h,分別記作 LPS+pcDNA3.1 組、LPS+pcDNA3.1-FGD5-AS 組、LPS+pcDNA3.1-FGD5-AS1+miR-NC 組、LPS+pcDNA3.1-FGD5-AS1+miR-133a-3p組。
1.2.3 qRT-PCR檢測細胞中FGD5-AS1、miR-133a-3p的表達水平 采用Trizol法提取各組細胞中總RNA,應用Nanodrop2000c超微量分光光度計檢測RNA 濃度。FGD5-AS1 正向引物5'-TACAGTGCAGTGGTG?GCTTA-3',反向引物 5'-AGGCACCCACTTATCAAGCT-3';miR-133a-3p 正向引物 5'-CCCTTTGGTCCC-CTTCAAC-3',反向引物5'-CAGTGCAGGGTCCGAG?GTAT-3';GAPDH 正向引物 5'-GGAGCGAGATCCCTCCAAAAT-3',反向引物 5'-GGCTGTTGTCATACTTCTCATGG-3';U6 正向引物 5'-ATTGGAACGATACAGAGAAGATT-3',反向引物:5'-GGAACGCTTCAC?GAATTTG-3',引物由上海生工生物工程股份有限公司設計合成。按照反轉錄試劑盒說明書操作將總RNA 反轉錄為cDNA,以cDNA 為模板進行qRTPCR 反應,反應條件:95℃ 2 min(循環 1 次),95℃30 s,60℃ 30 s,72℃ 30 s(循環40次)。FGD5-AS1以GAPDH 為內參,miR-133a-3p 以 U6 為內參,采用2-ΔΔCt法計算 FGD5-AS1、miR-133a-3p相對表達量。
1.2.4 MTT 檢測細胞增殖 收集對數期血管內皮細胞,調整細胞密度 3×104個/ml,接種于 96 孔板(100 μ/l孔),按照1.2.2分組處理,每孔中加入20 μl MTT溶液,室溫孵育4 h,棄上清,每孔加入150 μl二甲基亞砜(DMSO),振蕩10 min,應用酶標儀檢測各孔吸光度值(OD490nm),計算細胞存活率。
1.2.5 流式細胞術檢測細胞凋亡率 收集各組對數期血管內皮細胞(1×104個/ml),預冷PBS 洗滌,4℃ 下1 000/rmin離心5 min,收集細胞,加入500 μl Binding Buffer,分別加入5 μl Annexin V-FITC 與 5 μl PI,充分混勻,室溫避光孵育20 min,應用FACS Cali?bur流式細胞儀檢測細胞凋亡率。
1.2.6 ELISA 檢測 TNF-α、IL-1、IL-6 濃度 收集各組細胞培養上清液,采用ELISA 法檢測各組TNF-α、IL-1、IL-6水平,嚴格按照試劑盒說明書進行操作。
1.2.7 雙熒光素酶報告基因檢測FGD5-AS1的靶基因 Starbase 預 測顯示 FGD5-AS1 與 miR-133a-3p 存在結合位點,將含有結合位點及突變位點的序列片段分別插入熒光素酶報告基因載體構建野生型質粒WT-FGD5-AS1 與突變型質粒MUT-FGD5-AS1,分別將 WT-FGD5-AS1、MUT-FGD5-AS1 與 miR-NC、miR-133a-3p mimics 共轉染至血管內皮細胞,培養48 h,參照熒光素酶活性檢測試劑檢測各組相對熒光素酶活性。分別將pcDNA3.1、pcDNA3.1-FGD5-AS1、si-NC、si-FGD5-AS1轉染至血管內皮細胞,qRT-PCR檢測各組細胞中miR-133a-3p的表達水平。
1.2.8 Western blot檢測P21、Caspase-3蛋白表達 收集各組細胞,加入RIPA 裂解液提取細胞總蛋白,根據BCA 試劑盒說明書檢測蛋白濃度,蛋白高溫變性,采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDSPAGE)分離蛋白,電泳結束后將分離的蛋白凝膠轉移至PVDF 膜,5%脫脂奶粉封閉2 h,孵育一抗稀釋液(1∶1 000),4℃ 孵育過夜,TBST洗滌,孵育,加入二抗稀釋液(1∶2 000),室溫孵育1 h,TBST洗滌,曝光,顯影,應用Image J軟件分析各條帶灰度值。
1.3 統計學處理 應用SPSS21.0統計學軟件分析數據,計量資料以表示且均符合正態分布,兩組間比較采用獨立樣本t檢驗,多組間比較采用單因素方差分析,任意兩組間比較采用LSD-t檢驗,以P<0.05為差異具有統計學意義。
2 結果
2.1 LPS 作用下 FGD5-AS1、miR-133a-3p 在血管內皮細胞中的表達 與Control 組相比,LPS 組血管內皮細胞中FGD5-AS1的表達水平顯著降低(P<0.05),miR-133a-3p的表達水平顯著升高(P<0.05),見表1。
表1 LPS 作用下 FGD5-AS1、miR-133a-3p 在血管內皮細胞中的表達(,n=9)Tab.1 Expression of FGD5-AS1 and miR-133a-3p in vas?cular endothelial cells under effect of LPS(,n=9)

表1 LPS 作用下 FGD5-AS1、miR-133a-3p 在血管內皮細胞中的表達(,n=9)Tab.1 Expression of FGD5-AS1 and miR-133a-3p in vas?cular endothelial cells under effect of LPS(,n=9)
Note:Compared with control group,1)P<0.05.
miR-133a-3p 0.98±0.10 2.69±0.251)19.052<0.001 Groups Control LPS t P FGD5-AS1 1.02±0.10 0.34±0.031)19.540<0.001
2.2 過表達FGD5-AS1 對LPS 作用的血管內皮細胞的細胞活性、凋亡的影響 結果見圖1、表2。與Control 組相比,LPS 組血管內皮細胞存活率顯著降低(P<0.05),細胞凋亡率顯著升高(P<0.05),P21、Caspase-3 蛋白相對表達量顯著升高(P<0.05);與LPS+pcDNA3.1 組相比,LPS+pcDNA3.1-FGD5-AS1組血管內皮細胞存活率顯著升高(P<0.05),細胞凋亡率顯著降低(P<0.05),P21、Caspase-3蛋白相對表達量顯著降低(P<0.05)。
表2 過表達FGD5-AS1對LPS作用的血管內皮細胞的細胞活性、凋亡的影響(,n=9)Tab.2 Effects of overexpression of FGD5-AS1 on cell activity and apoptosis of LPS-induced vascular endothelial cells(,n=9)

表2 過表達FGD5-AS1對LPS作用的血管內皮細胞的細胞活性、凋亡的影響(,n=9)Tab.2 Effects of overexpression of FGD5-AS1 on cell activity and apoptosis of LPS-induced vascular endothelial cells(,n=9)
Note:Compared with control group,1)P<0.05;compared with LPS+pcDNA3.1 group,2)P<0.05.
Apoptosis rate(%)8.01±1.00 26.64±2.531)27.12±2.65 13.32±1.222)209.007<0.001 Groups Control LPS LPS+pcDNA3.1 LPS+pcDNA3.1-FGD5-AS1 F P FGD5-AS1 1.01±0.10 0.32±0.031)0.33±0.03 0.85±0.082)249.808<0.001 P21 0.22±0.02 0.72±0.071)0.74±0.07 0.33±0.032)230.568<0.001 Caspase-3 0.34±0.03 0.86±0.091)0.90±0.09 0.41±0.042)165.738<0.001 Viability rate(%)100.26±10.15 53.58±5.421)52.97±5.40 88.14±8.432)90.197<0.001
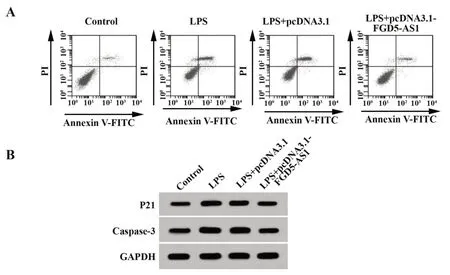
圖1 過表達FGD5-AS1 對LPS 作用的血管內皮細胞凋亡及P21、Caspase-3蛋白表達的影響Fig.1 Effects of FGD5-AS1 overexpression on LPS-in?duced apoptosis of vascular endothelial cells and ex?pressions of P21 and Caspase-3 proteins
2.3 過表達FGD5-AS1對LPS作用的血管內皮細胞中炎癥因子表達的影響 與Control 組相比,LPS 組血管內皮細胞中炎癥因子TNF-α、IL-1、IL-6 水平顯著升高(P<0.05);與LPS+pcDNA3.1 組相比,LPS+pcDNA3.1-FGD5-AS1 組血管內皮細胞中炎癥因子TNF-α、IL-1、IL-6水平顯著降低(P<0.05),見表3。
表3 過表達FGD5-AS1對LPS作用的血管內皮細胞中炎癥因子表達的影響(,n=9,pg/ml)Tab.3 Effect of overexpression of FGD5-AS1 on the expression of inflammatory factors in LPS-affected vascular endothelial cells(,n=9,pg/ml)
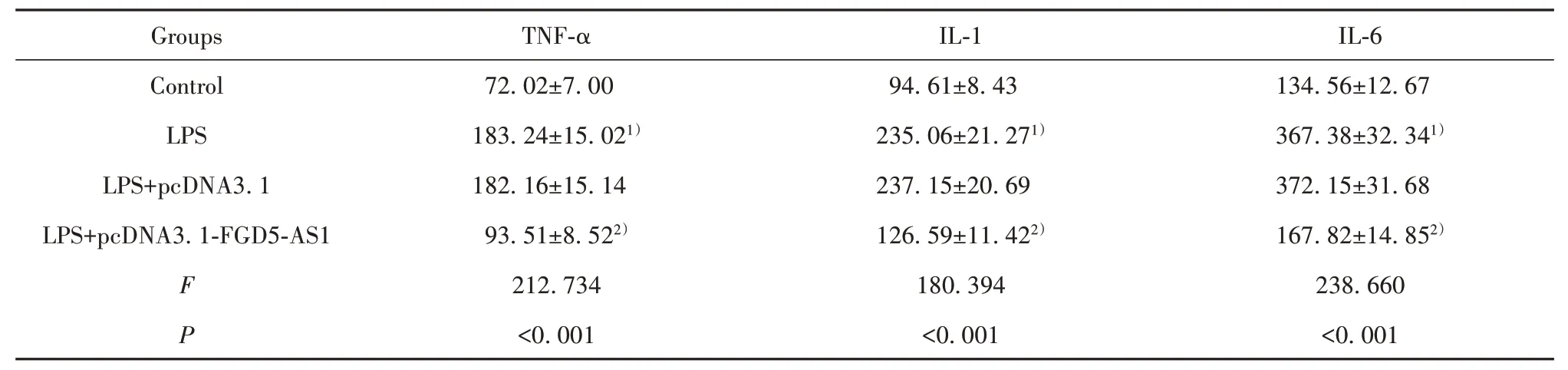
表3 過表達FGD5-AS1對LPS作用的血管內皮細胞中炎癥因子表達的影響(,n=9,pg/ml)Tab.3 Effect of overexpression of FGD5-AS1 on the expression of inflammatory factors in LPS-affected vascular endothelial cells(,n=9,pg/ml)
Note:Compared with control group,1)P<0.05;compared with LPS+pcDNA3.1 group,2)P<0.05.
IL-6 134.56±12.67 367.38±32.341)372.15±31.68 167.82±14.852)238.660<0.001 Control LPS LPS+pcDNA3.1 LPS+pcDNA3.1-FGD5-AS1 F P 72.02±7.00 183.24±15.021)182.16±15.14 93.51±8.522)212.734<0.001 94.61±8.43 235.06±21.271)237.15±20.69 126.59±11.422)180.394<0.001 GroupsTNF-αIL-1
2.4 FGD5-AS1 靶向、調控 miR-133a-3p Starbase預測顯示FGD5-AS1 與miR-133a-3p 存在結合位點,見圖2。雙熒光素酶報告實驗結果顯示,轉染野生型質粒 WT-FGD5-AS1 的細胞中,miR-133a-3p 組熒光素酶活性顯著低于miR-NC 組(P<0.05);轉染突變型質粒MUT-FGD5-AS1的細胞中,miR-133a-3p組與miR-NC 組熒光素酶活性相比差異無統計學意義(P>0.05),見表4。qRT-PCR檢測結果顯示,與pcD?NA3.1組相比,pcDNA3.1-FGD5-AS1組細胞中miR-133a-3p 的表達水平顯著降低(P<0.05);與si-NC 組相比,si-FGD5-AS1 組細胞中miR-133a-3p 的表達水平顯著升高(P<0.05),見表5。
表4 雙熒光素酶報告實驗(,n=9)Tab.4 Double luciferase report assay(,n=9)
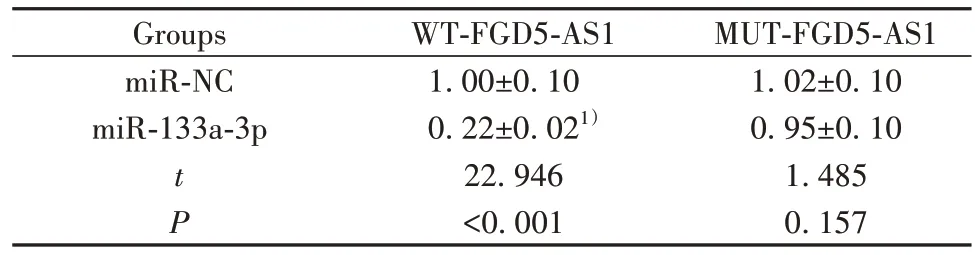
表4 雙熒光素酶報告實驗(,n=9)Tab.4 Double luciferase report assay(,n=9)
Note:Compared with miR-NC group,1)P<0.05.
MUT-FGD5-AS1 1.02±0.10 0.95±0.10 1.485 0.157 Groups miR-NC miR-133a-3p t P WT-FGD5-AS1 1.00±0.10 0.22±0.021)22.946<0.001
表5 FGD5-AS1調控miR-133a-3p的表達()Tab.5 FGD5-AS1 regulates expression of miR-133A-3p()

表5 FGD5-AS1調控miR-133a-3p的表達()Tab.5 FGD5-AS1 regulates expression of miR-133A-3p()
Note:Compared with pcDNA3.1 group,1)P<0.05;compared with si-NC group,2)P<0.05.
miR-133a-3p 1.01±0.10 0.29±0.031)0.98±0.10 2.61±0.252)417.076<0.001 Groups pcDNA3.1 pcDNA3.1-FGD5-AS1 si-NC si-FGD5-AS1 n9 9 9 9 F P
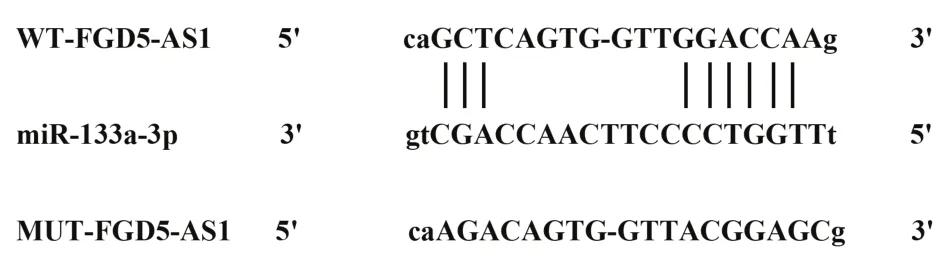
圖2 FGD5-AS1靶向miR-133a-3pFig.2 FGD5-AS1 targeted miR-133-a-3p
2.5 過表達miR-133a-3p 能逆轉FGD5-AS1 對LPS作用的血管內皮細胞的細胞活性、凋亡的影響 與LPS+pcDNA3.1-FGD5-AS1+miR-NC 組 相 比,LPS+pcDNA3.1-FGD5-AS1+miR-133a-3p 組細胞存活率顯著降低(P<0.05),細胞凋亡率顯著升高(P<0.05),P21、Caspase-3蛋白相對表達量顯著升高(P<0.05),見圖3、表6。
表6 過表達miR-133a-3p能逆轉FGD5-AS1對LPS作用的血管內皮細胞的細胞活性、凋亡的影響(,n=9)Tab.6 Overexpression of miR-133a-3p can reverse effect of FGD5-AS1 on cell activity and apoptosis of LPS-affected vascu?lar endothelial cells(,n=9)
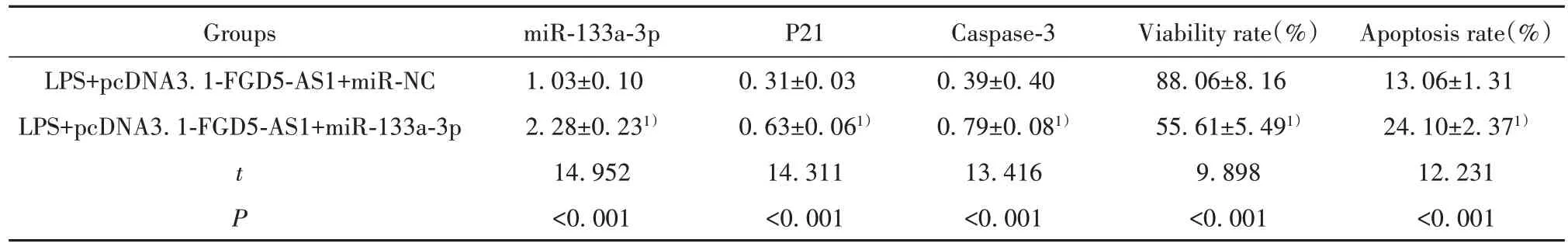
表6 過表達miR-133a-3p能逆轉FGD5-AS1對LPS作用的血管內皮細胞的細胞活性、凋亡的影響(,n=9)Tab.6 Overexpression of miR-133a-3p can reverse effect of FGD5-AS1 on cell activity and apoptosis of LPS-affected vascu?lar endothelial cells(,n=9)
Note:Compared with LPS+pcDNA3.1-FGD5-AS1+miR-NC group,1)P<0.05.
Apoptosis rate(%)13.06±1.31 24.10±2.371)12.231<0.001 Groups LPS+pcDNA3.1-FGD5-AS1+miR-NC LPS+pcDNA3.1-FGD5-AS1+miR-133a-3p t P miR-133a-3p 1.03±0.10 2.28±0.231)14.952<0.001 P21 0.31±0.03 0.63±0.061)14.311<0.001 Caspase-3 0.39±0.40 0.79±0.081)13.416<0.001 Viability rate(%)88.06±8.16 55.61±5.491)9.898<0.001

圖3 過表達miR-133a-3p能逆轉FGD5-AS1對LPS 作用的血管內皮細胞凋亡及P21、Caspase-3蛋白表達的影響Fig.3 Overexpression of miR-133a-3p reversed effect of FGD5-AS1 on LPS-induced apoptosis of vascular endothelial cells and expression of P21 and Cas?pase-3 proteins
2.6 過表達miR-133a-3p 能逆轉FGD5-AS1 對LPS作用的血管內皮細胞中炎癥因子表達的影響 與LPS+pcDNA3.1-FGD5-AS1+miR-NC 組 相 比,LPS+pcDNA3.1-FGD5-AS1+miR-133a-3p 組細胞中炎癥因子TNF-α、IL-1、IL-6 的水平顯著升高(P<0.05),見表7。
表7 過表達miR-133a-3p能逆轉FGD5-AS1對LPS作用的血管內皮細胞中炎癥因子表達的影響(,n=9,pg/ml)Tab.7 Overexpression of miR-133a-3p reversed effect of FGD5-AS1 on expression of inflammatory cytokines in LPS-af?fected vascular endothelial cells(,n=9,pg/ml)

表7 過表達miR-133a-3p能逆轉FGD5-AS1對LPS作用的血管內皮細胞中炎癥因子表達的影響(,n=9,pg/ml)Tab.7 Overexpression of miR-133a-3p reversed effect of FGD5-AS1 on expression of inflammatory cytokines in LPS-af?fected vascular endothelial cells(,n=9,pg/ml)
Note:Compared with LPS+pcDNA3.1-FGD5-AS1+miR-NC group,1)P<0.05.
IL-6 168.34±15.14 336.64±31.281)14.529<0.001 LPS+pcDNA3.1-FGD5-AS1+miR-NC LPS+pcDNA3.1-FGD5-AS1+miR-133a-3p t P 94.26±8.83 156.36±14.691)10.870<0.001 127.15±11.63 204.42±20.131)9.971<0.001 GroupsTNF-αIL-1
3 討論
膿毒癥發生時常伴隨多器官衰竭,并可加重炎癥反應從而造成組織或器官損傷,研究表明Ln?cRNA 可通過靶向miRNA 參與多種炎癥反應發生過程[9]。既往研究顯示LncRNA 異常表達可參與膿毒癥急性肺損傷發生過程[10]。因而探討與膿毒癥誘導的炎癥反應相關分子機制有助于降低心臟、肺部等多器官障礙的發生率。
FGD5-AS1 在牙周炎、急性心肌梗死等疾病中呈低表達,并可能參與多種疾病發生及發展過程[11-12]。但FGD5-AS1 在膿毒癥血管內皮細胞中的表達尚未可知。本研究通過LPS誘導血管內皮細胞模擬膿毒癥引起的炎癥環境,結果顯示FGD5-AS1在LPS 誘導的血管內皮細胞中表達下調,與上述研究報道結果相似。提示FGD5-AS1 表達量降低可能加重膿毒癥所致炎癥反應。膿毒癥患者血清中炎癥因子TNF-α、IL-1、IL-6水平升高,降低炎癥因子水平可有效改善血管內皮細胞功能[13]。本研究結果顯示LPS 誘導的血管內皮細胞中TNF-α、IL-1、IL-6水平升高,而FGD5-AS1過表達后細胞中TNF-α、IL-1、IL-6 水平明顯降低,提示FGD5-AS1 過表達可能通過降低炎癥反應從而改善血管內皮細胞功能。細胞增殖與凋亡的失衡可促進多種疾病發生及發展,研究表明P21可負向調控細胞周期,抑制細胞增殖,Caspase-3 作為細胞凋亡的執行因子,其可誘導細胞凋亡[14-15]。本研究結果顯示LPS 處理后,血管內皮細胞存活率顯著降低,細胞凋亡率升高,P21、Cas?pase-3表達量升高,而FGD5-AS1過表達能夠明顯逆轉這一反應,提示FGD5-AS1 過表達可能通過下調P21、Caspase-3 表達從而抑制LPS 誘導的血管內皮細胞凋亡,促進細胞增殖。
miR-133a-3p 在慢性阻塞性肺疾病中異常表達并可能參與疾病發生及發展過程[16]。研究表明CX?CL12/CXCR4 通過激活miR-133a-3p 從而促進炎癥反應[17]。本研究結果顯示LPS誘導的血管內皮細胞中miR-133a-3p 的表達水平明顯升高,miR-133a-3p過表達聯合FGD5-AS1 過表達處理后,細胞存活率顯著降低,細胞凋亡率升高,P21、Caspase-3 表達量升高,TNF-α、IL-1、IL-6 水平明顯升高,說明 miR-133a-3p過表達能夠逆轉FGD5-AS1過表達對LPS誘導的血管內皮細胞增殖、凋亡及炎癥因子表達的影響。提示FGD5-AS1 過表達可能通過下調miR-133a-3p 的表達從而抑制LPS 誘導的血管內皮細胞凋亡及炎癥反應,并可促進細胞增殖。
綜上所述,LPS 誘導的血管內皮細胞中FGD5-AS1 表達降低,miR-133a-3p 表達增加,炎癥因子TNF-α、IL-1、IL-6 水平升高,凋亡率增加,存活率降低,而FGD5-AS1 過表達可靶向調控miR-133a-3p 的表達從而促進LPS 誘導的血管內皮細胞存活,抑制細胞凋亡,降低TNF-α、IL-1、IL-6 水平,為進一步探討FGD5-AS1 調控炎癥反應的機制奠定理論基礎,FGD5-AS1 可能為膿毒癥與并發癥潛在的治療靶點。本研究將進一步探討FGD5-AS1 在膿毒癥或其他炎癥性疾病中的調控作用機制及其對其他信號通路的調控作用。

