感染后繼發性機化性肺炎1例的報道
梁培干,黃淑賢,羅秋平,邱峻,詹淑娜,譚少興
(1.廣州中西醫結合醫院 呼吸科,廣東 廣州 510800;2.炭步鎮中心衛生院,廣東 廣州 510820)
0 引言
機化性肺炎(Organizing Pneumonia, OP)指發生于肺部的炎癥,由于各種原因治療不徹底導致炎癥病變不吸收或吸收延遲,肺組織損傷后的一種炎性反應、機化,臨床表現缺乏特征性,與其他呼吸系統疾病并無太大區別,極易誤診為肺炎、肺結核及肺真菌感染、腫瘤等,其按病因可分為特發性的隱源性機化性肺炎(COP)和發生于多種病因的繼發性機化性肺炎(SOP)。近些年來,COP已逐漸為業界所認識,將之歸入特發性間質性肺炎的范疇[1],但是對SOP的研究較少,未得到足夠的重視,現對我院明確診斷和治療的感染后導致的繼發性機化性肺炎1例進行報道和討論。
1 病例資料
患者男性,52歲,務農。因“發熱伴咳嗽3天”于2020年3月23日入住我院呼吸科。患者入院前3天無明顯誘因下出現發熱,體溫最高達39 ℃,咳嗽,少痰,胸悶,無呼吸困難,無咯血。至門診查胸部CT提示右肺多發斑片狀增密影,考慮感染性病變(病原體待查),見圖1,擬“肺炎”收入院。既往10余年前外院診斷“結核性胸膜炎”,經治療后痊愈,余無特殊。入院查體:體溫(T):38.5 ℃,精神稍差,右肺呼吸音稍減弱,可聞及少量濕性啰音,余未見明顯異常。入院后輔助檢查:血常規:WBC 7.23×109/L,N 76.2%,Hb104 g/L,PLT 251×109/L;CRP 98.3 mg/L,PCT 0.23 ng/mL,肝腎功能、電解質、肺腫瘤五項未見明顯異常,風濕免疫11項:RF 49.3 IU/mL,抗SSB(+),抗SSA(+-),抗Ro-52(+);CD4/CD8/CD3細胞免疫檢驗:CD4220;CD8152;CD3400;CD4/CD81.45。血清G、GM試驗、HIV抗體、呼吸道病毒七項、肺炎支原體IgM、抗核抗體、抗雙鏈DNA、抗SM抗體、TB-DNA、T-SPOT:均陰性,肺泡灌洗液Xpert MTB:陰性;痰涂片及培養未見真菌、細菌及抗酸桿菌,3月27日血培養為金黃色葡萄球菌,對苯唑西林、青霉素耐藥,肺泡灌洗液病原體宏基因組檢測報告(NGS):檢出屎腸球菌特異性序列數73條,以及常見的呼吸道菌群。考慮CAP、敗血癥,入院先后予哌拉西林鈉舒巴坦鈉、左氧氟沙星、萬古霉素、利奈唑胺,抗感染治療3周,患者仍有發熱,逐漸出現呼吸困難,復查胸部CT顯示肺部病灶明顯進展,見圖2。遂行右下肺經皮肺穿刺活檢,病理提示:(右肺下葉肺組織)局灶肺泡上皮增生,肺泡腔內可見少許纖維素滲出,有機化灶形成,間質淋巴細胞浸潤,組織改變為肺機化性肺炎,見圖3。最終診斷:肺炎伴繼發性機化性肺炎,于4月16日給予甲潑尼龍琥珀酸鈉(40 mg VD QD)抗炎治療,患者體溫用藥后第2天即恢復正常,呼吸困難亦明顯緩解,于4月22日出院,出院當天復查胸部CT病灶大部分吸收,見圖4。出院后繼續口服甲潑尼龍片(40 mg PO QD)并逐漸減量,總療程6個月,患者未再出現發熱癥狀,電話隨訪至今病情無復發[2]。

圖1 3月22日胸部CT病灶圖像
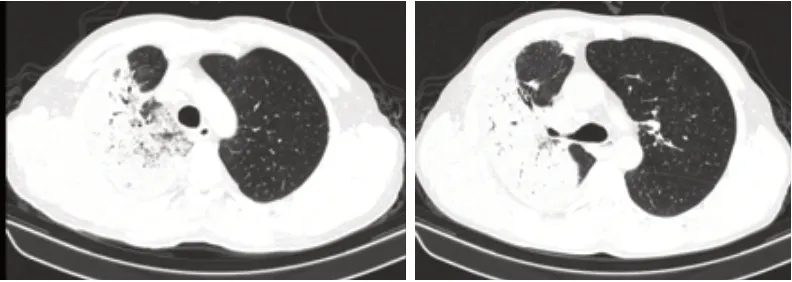
圖2 4月5日胸部CT病灶圖像

圖3 右下肺穿刺活檢病理

圖4 4月21日胸部CT病灶圖像
2 討論
SOP病因多樣,包括感染(各種病原體)、藥物(胺碘酮、金制劑等)、吸入、可卡因中毒、放射性損傷、免疫相關性疾病(紅斑狼瘡、類風濕關、肌炎和皮肌炎等)、器官/骨髓移植、炎癥性腸病、肝硬化等[3]。機體受病原微生物感染后,雖經抗感染治療,病原體得到部分或全部清除,但肺泡及末梢細支氣管炎癥吸收不完全,且持續的炎癥反應導致了肺泡腔內纖維蛋白滲出,從而導致感染后SOP的發生。檢索近年國內外文獻,已知可引起SOP的包括病毒、細菌、真菌、寄生蟲,如甲型流感病毒、副流感嗜血菌、金黃色葡萄球菌、銅綠假單胞菌、大腸埃希菌、煙曲霉、黃曲霉、白色念珠菌等[4]。其中細菌感染后繼發的OP,臨床實踐中很容易被誤診為單純的細菌感染,往往給予大量抗菌藥物抗感染仍效果甚微,延誤病情并導致醫療資源浪費。
本例最初由于存在呼吸道感染癥狀,查體時發現濕啰音,化驗示外周血中性粒百分比及CRP升高,胸部CT示肺滲出、實變影,后先后查出金黃色葡萄球菌、屎腸球菌等菌種,細菌感染明確,于我院門診及入院后一直按CAP、敗血癥治療,先后給予針對性的強有力之抗菌藥物達3周未取得顯著療效仍未及時更改診治方案,后行肺穿刺活檢才得以明確病因,因此如何早期識別感染后SOP對于臨床的診治有重大的意義。
感染后SOP的診斷主要依靠相關臨床表現(發熱、干咳、呼吸困難等)、明確的病原學、影像學典型表現、規范足療程抗感染治療無效并排除其他已知原因(如結締組織疾病、腫瘤化療、服用藥物、器官移植等),且典型病理提示由疏松肉芽結締組織充填于肺泡和終末氣道內。李惠萍等[5]研究提示COP影像學表現為多發性、多形態、多變性、多復發性、多雙肺受累但蜂窩肺少見,總結為“五多一少”,最典型的表現為雙肺多發的斑片狀實變影,可伴見網格狀、結節狀,反暈征、空洞、胸腔積液則相對少見。相關研究者發現大體而言SOP和COP在影像學的表現方面差別并不明顯,而相關學者的研究則發現SOP患者似乎更傾向出現胸腔積液,國內報道有表現為片狀實變影,可見支氣管充氣征,但未見病灶的游走性及多變性的,有表現為孤立的局灶型肺部陰影,有支氣管充氣征,常位于上肺,與局灶性機化性肺炎類似的。SOP和COP影像學上是否有區別、區別大小還有待于進一步大樣本的病例研究。
本病例依據臨床及病理確診為SOP應無異議,考慮感染所致可能性大,但臨床尚存在一些疑點,患者風濕免疫11項提示RF偏高,抗SSB、抗Ro-52抗體為弱陽性(+),抗SSA抗體為可疑陽性,而CD4/CD8/CD3細胞免疫檢驗亦示患者CD4及CD8計數值偏低,提示免疫功能下降。綜上,提示患者存在免疫缺陷狀態,是患者本身存在風濕免疫疾病如類風濕性關節炎因而導致患者感染后出現了繼發性機化性肺炎,抑或是感染性機化性肺炎本身導致的免疫低下。由于患者病愈后拒絕進一步的檢查,因而對于本例無法得出最終的結論,但此問題值得我們在今后的臨床工作當中加以留意。
糖皮質激素是目前治療機化性肺炎的主要方法,SOP除了使用糖皮質激素治療外,同時還要針對病因治療,對于感染后SOP盡量明確病原體并進行規范的抗感染治療。大部分感染后SOP患者接受糖皮質激素及規范足療程抗感染治療后臨床癥狀和影像學變化可大部分甚至全部消失[6],預后較好,但激素減量過快或過早停藥病情可能復發。糖皮質激素的用量、療程尚未統一,本例患者起始予甲潑尼龍40 mg/d,后根據病情逐漸減量,總療程6個月,隨訪病情未復發。
綜上所述,對于存在明確感染,臨床表現為發熱、咳嗽、咳痰、痰中帶血、胸悶痛伴逐漸加重的呼吸困難,血氧分壓下降,胸部影像學主要表現為雙肺多發斑片狀滲出、實變,經規范的抗感染治療無明顯效果的患者,需注意感染后SOP的可能,有條件及時獲取組織病理學加以診斷,治療應及時給予糖皮質激素。

