亞硝酸鹽快速檢測試劑研究及其在醬腌菜中的應用
楊建飛,馬 倩,左 勇,*,黃雪芹,徐 佳,王定麗,周耀進,楊柯怡
(1.四川師范大學生命科學學院,四川 成都 610101;2.四川輕化工大學生物工程學院,四川 宜賓 644000)
醬腌菜是我國的傳統美食,具有方便即食、風味獨特、制作簡易等優點,深受廣大消費者喜愛,然而醬腌菜中亞硝酸鹽含量超標的現象屢見不鮮[1],食用醬腌菜是人體攝入亞硝酸鹽的來源之一,若人體攝入較高的亞硝酸鹽,具有患高鐵血紅蛋白癥、1型糖尿病和癌癥的風險[2-3],因此,世界衛生組織(World Health Organization,WHO)和食品科學委員會(Scientific Committee on Food,SCF)規定亞硝酸鹽的每日允許攝入量(acceptable daily intake,ADI)值為0~0.06 mg/kg(以體質量計)[4-5]。由此可見,在食品衛生檢驗、食品安全等方面,亞硝酸鹽的含量測定具有重要意義。
現有的亞硝酸鹽檢測方法主要分為光譜法、色譜法、電化學分析法和快速檢測法共4 類[6],其中光譜法主要指GB 5009.33—2016《食品中亞硝酸鹽與硝酸鹽的測定》的分光光度法[7](以下簡稱GB法),是目前國際通用的亞硝酸鹽定量檢測法[8],但此方法以強揮發性和強腐蝕性的濃鹽酸作酸性介質,測定流程由于分2 步進行而具有危險和耗時的缺點。色譜法可準確定量,但需要精密儀器和專業的技術人員,檢測費用昂貴,適合實驗室或科研使用[9]。電化學分析法能夠快速、準確測得亞硝酸鹽的響應值[10],但電極材料的選擇及制備過程繁瑣,使用壽命有限[11-12]。快速檢測法是基于比色原理對樣品亞硝酸鹽進行定性或半定量的方法[13-14],具有操作簡單、成本低、耗時短(3~5 min)等優點[15],已在土壤[16]、臨床[17]、水樣[18-19]、食品[20]等領域受到廣泛關注和應用,但比色法制備的許多液體、固體、試紙型的試劑盒有較高檢出限、假陽性、保質期短等缺點[21]。因此,研究適用于醬腌菜中亞硝酸鹽快速定量的檢測試劑具有重要意義。
本實驗以GB法作對照,使用重氮試劑和偶合試劑的混合溶液代替GB法的2 步反應,本實驗還研究可代替濃鹽酸的安全酸性介質,同時探究3 組重氮-偶合試劑(重氮試劑:對氨基苯磺酸、對氨基苯乙酮、磺胺;偶合試劑:鹽酸萘乙二胺,分別為對氨基苯磺酸-鹽酸萘乙二胺組、對氨基苯乙酮-鹽酸萘乙二胺組、磺胺-鹽酸萘乙二胺組,以下簡稱DS組、DT組、HA組)在醬腌菜中的適用性,以期為醬腌菜中亞硝酸鹽的快速定量檢測提供理論基礎。
1 材料與方法
1.1 材料與試劑
醬腌菜 四川宜賓市售;亞硝酸鈉、蘋果酸、丁二酸、酒石酸、檸檬酸、磷酸、對氨基苯磺酸、磺胺、對氨基苯乙酮、鹽酸萘乙二胺(均為分析純) 上海源葉生物科技有限公司。
1.2 儀器與設備
T6紫外-可見分光光度計 北京普析通用儀器有限責任公司;ME104E/02電子天平 托利多儀器(上海)有限公司;HWS-12電熱恒溫水浴鍋 上海喬欣科學儀器有限公司。
1.3 方法
1.3.1 亞硝酸鹽的檢測原理和方法
樣品前處理和亞硝酸鹽的測定原理依據GB法[7]。取1 mL質量濃度4 g/L的重氮試劑(對氨基苯磺酸或對氨基苯乙酮或磺胺)、質量濃度2 g/L的偶合試劑(鹽酸萘乙二胺)0.5 mL于試管中,用蒸餾水補至4.5 mL后搖勻,加入質量濃度1 μg/mL亞硝酸鈉標準溶液0.5 mL,搖勻后反應15 min,500~560 nm波長處掃描,確定每組重氮-偶合試劑的最大測定波長,取1 mL樣品提取液測定亞硝酸鹽含量。
1.3.2 亞硝酸鹽快速檢測條件的優化
研究酸性介質的種類(蘋果酸、檸檬酸、酒石酸、磷酸、丁二酸)、酸性質濃度(0.1、0.3、0.5、0.7 mol/L)、重氮試劑質量濃度(2、4、6、8、10、12 g/L)、偶合試劑質量濃度(0.1、0.3、0.5、0.7、1.0、1.5、2.0 g/L)、重氮-偶合試劑體積比(1∶1、2∶1、3∶1、4∶1、5∶1、6∶1、1∶2)、反應時間3、6、9、12、15、18、21 min)對亞硝酸鹽吸光度的影響,并采用4因素3水平的正交試驗分別優化DS組、HA組、DT組測定亞硝酸鹽的條件。正交試驗因素水平設計見表1~3。
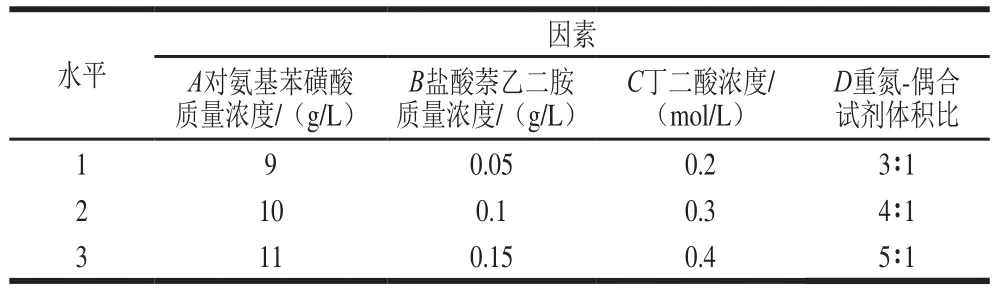
表1 DS組正交試驗因素與水平Table 1 Independent variables and levels used for orthogonal array design for optimization of ASA-NED method

表2 HA組正交試驗因素與水平Table 2 Independent variables and levels used for orthogonal array design for optimization of AAP-NED method
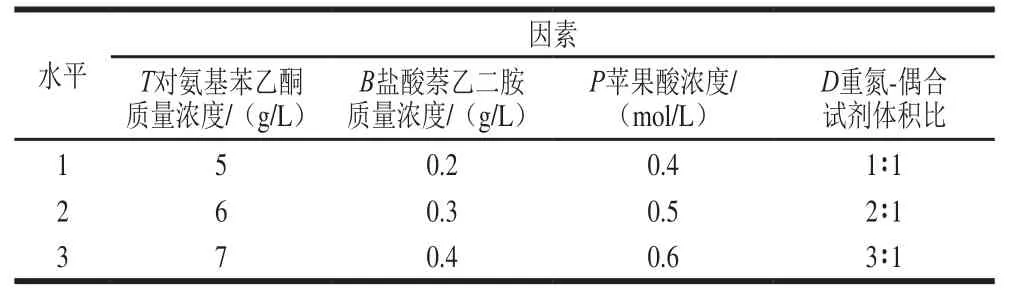
表3 DT組正交試驗因素與水平Table 3 Independent variables and levels used for orthogonal array design for optimization of SN-NED method
1.3.3 亞硝酸鹽快速檢測試劑的檢測性能
以GB法作對照,研究DS組、HA組、DT組應用于醬腌菜樣品時的抗干擾能力、準確度、精密度、檢出限和線性范圍。
1.3.3.1 檢出限和線性范圍
按各組試劑的最優組合測定系列質量濃度梯度的亞硝酸鹽標準溶液,研究DS組、HA組、DT組的檢出限和線性范圍,并采用3δ法[22]計算檢出限。
1.3.3.2 抗干擾能力
為探究本實驗中亞硝酸鹽檢測試劑在醬腌菜中的實際應用性,選擇醬腌菜中含有的食品添加劑和自身水溶性成分,如山梨酸鉀、苯甲酸鈉、D-異抗壞血酸鈉、安賽蜜、有機酸、氨基酸等,按亞硝酸鹽濃度的10~2 000 倍進行干擾實驗。
1.3.3.3 準確度
準確度通常以回收率表示。回收率是指反應待測物在樣品分析過程中的損失程度,損失越少,回收率越高,也說明該檢測方法準確性越高[23]。首先,按3 組檢測試劑最優方法分別測定樣品亞硝酸鹽的本底值,然后于待測液中加入已知質量濃度的亞硝酸鹽標準溶液以調整亞硝酸鹽標準溶液質量濃度為1 μg/mL,最后再次測定亞硝酸鹽含量,計算回收率[24]。
1.3.3.4 精密度
精密度表示實驗方法的重復性,以相對標準偏差(relative standard deviation,RSD)表示[25],通過重復測定5 次樣品中亞硝酸鹽含量計算精密度。
1.3.4 亞硝酸鹽快速檢測試劑的貯存穩定性
為研究亞硝酸鹽快速檢測試劑的實際應用性,對其在25、4、30、40 ℃的避光條件的貯存穩定性進行測定。
1.4 數據處理
采用SPSS 19.0軟件進行正交試驗設計和差異顯著性分析;采用Origin 2018進行圖表的繪制。每組實驗設3 個平行。
2 結果與分析
2.1 亞硝酸鹽檢測波長的測定
由圖1可知,在520~560 nm范圍內,DS組和HA組的最大吸收波長均為540 nm,DT組的最大吸收波長為550 nm,因此選擇DS組、DT組、HA組的亞硝酸鹽測定波長分別為540、550、540 nm。
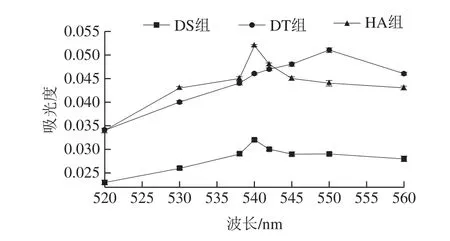
圖1 亞硝酸鹽的檢測波長Fig.1 Visible absorption spectra of nitrite detected with three new diazo-coupling reagents
2.2 亞硝酸鹽的檢測條件
2.2.1 酸性介質及其濃度的影響
由于0.7 mol/L的丁二酸溶液配制3 種重氮試劑時過飽和,因此圖2中無該濃度丁二酸對亞硝酸鹽吸光度的影響。酸性介質的種類和濃度對亞硝酸鹽的吸光度均有影響,可能是酸性介質的酸度系數和溶劑pH值不同所導致[21]。由圖2可知,當DS組、DT組、HA組分別以0.3 mol/L丁二酸、0.5 mol/L蘋果酸、0.5 mol/L酒石酸為酸性介質時,亞硝酸鹽的吸光度分別達到最大。因此,選擇0.3 mol/L丁二酸、0.5 mol/L蘋果酸和0.5 mol/L酒石酸分別為DS組、DT組、HA組的酸性介質。
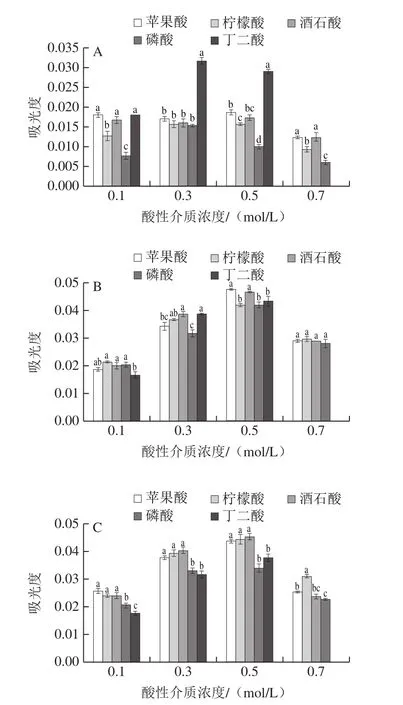
圖2 DS組(A)、DT組(B)、HA組(C)的酸性介質及其濃度對亞硝酸鹽吸光度的影響Fig.2 Influence of acid medium type and concentration on nitrite absorbance detected with ASA-NED (A), AAP-NED (B) and SN-NED (C)
2.2.2 重氮試劑質量濃度的影響
由圖3可知,隨著對氨基苯磺酸、磺胺、對氨基苯乙酮質量濃度的升高,亞硝酸鹽的吸光度先增加再趨于平穩,可能是重氮試劑在低質量濃度時,重氮化反應不完全,當亞硝酸鹽消耗完全時,形成的重氮化合物含量不再增加,吸光度趨于平穩。對氨基苯磺酸、磺胺、對氨基苯乙酮的質量濃度分別在10、8、6 g/L后,亞硝酸鹽的吸光度無顯著差異,因此選擇對氨基苯磺酸、磺胺、對氨基苯乙酮的質量濃度分別為10、8、6 g/L。
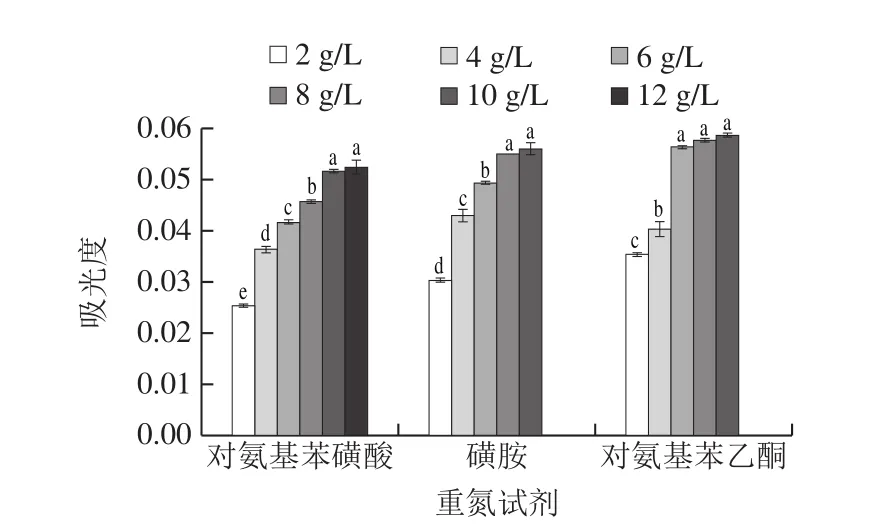
圖3 重氮試劑質量濃度對亞硝酸鹽吸光度的影響Fig.3 Effect of diazonium reagent concentration on absorbance of nitrite
2.2.3 重氮-偶合試劑體積比的影響
由圖4可知,3 組試劑的亞硝酸鹽吸光度均隨重氮-偶合試劑體積比的增加而先增加后降低,可能是過高的重氮-偶合試劑體積比或當偶合試劑體積高于重氮試劑時,降低反應摩爾消光系數[26]。DS組和HA組的吸光度在重氮-偶合試劑體積比分別為4∶1和3∶1時最大;重氮-偶合試劑體積比為2∶1、3∶1、4∶1時,DT組的吸光度較高且無顯著性差異,因此,選擇DS組、DT組、HA組的體積比分別為4∶1、2∶1、3∶1。
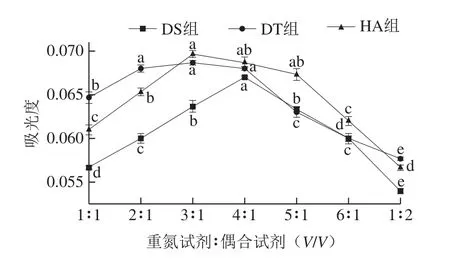
圖4 重氮-偶合試劑體積比對亞硝酸鹽吸光度的影響Fig.4 Influence of volume ratio of diazo to coupling reagent on absorbance of nitrite
2.2.4 反應時間的影響
由圖5可知,反應時間在3~21 min范圍內,DS組、DT組、HA組的吸光度均隨反應時間的延長而先升高后趨于穩定,DS組和DT組的吸光度均在反應15 min后無顯著差異,HA組的吸光度在反應6 min后無顯著變化,因此,選擇DS組、DT組、HA組的反應時間分別為15、15、6 min,較GB法規定的20 min分別節省5、5、14 min,因此本法有利于提高效率。
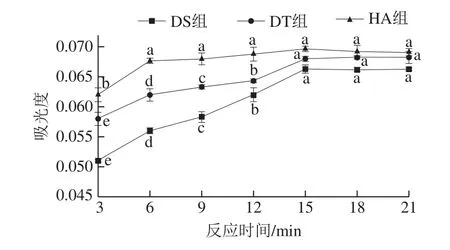
圖5 反應時間對亞硝酸鹽吸光度的影響Fig.5 Effect of reaction time on absorbance of nitrite
2.2.5 鹽酸萘乙二胺質量濃度的影響
由圖6可知,隨著鹽酸萘乙二胺質量濃度的增加,DT組和HA組的亞硝酸鹽的吸光度先升高后降低,DS組不斷降低,可能由于重氮試劑的不同導致;當鹽酸萘乙二胺的質量濃度過高時,溶液酸性增加,亞硝基在強酸條件下不穩定[27],導致顏色變淺,吸光度降低。DT組的吸光度在鹽酸萘乙二胺的質量濃度為0.3~0.7 g/L之間較高且無顯著差異;HA組在鹽酸萘乙二胺質量濃度為0.5 g/L時吸光度最大,因此,選擇DS組、DT組、HA組的鹽酸萘乙二胺質量濃度分別為0.1、0.3、0.5 g/L。
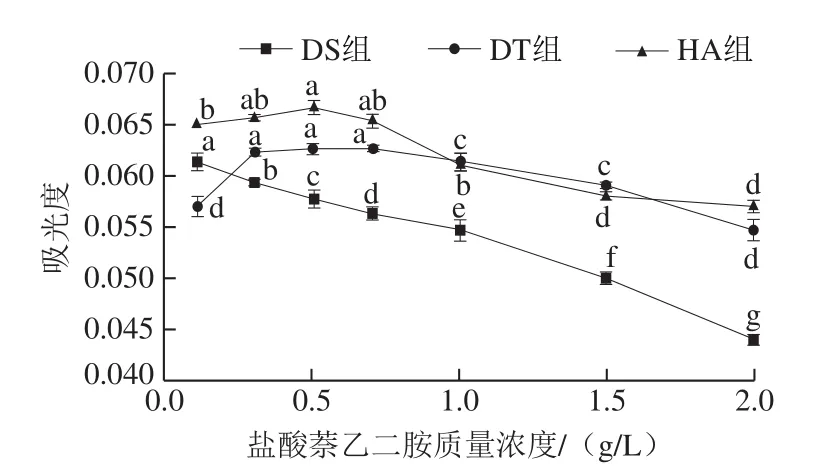
圖6 鹽酸萘乙二胺質量濃度對亞硝酸鹽吸光度的影響Fig.6 Influence of NED concentration on absorbance of nitrite
2.2.6 正交試驗優化結果
由表4~6可知,DS組、HA組、DT組的理論最優組合分別為A1B2C3D2、H3B1J3D3,T3B3P3D3;即DS組為對氨基苯磺酸質量濃度9 g/L、鹽酸萘乙二胺質量濃度0.1 g/L、丁二酸濃度0.4 mol/L、重氮-偶合試劑體積比4∶1;HA組為磺胺質量濃度9 g/L、鹽酸萘乙二胺質量濃度0.4 g/L、酒石酸濃度0.6 mol/L、重氮-偶合試劑體積比4∶1;DT組為對氨基苯乙酮質量濃度7 g/L、鹽酸萘乙二胺質量濃度0.4 g/L、蘋果酸濃度0.6 mol/L、重氮-偶合試劑體積比3∶1。在3 組試劑的理論最優組合進行驗證實驗,得出DS組、HA組、DT組吸光度分別為0.072、0.070、0.073,均與各自的對照組無明顯差異,表明DS組、HA組、DT組的理論最優組合可靠。
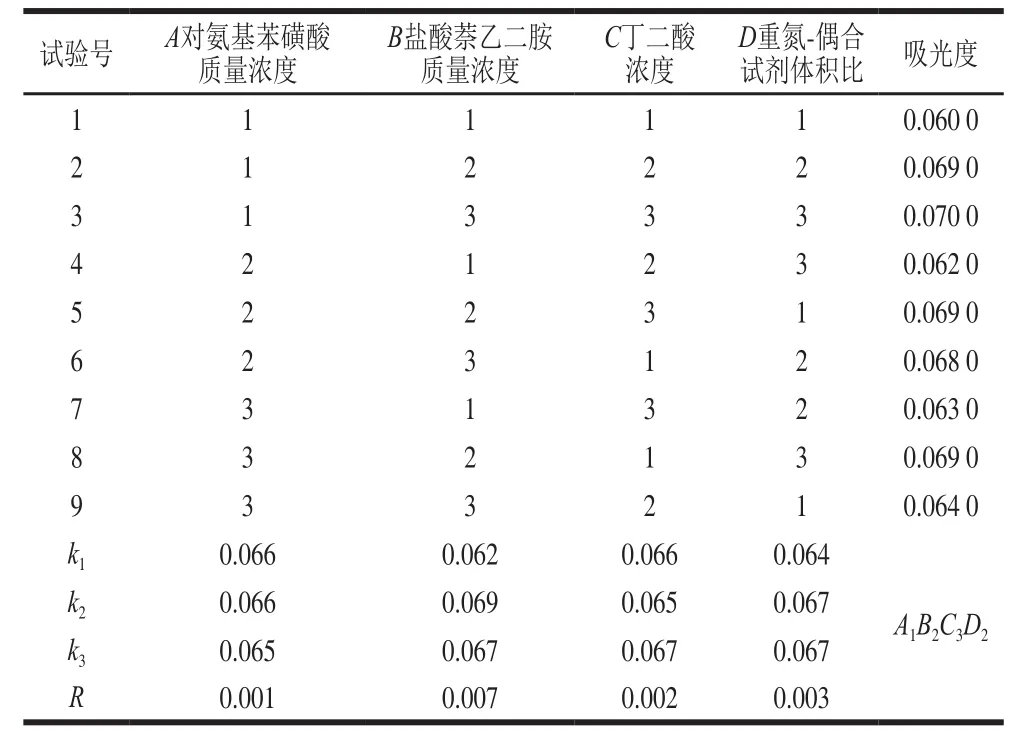
表4 DS組正交試驗設計及結果Table 4 Orthogonal array design with experimental results for optimization of ASA-NED method
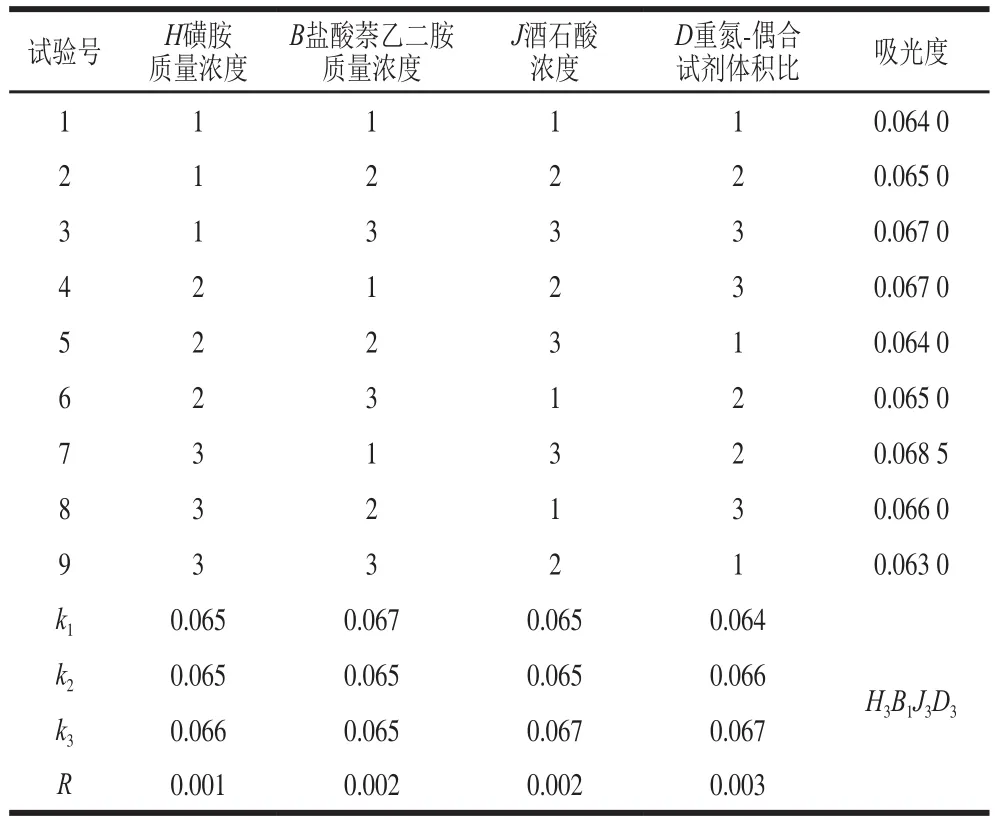
表5 HA組正交試驗設計及結果Table 5 Orthogonal array design with experimental results for optimization of AAP-NED method
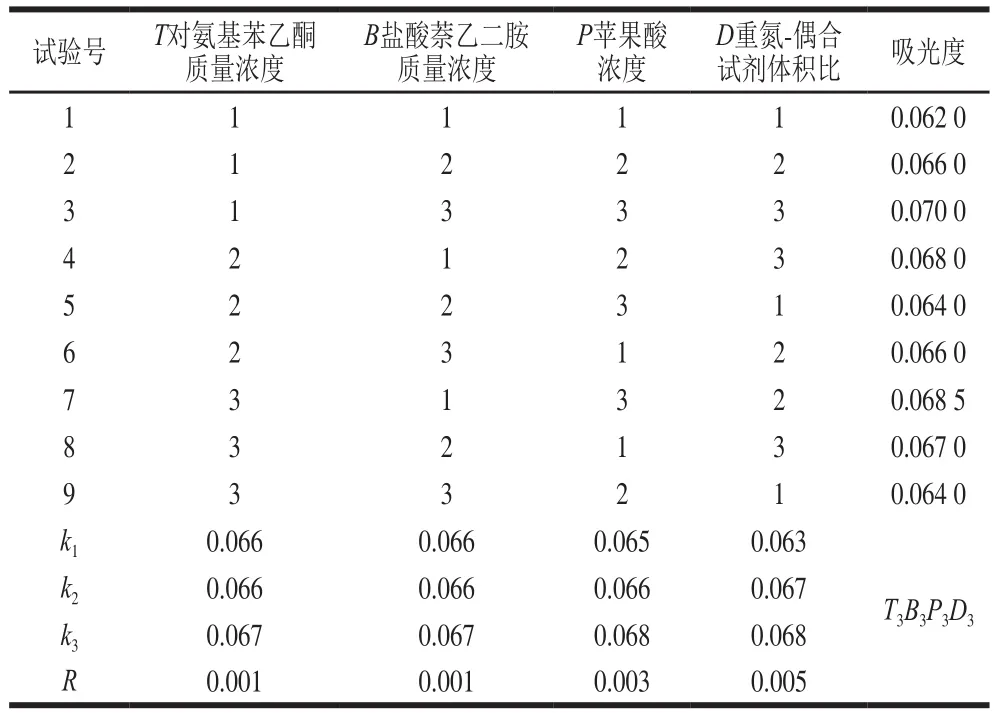
表6 DT組正交試驗設計及結果Table 6 Orthogonal array design with experimental results for optimization of SN-NED method
2.3 亞硝酸鹽檢測試劑的檢測性能
2.3.1 檢出限和線性范圍
按照DS組、HA組、DT組的最優組合,研究各組試劑的檢測范圍和線性范圍并計算檢出限,結果如圖7所示。由圖7A1、B1、C1可知,測定0~6 μg/mL的亞硝酸鹽時,DS組、HA組、DT組的吸光度均隨亞硝酸鹽質量濃度的增加而增大,當亞硝酸鹽質量濃度高于4 μg/mL時,吸光度增加平緩,表明亞硝酸鹽質量濃度過高時,應適當稀釋后再進行測定;由圖7A2、B2、C2可知DS組、HA組、DT組的線性范圍分別為0.02~3、0.02~3、0.02~3.4 μg/mL,R2分別為0.999 2、0.999 5、0.999 0,表明3 組試劑均適用于亞硝酸鹽的測定,DT組的線性范圍最廣;采用3δ法計算出DS組、HA組、DT組的檢出限分別為0.82、0.51、0.76 mg/kg,與GB法規定的1 mg/kg檢出限相比,表明3 組試劑均有較低的檢出限。
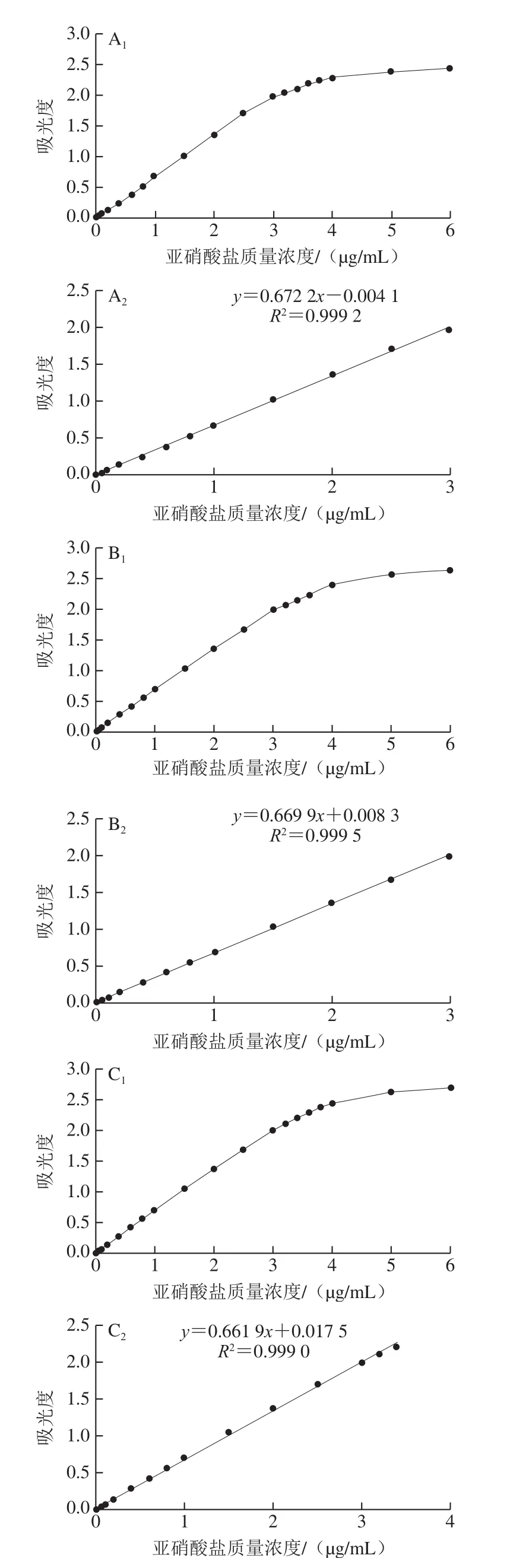
圖7 DS組(A)、HA組(B)、DT組(C)的檢測范圍和線性范圍Fig.7 Detection ranges and linear ranges of ASA-NED (A),AAP-NED (B) and SN-NED methods (C)
2.3.2 抗干擾能力
由表7可知,在5%的相對誤差內,GB法抗D-異抗壞血酸鈉、半胱氨酸、山梨酸鉀濃度干擾的能力分別達亞硝酸鹽濃度的20、10、1 000 倍,表明D-異抗壞血酸鈉和半胱氨酸對亞硝酸鹽含量測定的干擾較大,其原因可能為D-異抗壞血酸鈉具有較強的抗氧化性,將NO2-還原為NO,半胱氨酸含有的巰基與NO2-反應生成巰代亞硝酸酯[28-29]。與GB法相比,DS組、HA組、DT組抗D-異抗壞血酸鈉濃度干擾的能力分別達20、10、10 倍,抗半胱氨酸濃度干擾的能力分別達10、50、50 倍,且幾乎不受苯甲酸鈉、山梨酸鉀、安賽蜜、葡萄糖、谷氨酸、丙氨酸、草酸、蘋果酸、乳酸、琥珀酸、酒石酸、檸檬酸的干擾,表明DS組、HA組、DT組對防腐劑、甜味劑、有機酸均有較高的抗干擾能力,其中DS組與GB法的抗干擾能力相當,HA組和DT組的綜合抗干擾能力較高于GB法,表明HA組和DT可針對性的應用于醬腌菜中亞硝酸鹽含量的測定。
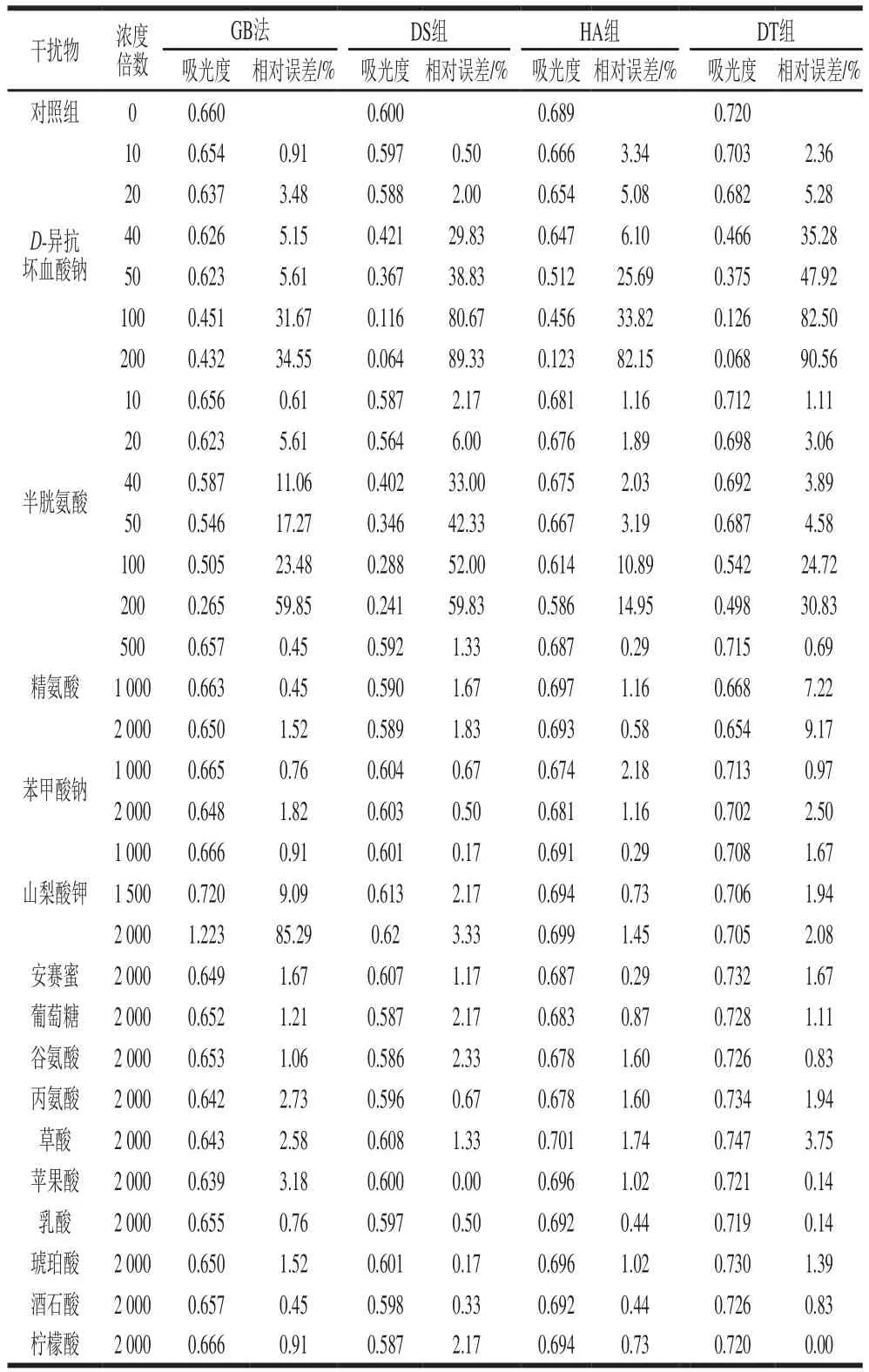
表7 抗共存物干擾能力Table 7 Resistance to coexisting substances
2.3.3 準確度和精密度
由表8可知,GB法測定15 種醬腌菜樣品的回收率在88.61%~92.66%之間,RSD均小于5%。與GB法相比,除了海帶樣品外,DS組、DT組、HA組的回收率分別為84.04%~87.00%、96.01%~99.60%、93.82%~96.24%,RSD均低于5%,表明DT組和HA組準確度較高,實驗條件精密度良好,重復性較好[30]。
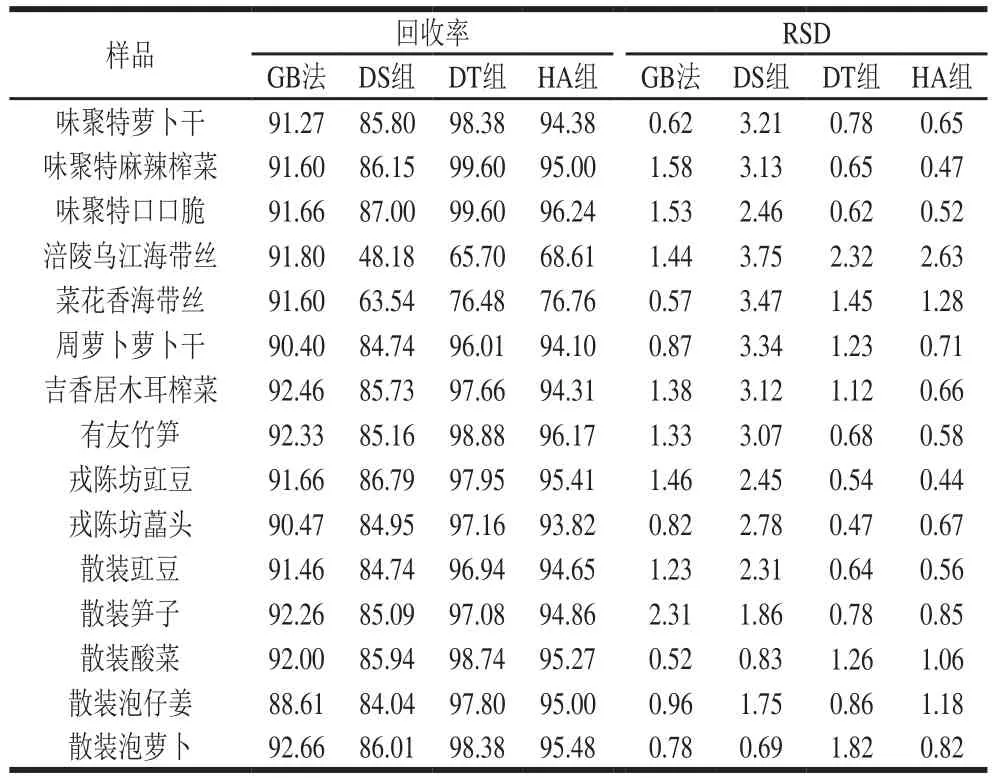
表8 GB法、DS組、HA組、DT組的回收率和精密度Table 8 Recoveries and precision RSDs of the traditional and modified methods%
2.4 實際樣品的測定
由表9可知,不同醬腌菜品種之間,亞硝酸鹽含量存在差異,GB法測得15 種醬腌菜樣品的亞硝酸鹽含量在(0.87±0.02)~(3.53±0.12)mg/kg之間,遠低于GB法中20 mg/kg的限量標準。與GB法相比,除海帶樣品外,優化后的DT組和HA組的測定結果與GB法無顯著差異,而DS組的測定結果與GB法差異顯著,其原因可能為DS組受醬腌菜中的D-異抗壞血酸鈉[31]、蔥、姜、蒜、等香辛料成分[32-33]的干擾影響較大,表明DT組和HA組的測定結果比DS組準確可靠。海帶樣品的測定結果差異較大的原因可能為海帶含有的碘成分與亞硝酸鹽反應生成NO或NO3-[34-35],其原因也可能為I-與重氮-偶合試劑存在某種反應,表明DT組和HA組適用于測定除海帶樣品外的醬腌菜中亞硝酸鹽含量。
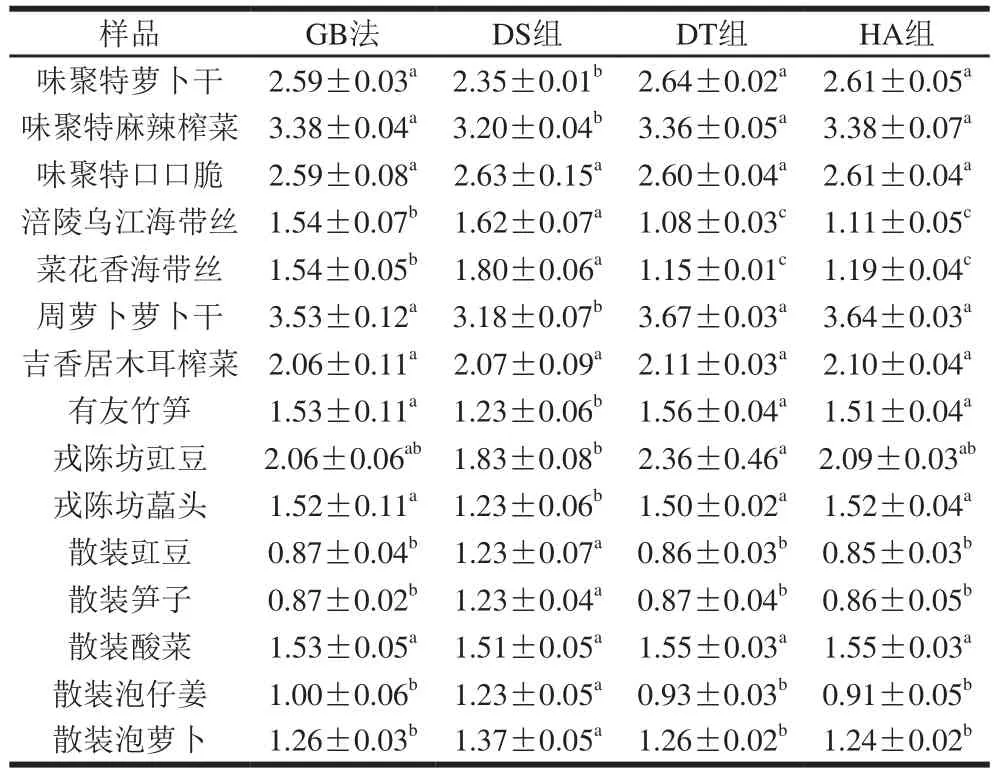
表9 樣品中亞硝酸鹽含量的測定比較Table 9 Comparison of the determination of nitrite contents in real samples by the traditional and modified methods mg/kg
2.5 HA組和DT組的貯存穩定性
根據2.3、2.4節的結果,研究HA組和DT組在25、4、30、40 ℃的避光貯存穩定性。由圖8A可知,在貯存40 d的過程中,HA組在25、4、30、40 ℃均表現出良好的穩定性;由圖8B可知,DT組僅在4 ℃保持良好的穩定性,當貯存時間超過30 d后,DT組在25、30、40 ℃的亞硝酸鹽吸光度明顯降低,表明HA組和4 ℃的DT組均可穩定貯存40 d,但HA組比DT組的貯存穩定性好。
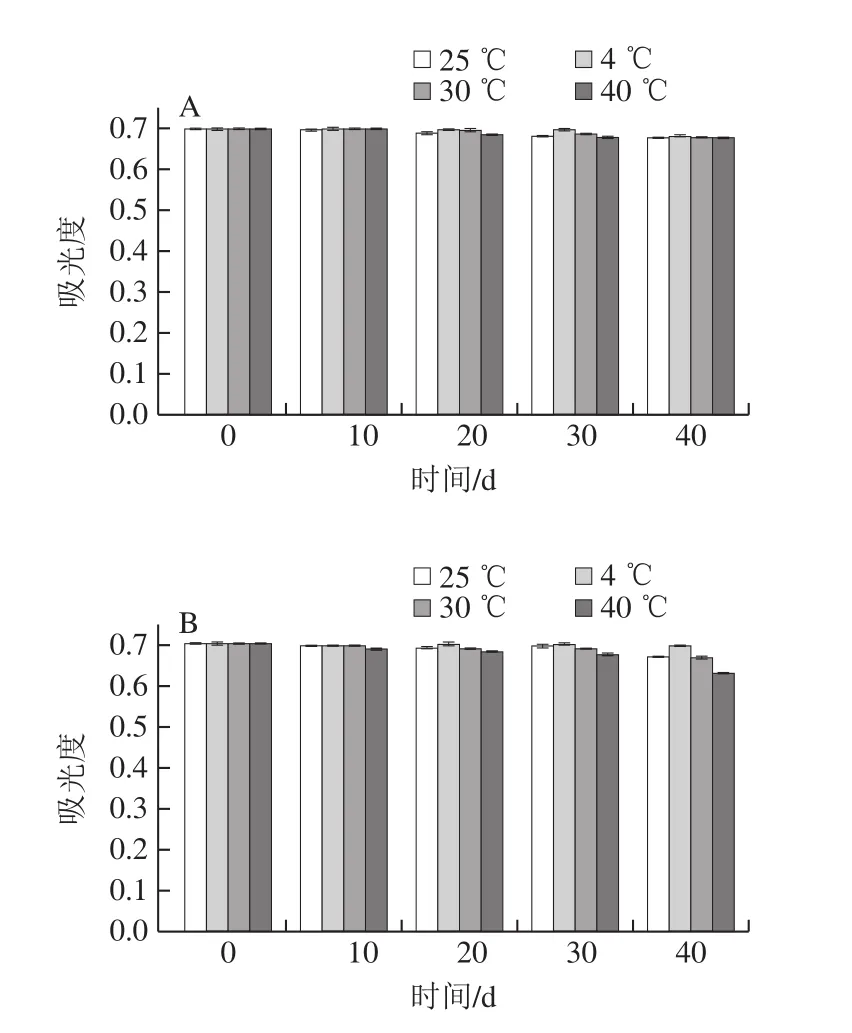
圖8 HA組(A)和DT組(B)的貯存穩定性Fig.8 Storage stability of AAP-NED (A) and SN-NED (B)
3 結 論
本實驗以GB的分光光度法作對照,采用正交試驗優化3 組亞硝酸鹽檢測試劑(DS組、DT組、HA組)代替GB法中的重氮-偶合試劑測定醬腌菜中亞硝酸鹽的含量。結果表明:本方法比GB法縮短5~14 min的檢測時間,具有更高的效率;DS組、HA組、DT組的酸性介質,丁二酸、酒石酸和蘋果酸均可有效代替GB法中的濃鹽酸作酸性介質,提高安全性;DS組、HA組、DT組的檢測線性范圍分別在0.02~3、0.02~3、0.02~3.4 μg/mL之間,檢出限分別為0.82、0.51、0.76 mg/kg,低于GB法1 mg/kg的檢出限標準;在抗干擾能力方面,DS組、HA組、DT組對防腐劑、甜味劑、有機酸均有較高的抗干擾能力,其中DS組與GB法的抗干擾能力相當,HA組和DT組的綜合抗干擾能力較高于GB法;測定15 種不同品種醬腌菜中亞硝酸鹽含量時,DT組和HA組的測定結果與GB法無顯著差異,RSD值均小于5%,DS組測定結果與GB法差異顯著;除含碘量較高的海帶樣品外,準確度大小關系為:DT組(96.01%~99.60%)>HA組(93.82%~96.24%)>GB法(88.61%~92.66%)>DS組(84.04%~87.00%);其中HA組和4 ℃的DT組均可穩定貯存40 d。綜上,DT組和HA組均展現出優良的檢測能力,可有效提高分光光度法的效率和安全性,為醬腌菜中亞硝酸鹽的快速定量檢測提供理論參考。

