馬鈴薯晚疫病生防細菌的篩選及鑒定
程海洋 魏有海 郭良芝 程亮 郭青云


摘要:為明確從矮火絨草根內分離獲得的內生細菌對致馬鈴薯晚疫病病菌的抑制作用,采用稀釋平板法分離矮火絨草內生細菌,以對峙培養法和打孔法分別測試細菌菌株和發酵液濾液對晚疫病菌絲生長和孢子囊萌發的抑制作用,并對優勢菌株進行分子生物學鑒定。結果表明,在分離的54株細菌中,有20株細菌對晚疫病病菌具明顯拮抗作用,有6 株抑菌率達80%以上。其中,KBL17和KBL8菌株對致病疫霉的抑菌率較高,分別為95.47%、88.37%;發酵濾液以KBL17和KBL6的抑菌率較高,分別為92.58%、83.21%,KBL17的孢子囊抑制率最高,為96.03%;盆栽試驗中,細菌菌株發酵濾液處理能夠導致晚疫病病情指數下降,其中KBL17菌株防效最好,達到76.04%,低于化學藥劑嘧菌酯的防效(82.57%)。田間試驗結果表明,與化學殺菌劑(70.27%)相比,KBL17菌株對晚疫病的平均防效達到 67.45%。經鑒定KBL17菌株為熒光假單胞菌(Pseudomonas fluorescens)。該菌株在馬鈴薯晚疫病防治中有較大潛力。
關鍵詞:馬鈴薯晚疫病;致病疫霉;拮抗作用;鑒定;生物防治;內生細菌
中圖分類號:S435.32?? 文獻標志碼: A
文章編號:1002-1302(2021)18-0116-06
收稿日期:2020-01-11
基金項目:國家重點研發計劃(編號:2018YFD020080505);青海省農業有害生物綜合治理重點實驗室項目(編號:2020-ZJ-Y11、2021-ZJ-Y08);青海省科技成果轉化專項(編號:2018-NK-105);第二次青藏高原綜合科學考察研究項目(編號:2019QZKK0303)。
作者簡介:程海洋(1997—),男,河南洛陽人,碩士研究生,從事生物防治等研究工作。E-mail:haiyangcheng532@163.com 。
通信作者:程 亮,碩士,研究員,從事生物防治研究工作。E-mail:liangcheng1979@163.com。
馬鈴薯,屬茄科多年生草本植物,糧飼兼用,是全球第四大重要的糧食作物,僅次于水稻、小麥和玉米,馬鈴薯產業已成為我國保障糧食安全和社會發展的重要支柱[1-2]。馬鈴薯晚疫病是由致病疫霉(Phytophora infestans)引起并導致馬鈴薯莖葉死亡和塊莖腐爛的一種毀滅性真菌病害,常導致馬鈴薯嚴重減產甚至絕收,造成全球重大經濟損失[3]。目前,使用化學殺菌劑是防治馬鈴薯晚疫病的有效方法[4-5],但頻繁使用殺菌劑對環境和人類健康均有不利影響,易造成病原菌抗(耐)藥性越來越強[6],同時加速了馬鈴薯晚疫病病菌群體遺傳結構生理分化和變異[7]。青海省是馬鈴薯的重要產區之一,因此,篩選新的用于防治馬鈴薯晚疫病的藥物,尤其是具有抗菌作用的生防菌迫在眉睫。
內生細菌(endophyte)是指生活史某一階段或全部階段生活于健康植物組織或器官的細胞間隙或細胞內的一類細菌[8]。內生細菌具有抑菌、誘導產生次生代謝物、固氮、溶磷及產吲哚乙酸等多方面的有益生物功能,增強宿主植物抗病蟲害能力及生長競爭能力等。由于內生細菌作為生防因子具有巨大優勢,因此利用內生細菌對植物病害進行生物防治已成為研究的熱點之一。許多學者通過篩選拮抗菌或其代謝產物抑制致病疫霉[9],或利用一些特定的活性物質抑制致病疫霉[10]。 如申芬等報道拮抗菌發酵液能夠顯著抑制致病疫霉菌絲生長,能使菌絲體發生畸變,降低孢子囊形成的能力,抑制孢子囊萌發、阻止休止孢萌發[11]。王梅菊等從油菜根莖部分離出來的1株枯草芽孢桿菌(Bacillus subtilis) CanL-30,可以有效地防治灰葡萄孢(Botrytis cinerea)、立枯絲核菌(Rhizoctonia solani)和油菜黑脛病病菌(Leptosphaeeria biglobosa)等引起的病害,同時也可以促進寄主油菜的生長[12]。王玉琴等從高寒草地針茅葉部分離出的1株枯草芽孢桿菌(B. subtilis) 265ZY4對馬鈴薯壞疽病病菌(Phoma foveata)、馬鈴薯炭疽病病菌(Colletotrichum coccodes)和馬鈴薯枯萎病病菌(Fusarium avenaceum)具有明顯的拮抗作用,同時具有產吲哚-3-乙酸(IAA)和溶磷等能力[13]。崔月貞等從東祁連山高寒草地牧草分離出的3株內生細菌[韋氏芽孢桿菌 (B. weihenstephanensis) 262AY11、解淀粉芽孢桿菌(B.amyloliquefaciens) 262AY6和枯草芽孢桿菌(B.subtilis) 262AY2]對馬鈴薯晚疫病的抑菌率分別為78. 41%、78. 03%、75. 38%,且262AY11 和 262AY6 具有固氮和產 IAA 的生物學功能[14]。
本研究從采集自祁連高寒草地矮火絨草根部樣品中分離篩選對馬鈴薯晚疫病有抑制效果的內生細菌菌株,并對其進行16S rDNA序列鑒定,以期為生防菌劑的研發提供菌株資源,也為植物內生細菌防治馬鈴薯晚疫病的生物防治開發應用等提供理論依據。
1 材料與方法
1.1 試驗材料
1.1.1 病原菌 致病疫霉(P. infestans)菌株,由筆者所在實驗室保存。
1.1.2 培養基
大豆酪蛋白瓊脂(TSA)培養基:胰蛋白胨15 g/L,大豆蛋白胨 5 g/L,氯化鈉5 g/L,蒸餾水 1 000 mL,瓊脂20 g/L,pH值為7.3±0.2;理查德合成瓊脂(RSA)培養基:黑麥 60 g 催芽露白后使用,番茄汁 100 mL,CaCO3 0.4 g,瓊脂 18 g,蒸餾水1 000 mL;LB 液體培養基:胰蛋白胨 10 g/L,NaCl 10 g/L,酵母提取物5 g/L,蒸餾水 1 000 mL,pH值為7.2~7.4;LB 固體培養基:胰蛋白胨10 g/L,NaCl 10 g/L,酵母提取物5 g/L,瓊脂20 g/L,蒸餾水1 000 mL,pH值為7.2~7.4。
1.2 內生細菌分離純化
按胥婷等的方法[15]分離矮火絨草根內生細菌。用無菌水洗凈矮火絨草根部泥土后,濾紙吸干表面水分,稱取1.0 g根,于無菌室內,用75%乙醇(1 min)、5%次氯酸鈉(5 min)、75%乙醇(30 s)依次對根表面進行消毒,最后用無菌水洗滌4次,吸取最后1次洗滌的無菌水100 μL涂布TSA培養基平板,28 ℃培養2 d,無菌落長出說明表面消毒合格。表面消毒后,用無菌濾紙吸干根部表面的水分,再用無菌剪刀剪碎后置于無菌研缽中,加入少量滅菌的石英砂和9 mL無菌水充分研磨,得到10-1的菌懸液。梯度稀釋分別得到10-2、10-3、10-4濃度的菌懸液,各取100 μL菌懸液涂布于TSA培養基平板上,28 ℃培養,每個梯度做3次重復,培養2~7 d,根據菌落形態、顏色、透明度等特征挑取不同的細菌菌落分離純化,純化3~5代后,得到單菌落進行轉管并室溫保存。
1.3 生防內生細菌篩選
1.3.1 平板拮抗活性測定
將分離獲得的細菌菌株接種到LB固態培養基上,37? ℃活化培養基24 h后,采用對峙培養法篩選拮抗細菌。將細菌菌株轉接到LB培養基與經RSA培養基活化的致病疫霉對峙培養,觀察菌株是否對致病疫霉菌絲生長有抑制效果,以十字交叉法測量抑菌帶,并計算抑菌率。以未接細菌菌株的RSA培養基為對照,選擇具有明顯抑菌帶的菌株,轉接到LB培養基上培養,保存備用。
抑菌率=對照菌落直徑-處菌菌落直徑對照菌落直徑×100%。
1.3.2 內生細菌發酵濾液的抑菌活性測定
內生細菌發酵濾液的制備:將離體對致病疫霉的抑菌率大于70%的菌株經LB固體培養基斜面活化后,接1環于盛50 mL LB液體培養基的250 mL三角瓶中,37 ℃振蕩培養12 h制成種子液,再按5%的接種量轉接至 50 mL LB液體培養基的250 mL三角瓶中,37 ℃擴大培養24 h得到菌液原液。將上述培養得到的菌液經 12 000 r/min離心10 min,并經細菌過濾器(22 μm)除菌后得到發酵濾液。
內生細菌發酵濾液對致病疫霉菌絲生長的影響:采用打孔法測試菌株無菌代謝液的抑菌作用,取200 μL的發酵濾液加入孔中(直徑為10 mm),以滅菌的空白LB液體培養基為對照,每個處理3次重復。抑菌率統計方法同“1.3.1”節。
內生細菌發酵濾液對致病疫霉孢子囊萌發的抑制作用:參照張鉉哲等的方法[16],將馬鈴薯晚疫病病菌制成孢子囊懸浮液,濃度調至在10×10倍顯微鏡下每個視野150~200個孢子囊,將孢子囊懸浮液與發酵濾液按1 ∶1的體積比混勻,每個處理吸取 15? μL 液體滴于干凈凹玻片上,于23 ℃培養24 h,觀察孢子囊萌發情況,芽管長于孢子囊直徑視為萌發。每個處理3次重復,每個重復以視野中所見到的孢子囊數為準,統計萌發抑制率。
1.4 溫室盆栽防效測定
試驗于2019年在青海省農林科學院植物保護所溫室中進行。馬鈴薯下寨65品種放在陰暗潮濕處催芽,將芽眼帶薯塊切下,每盆3塊,每個處理種植10盆馬鈴薯植株,待其長至10~12片葉時,分別噴施內生細菌發酵濾液和嘧菌酯,以清水為對照(CK),每株馬鈴薯植株噴施15 mL,2? d后進行晚疫病病原菌接種。接種方法參照徐生軍等的方法[17],用無菌水將晚疫病病菌培養平板上的游動孢子囊洗下,經滅菌紗布過濾后制成孢子囊懸浮液,用血球計數板將孢子囊數調為1×105個/mL,置于4 ℃冰箱中2~3 h后取出,采用噴霧法接種。接種后 7 d 調查病害情況,計算病情指數和防治效果。盆栽試驗以葉片為單位進行調查,病情分級標準按方中達的方法[18]。0級:葉片無病斑;1級:病斑面積占整個葉片面積的比例<5%;3級:病斑面積占整個葉片面積的6%~10%;5 級:病斑面積占整個葉片面積的11%~20%;7級:病斑面積占整個葉片面積的21%~50%;9 級:病斑面積占整個葉片面積的比例>50%。
病情指數=∑(各級病葉數×相對級數值)調查總葉數×最高級數值×100。
1.5 田間晚疫病防效測定
2019年田間試驗設置在青海省農林科學院馬鈴薯試驗田。采用液體發酵法制備內生菌株發酵液,過濾獲得發酵濾液。試驗小區面積為40 m2,共設置8個處理,處理1~6分別為KBL6、KBL8、KBL17、KBL18、KBL19、KBL20發酵濾液83 L/666.7 m2;處理7為250 g/L嘧菌酯懸浮劑25 g/666.7 m2;處理8為清水對照,每個處理重復3次,隨機區組排列。田間出現中心病株時進行病情指數的基數調查并施藥,之后每隔 7 d 施藥1次,共施藥3次,每次施藥前進行病情指數的調查,并于施藥后 7 d再次進行調查。每個小區分別進行5點取樣,每點選10株,計算病情指數及發病率,統計分析確定防治效果。田間試驗以整株為單位進行調查,病情分級參照方樹民等的方法[19]。0級:葉片無任何癥狀;1級:葉片上有個別病斑;2級:1/3 以下葉片有病斑;3級:1/3~1/2 葉片上有病斑;4級:1/2 以上葉片上有病斑;5 級:幾乎整株枯死。
病情指數=∑(病情級別×各級病株數)調查總株數×最高級數值×100。
防治效果=1-CK0×PT1CK1×PT0×100%。
式中:CK0表示對照組的藥前病情指數;CK1表示對照組的藥后病情指數;PT0表示藥劑處理組的藥前病情指數;PT1表示藥劑處理組的藥后病情指數。采用DPS 7.05軟件,應用Duncans新復極差法,對試驗數據進行差異顯著性分析。
1.6 菌株KBL17鑒定
本試驗采用分子生物學鑒定菌株KBL17。使用生工生物工程(上海)股份有限公司的Ezup柱式試劑盒提取內生細菌基因組,方法參照試劑盒說明書。利用1對通用引物(27f和1492r)進行PCR擴增。引物由生工生物工程(上海)股份有限公司合成,序列如下:27f:5′-AGAGTTTGATCCTGGCTCAG-3′,1492r:5′-GGTTACCTTGTTACGACTT-3′。
PCR反應體系:2×Taq PCR MasterMix 12.5 μL,DNA模板(50 ng/L)1.0 μL,上、下引物各1.0 μL,雙蒸水10.5 μL。擴增條件:95 ℃預變性 5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 1.5 min,進行40個循環;72 ℃ 延伸10 min,4 ℃保存。擴增片段用生工生物工程(上海)股份有限公司的PCR產物回收試劑盒純化后,與pMD19-T載體16 ℃連接過夜,轉化至大腸桿菌感受態細胞。陽性克隆經菌落 PCR 驗證正確后,提取質粒,由生工生物工程(上海)股份有限公司完成堿基序列測定。將測序獲得的16S rRNA通過與GenBank中核酸數據庫進行Blast分析并利用 Clustal X 軟件構建系統發育樹,確定KBL17的分類地位。
2 結果與分析
2.1 矮火絨草根內生細菌的分離結果及其抑制作用
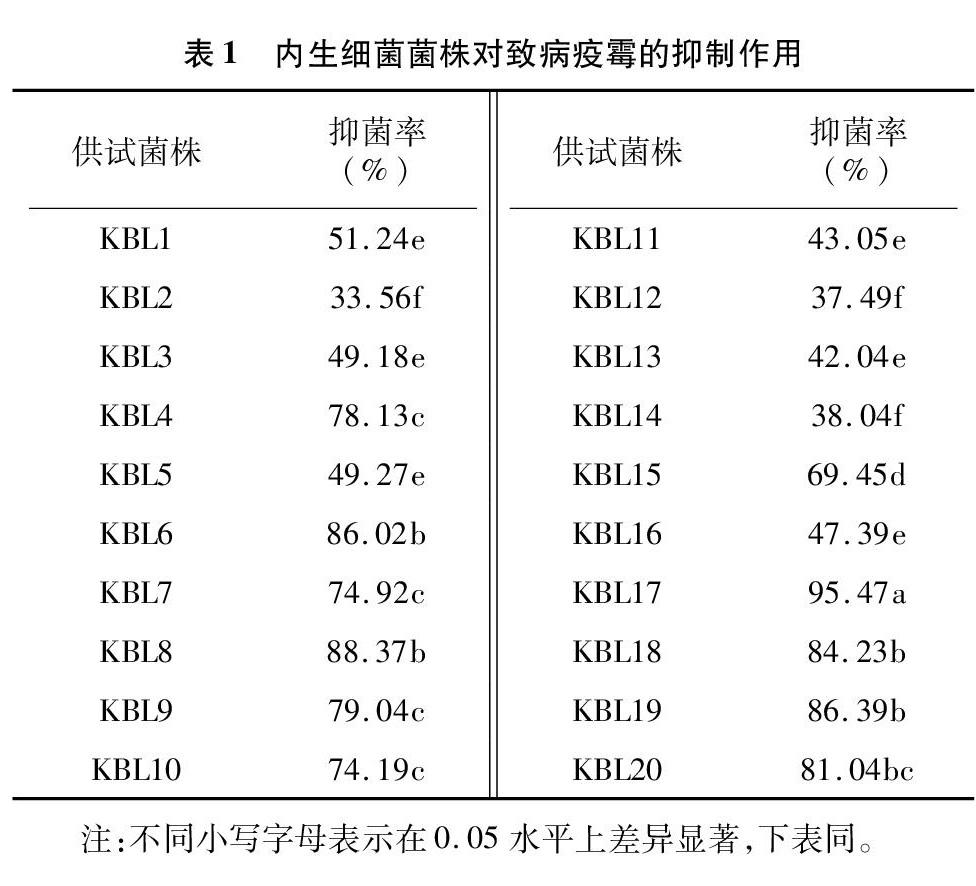
采集矮火絨草根組織,采用平板稀釋法,共分離獲得54株內生細菌,編號分別為KBL1~KBL54,大部分菌株在LB培養基上迅速生長,大多菌落表現為濕潤狀、乳白色、不規則、扁平、光滑,少數菌落邊緣褶皺、微黃色。將分離獲得的20株內生細菌分別于經RSA活化培養的致病疫霉菌株在RSA平板上對峙培養。由表1可知,能夠抑制致病疫霉生長的菌株共有20株。其中,抑菌率達到80%以上的有6株(KBL6、KBL8、KBL17、KBL18、KBL19、KBL20菌株),以KBL17菌株的抑制作用最強,抑菌率達到95.47%。在表現抑菌作用較強的菌株中,KBL6和KBL8菌株與致病疫霉之間形成的抑菌帶不明顯,而KBL18(抑菌率為84.23%)和KBL20(抑菌率為81.04%)菌株形成的抑菌帶十分明顯。
2.2 內生細菌發酵濾液的抑菌活性測定
2.2.1 內生細菌發酵濾液對致病疫霉菌絲生長的影響
將抑菌率達到80%以上的6個菌株分別擴大培養后離心過濾得到其發酵濾液。由圖1可知,供試6個菌株的發酵濾液對致病疫霉菌絲的抑制率均在80%以上,較菌株對峙培養抑菌率有所下降,分別為83.21%、80.23%、92.58%、82.36%、81.37%、80.53%。其中,KBL8菌株降幅最大,為9.21百分點,其次為KBL19菌株,降幅為5.81百分點。其他菌株對峙與發酵濾液之間幅差在5%以內,相對較穩定。綜合評價KBL17菌株的抑菌率最高(92.58%),其次是KBL6菌株(83.21%),KBL8菌株的抑菌率最低,為80.23%。
經對峙平板觀察發現,受6個菌株發酵濾液抑制的致病疫霉菌落變小,菌絲致密,生長速率降低。顯微鏡檢發現,發酵濾液導致致病疫霉菌絲畸變,菌絲無法正常伸展,菌絲尖端呈現球形的畸變。
2.2.2 內生細菌發酵濾液對致病疫霉孢子囊萌發的抑制作用
將6株內生細菌發酵濾液和致病疫霉的孢子囊懸浮液混合后發現,無菌發酵濾液均可強烈抑制致病疫霉孢子囊的萌發,抑制率達到82.49%~96.03%(圖1),顯微鏡檢發現,發酵濾液引起致病疫霉孢子囊形態發生畸變,多為外壁破裂、中空結構、內含物分隔于兩極、空孢子囊類型。
2.3 溫室盆栽防效測定
由表2可知,致病疫霉游動孢子接種 5 d 后,清水對照組病情指數達到86.17,而生防菌KBL6、KBL8、KBL17、KBL18、KBL19、KBL20處理組馬鈴薯晚疫病病情指數顯著降低,防治效果分別達到了70.56%、66.91%、76.04%、71.15%、68.85%、65.79%。陽性對照嘧菌酯的病情指數僅為15.02,防治效果達到82.57%。各處理組的病情指數與對照相比達到顯著性差異,嘧菌酯處理與各個內生菌處理組的防效達到顯著性差異,顯著高于內生菌株處理組。
2.4 田間防效測定
由表3可知,連續噴施3次生防菌劑,處理7(化學藥劑)對馬鈴薯晚疫病的防治效果最好,平均防效可達70.27%,其次為處理3(KBL17菌株),平均防效達67.45%,防效最差的為處理2(KBL8菌株),平均防效僅為54.81%。
2.5 內生菌株的鑒定
用引物27f/1492r進行PCR擴增,擴增獲得約 1 444 bp 的片段。將所得序列與GenBank數據庫中其他細菌16S rDNA基因序列進行比對,分析其分類地位。發現該菌的16S rDNA與假單胞菌序列有很高的同源性。構建16S rDNA序列系統發育樹,發現KBL17菌株與熒光假單胞菌(Pseudomonas fluorescens)聚在一個群組里(圖2),初步確定KBL17為熒光假單胞菌(P. fluorescens)。
3 結論與討論
植物內生細菌分布于宿主植物的不同部位,由于其生存環境相對封閉,因此其生長發育不易受外界不良環境的干擾,這一生境優勢使其在植物病害防治中擁有比根圍、葉圍細菌更大的應用空間[20]。利用內生細菌及其代謝產物抑制植物病害已有許多研究,目前用于防治植物病害的內生細菌種類主要以芽孢桿菌屬和假單胞桿菌屬為主[21]。有文獻報道,熒光假單胞桿菌的一些菌株已在食品[22]和環境保護[23]等領域展現出很大潛力,在馬鈴薯晚疫病防治方面,Bengtsson等研究發現1株熒光假單胞桿菌(P. koreensis 2.74)產生的表面活性劑既能使馬鈴薯致病疫霉的游動孢子裂解,也能誘導馬鈴薯對致病疫霉產生抗性[24]。Zegeye等對熒光假單胞桿菌(P. koreensis)Bak150菌株對致病疫霉具有強烈的抑制作用,抑制率可達88%以上[25]。本試驗從矮火絨草根中分離篩選致病疫霉拮抗細菌,54株細菌中有20株有一定的抑菌作用,其中活體菌株KBL17和KBL8的抑菌率最高,分別為95.47%、88.37%,而無菌代謝液以KBL17和KBL6菌株的抑菌率最高,分別為92.58%、83.21%。綜合菌株和無菌代謝液的抑菌率,以KBL17菌株的抑菌作用最為穩定,抑菌率均在90%以上。經初步鑒定,對致病疫霉抑制能力較強的菌株KBL17為熒光假單胞桿菌,這與蔣繼志等報道的結果[26]相一致。
目前,很多在平板上對致病疫霉有拮抗作用的菌株,當用于盆栽或田間防治時,防治效果減弱或無防治效果。Caulier等施用假單胞菌P. protegens 44R-P8 和P. brenneri 43R-P1的菌懸液,對馬鈴薯晚疫病的防治效果分別為83%、64%[27]。李雙東等施用枯草芽孢桿菌EB-2的菌懸液和無菌體發酵液,對馬鈴薯晚疫病的防治效果分別為61.80%、60.54%[28]。胡軍華等將假單胞菌20-5的發酵液先噴于馬鈴薯葉片上再接種馬鈴薯晚疫病菌,馬鈴薯苗不發病或發病很輕。在本研究盆栽試驗中,6個菌株處理與對照相比,馬鈴薯晚疫病病情指數均有不同程度的下降,說明6個菌株對馬鈴薯晚疫病有很好的抑菌活性,其中以菌株KBL17的防效最高,為76.04%,略低于化學農藥嘧菌酯的防效(82.57%)[29]。田間試驗中,菌株KBL17的平均防效為67.45%,嘧菌酯的平均防效為70.27%。說明該菌株在馬鈴薯晚疫病的生物防治中具有應用潛力。
綜上,噴施內生細菌有助于馬鈴薯抵抗晚疫病病菌的侵染,提高馬鈴薯的抗病能力,在田間試驗中也具有良好的防治效果,未來可通過內生細菌與化學殺菌劑聯合使用,以減少晚疫病病菌的侵染,達到防病增收的效果。關于內生細菌在大田生產中的應用,仍需大量試驗,其作用機制也需更深入的研究。
參考文獻:
[1]謝從華. 馬鈴薯產業的現狀與發展[J]. 華中農業大學學報(社會科學版),2012,17(1):1-4.
[2]Forbes G A,Pérez W,Andeade-Piedra J. Field assessment of resistance in potato to Phytophthora infestans:International cooperators guide[M]. Lima:International Potato Center,2014.
[3]Mosquera T,Alvarez M F,Jiménez-Gómez J M,et al. Targeted and untargeted approaches unravel novel candidate genes and diagnostic SNPs for quantitative resistance of the potato (Solanum tuberosum L.) to phytophthora infestans causing the late blight disease[J]. PLoS One,2016,11(6):e0156254.
[4]Chmielarz M,Sobkowiak S,Dbski K,et al. Diversity of Phytophthora infestans from Poland[J]. Plant Pathology,2014,63(1):203-211.
[5]Arora R K,Sharma S,Singh B P. Late blight disease of potato and its management[J]. Potato Journal,2014,41(1):16-40.
[6]田薈遙,蔣繼志,侯 寧,等. 馬鈴薯致病疫霉生理小種鑒別寄主的組培條件優化及部分生理小種的鑒定[J]. 河北農業大學學報,2017,40(5):78-83,89.
[7]李成斌,張紅霞,李 巖,等. 2015—2017年北方5省(區)致病疫霉抗藥性監測及與嘧菌酯交互抗性[J]. 河北農業大學學報,2018,41(6):75-79,103.
[8]方珍娟,張曉霞,馬立安. 植物內生菌研究進展[J]. 長江大學學報(自然版),2018,15(10):41-45.
[9]Guo B,Wang Y,Sun X,et al. Bioactive natural products from endophytes:a review[J]. Applied Biochemistry and Microbiology,2008,44(2):136-142.
[10]Li Y,Xia L Q,Wang Y N,et al. The inhibitory effect of Epicoccum nigrum strain XF1 against Phytophthora infestans[J]. Biological Control,2013,67(3):462-468.
[11]申 芬,蔣繼志,侯 寧,等. 5種拮抗菌復合發酵對致病疫霉的抑制及離體防病作用研究[J]. 河北農業大學學報,2018,41(1):11-16,23.
[12]王梅菊,劉 晨,吳明德,等. 油菜內生細菌多樣性分析及菌株CanL-30生防潛力評估[J]. 中國油料作物學報,2018,40(2):258-268.
[13]王玉琴,楊成德,王 穎,等. 針茅內生細菌菌株265ZY4的鑒定及其生物學功能[J]. 微生物學通報,2015,42(1):101-109.
[14]崔月貞,楊小利,楊成德,等. 拮抗馬鈴薯晚疫病菌的高寒草地牧草內生細菌的鑒定及其生物功能測定[J]. 植物保護學報,2016,43(5):789-795.
[15]胥 婷,楊麗強,宋 宇,等. 不同草原類型針茅根部可培養內生細菌群落結構及其功能[J]. 生態學雜志,2015,34(11):3101-3110.
[16]張鉉哲,李媛媛,李 璐,等. 抗病誘導劑與殺菌劑混合處理對馬鈴薯晚疫病的防治效果[J]. 中國蔬菜,2019(9):55-61.
[17]徐生軍,姚亮亮,李新新,等. 黑龍江省和吉林省馬鈴薯晚疫病菌對氟啶胺和甲霜靈的敏感性變化[J]. 植物保護,2009,35(5):80-85.
[18]方中達. 植病研究方法[M]. 3版.北京:中國農業出版社,1998.
[19]方樹民,翁定河,徐大東,等. 馬鈴薯品種對晚疫病的抗性評價[J]. 福建農業科技,2001(4):5-6.
[20]蔣繼志,郭俊亭,李麗艷. 致病疫霉拮抗真菌研究進展[J]. 河北大學學報(自然科學版),2012,32(1):105-112.
[21]Glare T,Caradus J,Gelernter W,et al.Have biopesticides come of age?[J].Trends Biotechnol,2012,30(5):250-258.
[22]王 僑,秦正山,袁 濤,等. 兩種假單胞桿菌協同發酵產脂肪酶優化和酶性質研究[J]. 釀酒科技,2018(4):38-46.
[23]魏荷芬,韓保安,王田野,等. 一株熒光假單胞桿菌的分離鑒定與反硝化特性[J]. 微生物學通報,2016,43(8):1679-1689.
[24]Bengtsson T,Holefors A,Liljeroth E,et al. Biosurfactants have the potential to induce defence against phytophthora infestans in potato[J]. Potato Research,2015,58(1):83-90.
[25]Zegeye E D,Santhanam A,Gorfu D,et al. Biological activity of Trichoderma viride and Pseudomonas fluorescens against Phytophthora infestans under greenhouse conditions[J]. International Journal of Agricultural Technology,2011,7(6):1589-1602.
[26]蔣繼志,梁延銀,王懷遠,等. 致病疫霉拮抗熒光假單胞桿菌的篩選及離體防病作用[J]. 河北農業大學學報,2013,36(3):72-76.
[27]Caulier S,Gillis A,Colau G,et al. Versatile antagonistic activities of soil-borne Bacillus spp. and Pseudomonas spp. against Phytophthora infestans and other potato pathogens[J]. Frontiers in Microbiology,2018,9:143.
[28]李雙東,曹克強. 枯草芽孢桿菌EB-28對馬鈴薯晚疫病菌的抑菌作用及防病效果[J]. 安徽農業科學,2009,37(24):11376-11378.
[29]胡軍華,周澤楊,藍希鉗,等. 假單胞菌20-5菌株對致病疫霉的作用[J]. 西南農業學報,2007,20(5):1002-1005.

