一種羊肚菌源多肽MIP-16的分離純化及其神經保護活性
熊 川,黃文麗,金 鑫,羅 強,李 萍,張 璐,李 強,朱 宇*
1四川省農業科學院生物技術核技術研究所,成都 610061;2重慶醫科大學附屬第二醫院 感染病分子重點實驗室肝炎研究所,重慶 400010;3成都大學藥學與生物工程學院,成都 610106
帕金森病(Parkinson’s disease,PD)是人類第二大神經退行性疾病[1],65歲以上人群中患病率為2%~3%[2]。PD的病理特征可概括為黑質致密區大量多巴胺能神經元丟失,進而導致黑質和紋狀體多巴胺生物合成減少[3]。PD的致病機理還不明確,研究證實,環境因素、遺傳因素、氧化應激等均可能參與PD多巴胺能神經元的變性死亡過程[4]。其中,氧化應激是導致神經元退化變性的一個重要原因,一方面,大腦是人類正常的生理活動中耗氧量最大的器官,但腦內的抗氧化酶相對缺乏,使大腦非常容易受到氧化應激損傷[5];另一方面,早期研究表明,黑質致密區多巴胺能神經元線粒體氧化應激的增加可觸發多巴胺依賴性毒性級聯反應,導致溶酶體功能障礙和α-突觸核蛋白的積累[6],這是PD的兩個主要病理特征。目前,醫學上大多采用經典的多巴胺替代療法來治療PD,如L-3,4-二羥基苯丙氨酸(L-DOPA)的補充。但越來越多的研究發現,這一經典的療法存在較大的副作用,臨床觀察發現,長周期的L-DOPA治療,有一定概率導致PD患者的運動障礙[7]。因此,從減少氧化壓力入手,尋找新的神經保護劑,是預防治療PD的潛在途徑之一。
近年來,從天然產物中提取純化具有抗氧化活性的神經保護劑受到廣泛關注并取得了顯著的進展。從景天科植物紅景天(RhodiolaroseaL.)根部提取到的紅景天苷能夠抑制氧化應激和炎癥來保護凋亡的PC12細胞[8]。芍藥苷則通過抑制NF-κB的活化來緩解6-羥基多巴胺誘導的PC12細胞凋亡[9]。然而,與植物相比,真菌神經保護劑的研究相對較少。某些真菌多糖能夠表現出較好的自由基清除活性,發揮神經保護作用[10]。然而真菌多糖分子量大,結構復雜,難以穿透血腦屏障,其作為神經保護劑的應用受到限制。某些真菌的乙醇提取物或水提取物含有神經保護因子[11],但提取物的成分尚不清楚,功能物質的結構有待鑒定。
羊肚菌(Morchellaspp.)是一種名貴的食藥用真菌,《本草綱目》記載其“甘寒無毒,化痰理氣,益腸胃”。梯棱羊肚菌(MorchellaimportunaM.Kuo.)是我國大面積人工栽培的品種,在本課題組前期的研究中確認,梯棱羊肚菌水提物中具有擬神經生長因子(nerve growth factor,NGF)的物質,能夠促進PC12細胞分化,形成神經網絡[12]。基于此,本研究進一步純化鑒定梯棱羊肚菌子實體中的功效成分,構建6-OHDA損傷的PC12細胞模型,驗證梯棱羊肚菌子實體中功效成分的神經保護活性,為人工栽培的羊肚菌保健功效的開發提供數據,為真菌源神經保護劑的篩選提供備選資源。
1 材料與方法
1.1 材料
1.1.1 樣品
梯棱羊肚菌子實體采集自四川省農業科學院食用菌栽培基地,37 ℃烘箱中烘干待用。大鼠嗜鉻瘤細胞株(PC12)購買自美國模式菌種收集中心(American Type Culture Collection,ATCC)菌種保藏中心,ATCC編號為CRL-1 721。
1.1.2 試劑
C18色譜柱(PerkinElmer,美國);Sephadex 30 increase分子排阻色譜柱(GE Healthcare,瑞典);胎牛血清、DMEM培養液(Thermo Scientific,美國);青霉素、鏈霉素、3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑藍(MTT)(Sigma,美國);超氧化物歧化酶(SOD)檢測試劑盒、過氧化氫酶(CAT)檢測試劑盒、谷胱甘肽過氧化物酶(GSH-Px)檢測試劑盒、Caspase-3檢測試劑盒(碧云天,中國);活性氧(ROS)檢測試劑盒(Abcam,英國);其他試劑均為分析純(國藥集團化學試劑有限公司)。
1.1.3 儀器
紫外分光光度計(Molecular Devices,美國);旋轉蒸發儀(EyelaOSB 2000,日本);冷凍干燥機(CHRIST Beta 2-8 LSCplus,德國);高效液相色譜儀(Perkinelmer CT 06484,美國);CO2細胞培養箱(Thermo,美國);倒置顯微鏡(Olympus,日本)。
1.2 方法
1.2.1 梯棱羊肚菌子實體多肽(MIP-16)的提取純化
稱取梯棱羊肚菌子實體干品50 g,置于中藥材粉碎機粉碎后過100目篩網,獲得梯棱羊肚菌子實體干品粉末。梯棱羊肚菌子實體干品粉末中蛋白質的含量根據GB/T5009.5-2010凱氏定氮法測定。梯棱羊肚菌子實體干品粉末中多肽的提取按照如下步驟進行:按照粉末/PBS緩沖液的料液比1∶30加樣,充分攪拌后置于磁力攪拌器120轉攪拌過夜,靜置后取上清。上清液通過截留分子量為3 500 Da的透析袋透析24 h,收集透析液,旋轉蒸發儀濃縮,獲得的濃縮液采用真空冷凍干燥機冷凍干燥,可獲得梯棱羊肚菌子實體多肽提取物干粉。
取梯棱羊肚菌子實體多肽提取物干粉10 g,無菌水溶解,配制成濃度為100 mg/mL的溶液,上樣于Superdex 30 Increase凝膠過濾柱,無菌水洗脫,通過自動收集器收集洗脫液,后于215 nm下測定洗脫液的吸光值,收集并凍干單一峰,得到梯棱羊肚菌子實體多肽復合物。
取梯棱羊肚菌子實體多肽復合物干粉1 g并溶解于無菌水,配制成濃度為10 mg/mL的溶液,通過反向高效液相色譜純化,收集單一峰,獲得梯棱羊肚菌子實體多肽(MIP-16)。色譜條件設置如下:色譜柱選用PE C18柱(150 mm×4.6 mm),A相:純凈水,B相:含0.1%三氟乙酸的乙腈;進樣量設定為30 μL;柱溫設置為25±5 ℃;流速選擇1.0 mL/min;檢測波長設定為215 nm。洗脫條件:A相:0~8 min,99%→97%;8~12 min,97%→96%;12~16 min,96%→80%;16~20 min,80%→99%。
通過液相色譜-質譜(LC-MS-MS)解析MIP-16的氨基酸組成。液相A液為含0.1%甲酸水溶液,B液為0.1%甲酸乙腈溶液。色譜柱以A液平衡。樣品由自動進樣器上樣,再經色譜柱梯度分離,流速為0.3 mL/min,柱溫70 ℃。質譜條件:樣品用TripleTOF 5 600+質譜儀進行質譜分析。分析時長:18 min,檢測方式:正離子,一級質譜掃描范圍:600~3 500m/z。
1.2.2 MIP-16形態觀察
取2 mg MIP-16置于附有銅膠帶的樣品臺,通過離子濺射儀(Quorum,英國)給樣品鍍上一層導電金粉,置于掃描電鏡下觀察(Quanta FEG 250,美國)。樣品在20.0 kV加速電壓下進行檢查[13]。選擇清晰的視野拍照。
1.2.3 細胞培養及處理
PC12細胞用含5%胎牛血清和10%馬血清的1640培養基培養。取對數期細胞按照3×104個/mL濃度接種于96孔板,每孔100 μL。隨后,PC12細胞與不同濃度的MIP-16共同孵育6 h,移除培養基,加入不同濃度的6-OHDA處理。之后通過MTT法測定PC12細胞的活力。

式中,A樣品代表不同濃度MIP-16處理后的細胞吸光值;A對照代表正常培養的細胞的吸光值。
1.2.4 PC12細胞中ROS測定
取對數期生長的PC12細胞以3×104個/mL濃度接種于96孔板,每孔100 μL。待細胞貼壁后用不同濃度的MIP-16處理6 h,移除培養基,加入不同濃度的6-OHDA處理。移除培養基,用預冷的PBS緩沖液沖洗細胞2遍,用DCFDA-細胞活性氧(ROS)檢測試劑盒測定PC12細胞中的ROS含量。
1.2.5 PC12細胞中MDA和內源性抗氧化酶活力測定
PC12細胞的處理如“1.2.4”,收集細胞,預冷的PBS溶液清洗并重懸PC12細胞。6 000 rpm離心收集細胞,加入100 μL細胞裂解液,漩渦振蕩儀處理1 min,6 000 rpm離心10 min,取100 μL上清加入到96孔板中,隨后用酶標儀測定吸光度,計算MDA,SOD,CAT和GSH-Px的含量,其中MDA測定532 nm吸光值,SOD測定450 nm吸光值,CAT測定520 nm吸光值,GSH-Px測定340 nm吸光值。
1.2.6 MIP-16神經保護作用機制探索
PC12細胞的處理如“1.2.4”,收集細胞,預冷的PBS溶液清洗并重懸PC12細胞。采用QPCR法測定細胞內Bcl-2和Bax的表達情況。通過Trizol試劑(Sigma,美國)完成PC12細胞RNA提取。

表1 QPCR引物的核酸序列Table 1 Nucleotide sequences of the QPCR primers
應用SYBR Premix Ex Taq試劑盒(Selleckchem,美國),完成30次循環。
進一步測定Caspase-9和-3的活性。采用碧云天公司的Caspase-9和-3活性檢測試劑盒(c1158和c1115)完成細胞Caspase-9和-3活性的測定。取對數生長期PC12細胞以總量1×106個/孔完成6孔板接種,MIP-16處理6 h,構建6-OHDA誘導的PC12細胞損傷模型,PBS清洗并收集細胞,加入裂解液并于冰上裂解5 min,4 ℃下10 000 rpm離心10 min,反應緩沖液處理,405 nm下測定吸光值。
1.3 數據分析
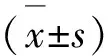
2 結果
2.1 MIP-16分離純化及結構鑒定
依據GB/T5009.5-2010凱氏定氮法,測定梯棱羊肚菌子實體粉末中蛋白質的含量為26.62%±1.17%。50 g梯棱羊肚菌子實體粉碎后通過磷酸鹽緩沖液提取,3 500 Da透析袋透析并將所得透析液凍干后共得到多肽提取物干粉9.85 g,得率為19.7%。10 g多肽提取物經過分子排阻色譜Superdex 30 Increase凝膠過濾后(見圖1A),依據分子量的大小,獲得了4個洗脫峰,分子量由大到小以此標記為A1~A4,分別收集洗脫峰。通過DPPH自由基清除實驗測定了各組分的DPPH自由基清除活性,結果表明組分A2自由基清除活性最強,因此選擇A2組分作為梯棱羊肚菌多肽復合物進行下一步純化。最終獲得的多肽復合物(A2)凍干粉0.48 g,得率為4.8%。組分A2通過RP-HPLC進行分離純化后,獲得3個組分,即B1~B3。測定自由基清除活性后,選擇B2作為梯棱羊肚菌多肽,即MIP-16。最終獲得MIP-16凍干粉0.14 g,得率為14%。

圖1 MIP-16的分離純化Fig.1 Isolation and purification of MIP-16注:A:分子排阻色譜圖;B:RP-HPLC色譜圖。Note:A:Gel chromatographic;B:RP-HPLC chromatographic.
多次重復實驗以收集足夠量的MIP-16進行LC-MS-MS分析。通過LC-MS-MS分析,解析出MIP-16由16個氨基酸組成,相對分子質量為1 762 Da,氨基酸組成序列為Thr-Ile-Thr-Leu-Glu-Val-Glu-Ser-Ser-Asn-Ile-Thr-Asn-Asp-Val-Lys(見圖2)。

圖2 MIP-16的氨基酸序列Fig.2 Amino acid sequence of MIP-16
在掃描電鏡下,MIP-16呈現不規則的片狀結構,片狀結構的邊緣出現不規則的卷曲(見圖3)。

圖3 MIP-16的掃描電鏡圖Fig.3 Scanning electron micrograph image of MIP-16
2.2 MIP-16的神經保護作用
選擇大鼠腎上腺髓質嗜鉻瘤分化細胞株(PC12),并建立6-OHDA誘導損傷的細胞模型,用不同濃度的MIP-16對細胞進行處理。結果表明,作用濃度介于0~160 μM的MIP-16對PC12細胞活性沒有抑制作用。然而,6-OHDA對PC12具有顯著的抑制作用(見圖4A)。25 μM的6-OHDA處理24 h后,細胞活力顯著下降,為對照組的85.83%±3.25%,隨著6-OHDA的濃度增大,PC12細胞活力持續下降,100 μM的6-OHDA處理24 h,PC12細胞活力降至對照組的一半,繼續增大6-OHDA的濃度,PC12細胞活力未見顯著性下降,因此,后續實驗中,6-OHDA濃度設定為100 μM。6-OHDA作用時間對PC12細胞活力的影響如圖4B所示,隨著作用時間的增加,PC12細胞的細胞活力逐漸降低,6-OHDA處理24 h,細胞活力降低至對照組的52.42%±3.19%,作用時間繼續增長,細胞活力不再出現顯著性下降。基于此,后續實驗中6-OHDA的作用時間設置為24 h。通過MIP-16的預先孵育,6-OHDA對PC12細胞的損傷作用顯著減少(見圖4C)。20 μM的MIP-16預處理,使得細胞活力恢復為62.86%±2.89%,與未經MIP-16預處理的PC12細胞呈現顯著性差異。40 μM的MIP-16則可使PC12細胞活力保持在69.98%±2.54%。

圖4 MIP-16對6-OHDA引起細胞損傷的保護作用Fig.4 MIP-16 increased the cell viability of PC12 cells exposed to 6-OHDA注:A:6-OHDA處理24 h后的細胞活力;B:不同作用時間的6-OHDA對細胞活力的影響;C:MIP-16對細胞的保護作用。A、C中,不同小寫字母代表5%水平的差異,即P < 0.05。B中,與未經6-OHDA處理的細胞相比,*P < 0.05,**P < 0.01。Note:A:Cell viability determination of PC12 cells co-cultured with different concentrations of 6-OHDA for 24 h;B:Cell viability of PC12 cells co-cultured with 6-OHDA at a concentration of 100 μM for different time;C.Protective effect of MIP-16 on cells.In A and C,Different lowercase letters represent significant differences at the 5% level.In B,compared with PC12 cells not exposed to 6-OHDA,*P < 0.05,**P < 0.01.
2.3 MIP-16神經保護作用的機制
2.3.1 MIP-16對細胞內ROS和MDA含量的影響
6-OHDA的處理會使得PC12細胞內的ROS水平顯著上升,如圖5A所示,濃度為100 μM的6-OHDA處理24 h后,PC12細胞內的ROS水平達到對照組的2.3倍。20 μM的MIP-16預處理能夠顯著降低ROS的水平,為對照組的1.8倍,40 μM的MIP-16具有更好的抑制效果,ROS僅為1.6倍,即162.19%±4.14%。PC12細胞MDA的含量與ROS具有相同的趨勢(見圖5B),6-OHDA的處理會使得MDA的含量上升為對照組的280.87%±6.89%,10 μM的MIP-16預處理能夠顯著降低MDA的含量,為對照組的2.2倍,MIP-16濃度的增加,抑制效果進一步增強。

圖5 MIP-16對PC12細胞ROS和MDA含量的影響Fig.5 Effect of MIP-16 on the content of ROS and MDA in PC12 cells注:與對照組相比,#P < 0.05,##P < 0.01;與6-OHDA處理的細胞相比,*P < 0.05,**P < 0.01,下同。Note:A:ROS content;B:MDA content.Compared with the control group,#P < 0.05,##P < 0.01;Compared with the 6-OHDA group, *P < 0.05,**P < 0.01,the same below.
2.3.2 MIP-16對細胞內源性抗氧化酶活的影響
6-OHDA的處理會使PC12細胞內源性抗氧化酶系的活力顯著下降,如圖6所示,SOD活性為對照組的52.21%±4.11%,CAT為40.31%±3.86%,GSH-Px則為39.62%±2.91%。不同濃度的MIP-16處理后,內源性抗氧化酶系活力明顯升高。40 μM的MIP-16處理,能夠使CAT和GSH-Px的活力與6-OHDA處理組呈現極顯著差異。

圖6 MIP-16對PC12細胞內源性抗氧化酶活的影響Fig.6 Effect of MIP-16 on the activity of endogenous antioxidant enzymes in PC12 cells
2.3.3 MIP-16對凋亡相關蛋白表達的影響
6-OHDA的處理會改變Bax和Bcl-2的表達量,100 μM的6-OHDA處理24 h后,Bax的相對表達量增加為192.82%±5.72%,Bcl-2的相對表達量下降至40.48%±1.74%。MIP-16的預處理則能夠下調Bax的表達,上調Bcl-2的表達,調整Bax/Bcl-2的比例。圖7B展示了PC12細胞中Caspase的活性,6-OHDA處理后,PC12細胞中Caspase-9和-3的活性都顯著升高,其中,Caspase-3達到對照組的205.41%±7.74%,Caspase-9則為242.76%±6.01%。通過不同濃度的MIP-16預處理后,Caspase-9和-3的活性都顯著下降。

圖7 MIP-16對6-OHDA誘導的PC12細胞凋亡的影響Fig.7 Effect of MIP-16 on apoptosis induced by 6-OHDA in PC12 cells
3 討論與結論
3.1 真菌多肽的提取
某些大型真菌具有極高的食藥用價值,同時含有豐富的蛋白質,是獲得天然多肽的理想原料。Cordymin是提取自冬蟲夏草(Cordycepssinensis)中的一種多肽,該多肽能夠抑制炎癥發生,對大鼠由于缺血缺氧引起的腦損傷具有緩解作用[14]。從杏鮑菇(Pleurotuseryngii)菌絲體中分離的多肽PEMP具有抗氧化、抗腫瘤和免疫強化功能[15]。目前,真菌的功效成分多集中在多糖的研究上,相較于真菌多糖,多肽結構簡單,免疫原性低,且易于人工合成,是現代藥物開發的極具發展潛力的部分。目前從蛋白質水解物中分離純化多肽多采用色譜柱法,包括離子交換色譜法和/或凝膠過濾色譜法,前者可以根據離子和極性分子的電荷進行分離,后者可以根據分子大小進行分離。然后,目前尚未見對真菌多肽提取的標準方法的報道,提取緩沖液的pH值、提取過程中是否需要蛋白酶酶解等尚未探索。此外,從不同種類的真菌中提取多肽往往對應著不同的提取方法,這不利于真菌多肽的推廣應用。相較于真菌多糖成熟標準的提取方法,真菌多肽的提取方法需要進一步的探索。本研究中采用分子排阻色譜和反向高效液相色譜連用的方法純化獲得MIP-16,該方法首先通過分子大小進行粗分,再依據其極性進行細分,實驗證明該方法的區分度較好,但是試驗所需時間較長,還需要進一步改進完善。
3.2 帕金森綜合癥(PD)的藥物治療
黑質紋狀體多巴胺能神經元的變性和細胞死亡導致多巴胺缺乏,是PD的主要病因。因此,多巴胺替代療法(如補充L-DOPA等)是目前治療特發性帕金森病的最佳方法之一,通過外源多巴胺的補充,來緩解癥狀。然而,在最初的最佳治療反應期后,長周期的L-DOPA治療往往伴隨著運動功能喪失等副作用。此外,已有學者在長期服用L-DOPA的帕金森病患者的尿液中檢測到6-OHDA[16],因此,本研究中,我們通過6-OHDA處理PC12細胞,模擬PD的初期發生,尋找新的神經保護劑。在本研究中,我們發現6-OHDA的處理會使得PC12細胞中ROS的含量升高,進而會引發細胞凋亡。由此我們推測,長期L-DOPA治療會產生較多的6-OHDA,可能對PD的治療起到負反饋調節作用。基于以上分析,從降低氧化壓力,減少氧化損傷入手,有望篩選到高效安全的神經保護劑。而高等真菌中含有的多糖、多肽、三萜等成分具有較好的抗氧化活性,因此,我們從真菌中尋找神經保護劑,為PD的藥物篩選提供資源。
3.3 氧化應激與PD的發生
氧化反應可以為人體生命活動提供能量,但是反應過程中產生的超氧陰離子自由基和羥基自由基能引起氧化損傷。內源性抗氧化酶等抗氧化劑的存在使ROS的產生和消耗趨于平衡,在正常狀態下,維持一種穩態。但是有研究發現,隨著年齡的增長,抗氧化系統的效率逐漸降低,在老年人群中,活性氧的增加超過了抗氧化系統的清除能力,繼而會產生氧化壓力,可能導致PD等神經退行性疾病的發生[17]。內源性抗氧化酶包括超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-Px)等,是機體天然的抗氧化應激防御系統[18]。6-OHDA處理后,細胞內抗氧化酶活性顯著降低。由此可以推測,此時細胞內的抗氧化酶系統明顯超過正常負荷。MIP-16預處理6 h可顯著提高PC12細胞內源性抗氧化酶活性,SOD水平反映了細胞內抗氧化酶系統的負荷,可間接反映細胞內自由基的水平。這一結果可能表明,經過MIP-16預處理后,陰離子超氧物的生成量有所減少。此外,GSH-Px是細胞抗氧化防御的核心成分,也是ROS的電子供體,提示MIP-16作為另一種解毒系統,可能影響GSH的代謝,避免6-OHDA誘導的細胞死亡。
當內源性抗氧化酶系統不能及時清除ROS時,ROS容易損傷生物大分子,最終導致細胞凋亡。Bcl-2和Bax分別是Bcl-2蛋白家族中最具代表性的凋亡抑制基因和凋亡促進基因[19]。Bax基因編碼的Bax蛋白能與Bcl-2形成異二聚體,抑制Bcl-2的表達。研究發現Bax/Bcl-2蛋白的比值是決定細胞凋亡抑制作用強度的關鍵因素,Bax/Bcl-2也可認為是凋亡發生的分子開關。Bax誘導細胞凋亡的機制是Bax在tBid的作用下進入線粒體,增加線粒體膜的通透性,然后釋放細胞色素C,細胞色素C的釋放是細胞凋亡內源性途徑中的關鍵步驟,通過靶向和激活Caspase-9而發生,導致效應物半胱天冬酶(如Caspase-3)的激活[20]。因此,本研究通過檢測Bcl-2和Bax的表達水平以及Caspase(Caspase-3和Caspase-9)的活性來探討MIP-16對6-OHDA誘導的細胞凋亡的保護作用。本研究中我們觀察到,用MIP-16預處理6-OHDA可以顯著提高Bcl-2的水平和降低Bax的水平,抑制Caspase-3和Caspase-9的活性,以上結果提示MIP-16可能通過調節Bcl-2/Bax比例,抑制Caspase-3/-9的活性發揮抗凋亡作用。
研究結果表明,MIP-16對6-OHDA誘導的PC12細胞凋亡有明顯的抑制作用:(1)重塑內源性抗氧化酶活性,包括SOD、CAT和GSH-Px,作為一種內源性抗氧化促進劑。(2)降低ROS水平和MDA生成,從而降低細胞氧化水平,抑制凋亡的啟動。(3)調節Bax/Bcl-2比值,抑制Caspase-9和3的表達,從而阻斷細胞線粒體凋亡途徑。MIP-16結構簡單,易于人工合成,有望作為一種緩解和輔助治療PD的藥物進行開發利用。

