右歸丸對慢性腎臟病大鼠AQPs表達影響的研究
謝希,何清湖,陳平安,黃家望,朱夢晨,李玲
(1.湖南中醫藥大學中西醫結合學院,湖南 長沙 410208;2.湖南中醫藥大學醫學院,湖南 長沙 410208;3.湖南中醫藥大學中醫學院,湖南 長沙 410208)
慢性腎臟病(Chronic Kidney Disease,CKD)已經成為世界范圍內的公共衛生問題。據估計,全球CKD的患病率為8%~16%[1]。腎纖維化是各種進行性發展的腎臟疾病的共同歸宿,以成纖維細胞和細胞外基質的過度增生為主要特征[2]。TGFβ-Smads信號通路的激活和炎癥反應在腎纖維化的過程中發揮著重要作用[1,3]。水通道蛋白(Aquaporins,AQPs)是一類參與水分子運輸的蛋白家族,能夠介導自由水的跨生物膜轉運。目前在哺乳動物體內已經發現了13種AQPs,其中包括AQP1、AQP2和AQP3在內的8種水通道蛋白在腎臟的不同部位表達[4]。腎纖維化動物模型腎組織中AQP1、AQP2和AQP3的表達顯著降低,提示上調水通道蛋白的表達可能是延緩和改善腎纖維化的有效途徑[5-7]。右歸丸出自《景岳全書》,由熟地黃、枸杞、山茱萸、肉桂等藥物組成,具有溫補腎陽、填精止遺的作用,主要適用于腎陽不足,命門火衰,腰膝酸軟等腎陽虛癥狀,臨床應用和基礎研究均表明右歸丸對慢性腎臟病具有良好療效[8-10]。但目前對于右歸丸是否通過上調水通道蛋白的表達來改善腎纖維化損傷的研究較少。本研究通過腺嘌呤建立CKD大鼠模型,以右歸丸為干預因素,探討其對CKD大鼠腎組織中水通道蛋白表達的影響,以期為右歸丸的臨床應用提供實驗依據。
1 實驗材料
1.1 實驗動物
SPF級雄性大鼠40只,體質量220~240 g,適應性飼養1周,購自湖南斯萊克景達實驗動物公司,動物質量合格證號:SCXK(湘)2016-0002。
1.2 主要實驗試劑
腺嘌呤(Sigma-Aldrich貿易有限公司,A8626),右歸丸(北京同仁堂股份有限公司同仁堂制藥廠,Z11021040),RIPA蛋白裂解液(CWBIO,CW2334S),BCA蛋白濃度測定試劑盒(CWBIO,CW0014S),SDS-PAGE凝膠制備試劑盒(CWBIO,CW0022),彩色預染蛋白marker(Fermentas),ECL發光檢測試劑盒(Thermo Fisher,35055),TGF-β1抗體(Abcam,ab27969),Smad-2抗體(Abcam,ab33875),AQP1抗體(Bioss,bs-1506R)、AQP2(Bioss,bs-0261R)、AQP3 (Bioss,bs-1253R),β-actin抗體(Bioss,bsm-33036M),HRP標記羊抗鼠二抗(Proteintech,SA00001-1),HRP標記羊抗兔二抗(Proteintech,SA00001-2),大鼠TNFα Elisa試劑盒(Abcam,ab46070),大鼠IL-10 Elisa試劑盒(Abcam,ab100764)。
1.3 主要實驗儀器
微量移液器(德國Eppendorf),水平搖床(北京六一儀器廠),臺式高速冷凍離心機(美國Thermo),多功能酶標儀(美國Bio-tek,Synergy2),電泳儀(美國Bio-rad),垂直電泳槽(美國Bio-rad),電轉槽(美國Bio-rad),石蠟切片機(美國A0820),化學發光成像分析系統(美國Bio-rad,ChemiDoc XRS+)。
2 實驗方法
2.1 CKD大鼠模型建立及實驗分組
將40只大鼠隨機分為正常組、模型組、左卡尼汀組和右歸丸組,參考YOKOZAWA T[11]的方法建立CKD大鼠模型,取腺嘌呤加純水配制成30 mg·mL-1的混懸液,每只大鼠每日攝入劑量為150 mg·kg-1,正常組給予等量生理鹽水灌胃,連續4周。模型建立后,按照動物體表面積換算法,大鼠臨床給藥劑量分別為左卡尼汀0.323 g·kg-1和右歸丸2.913 g·kg-1,灌胃4周,水合氯醛麻醉后處理動物。
2.2 檢測指標
2.2.1 HE染色觀察大鼠腎組織病理學變化
取大鼠腎組織用4%多聚甲醛固定,乙醇梯度脫水,二甲苯透明,浸蠟,石蠟切片,HE染色,脫水,透明,封片,于顯微鏡下觀察腎組織病理變化。
2.2.2 透射電鏡觀察大鼠腎組織超微病理學變化
取大鼠腎組織用2.5%戊二醛固定,經過常規電鏡處理方法進行脫水、浸泡、包埋、固化、切片和染色等步驟,最后在透射電鏡下觀察。
2.2.3 免疫組織化學法檢測腎組織中AQP1、AQP2和AQP3的蛋白定位與半定量表達情況
取大鼠腎組織用4%多聚甲醛固定,乙醇梯度脫水,二甲苯透明,浸蠟,石蠟切片,脫蠟,抗原修復,一抗孵育,PBS洗滌3次,滴加第二抗體,30 min后洗滌,滴加鏈霉素-親和素-生物素復合物,30 min后洗滌,加DAB溶液進行顯色,30 min后洗凈,蘇木素復染,隨后脫水,透明,封片,于顯微鏡下觀察腎組織染色情況,染色呈棕黃色為陽性,利用圖像分析軟件Image Pro Plus 6.0對圖像進行信號分析,計算各視野的平均光密度值(IOD/Area)。
2.2.4 Western blot法檢測腎組織中TGF-β1、Smad-2、AQP1、AQP2和AQP3蛋白的表達水平
取大鼠腎組織,RIPA裂解液提取腎組織總蛋白,BCA法測蛋白濃度,定量取50 μg蛋白變性,進行SDS-PAGE凝膠電泳。轉膜后,5%脫脂奶粉封閉2 h,加入一抗β-actin、TGF-β1、Smad-2、AQP1、AQP2和AQP3多克隆抗體按照1∶1 000的比例稀釋,4 ℃過夜,TBST洗3次,二抗1∶3 000比例稀釋,37 ℃孵育1 h,洗滌后,加ECL顯影,用化學發光成像儀進行顯影,用圖像分析軟件Image J對圖像進行信號分析,計算靶蛋白/β-actin的值。
2.2.5 酶聯免疫吸附法檢測大鼠血清中TNFα和IL-10表達水平
根據Elisa試劑盒說明書,檢測各組大鼠血清中TNFα和IL-10的含量。
2.3 統計學方法
3 結果
3.1 右歸丸對大鼠腎組織病理變化的影響
如圖1所示,正常組大鼠腎小球、腎小管結構完整,大小均勻,腎組織未見壞死、未見炎性細胞浸潤及水腫滲出;模型組大鼠腎組織大面積壞死,腎小球硬化,健存腎小球數量減少,腎小球上皮細胞脫落減少,腎小管管腔狹窄,管壁增厚,健存的管腔呈囊性擴張,其中有滲出和炎性細胞浸潤,大量腺嘌呤晶體沉積。右歸丸組和左卡尼汀組大鼠腎組織炎癥反應程度顯著好轉,腎小球硬化和纖維化情況轉輕。
3.2 右歸丸對大鼠腎組織超微病理變化的影響
如圖2所示,正常組大鼠腎臟腎小球濾過膜(三層:內層為內皮細胞、中間層為基底膜、外層為上皮細胞和足細胞)見高電子密度致密物沉積于腎小球基底膜內側,內皮細胞下,大小不等的團塊狀,上皮細胞下偶見少量沉積物,基底膜局部輕微增厚。模型組大鼠腎臟腎小球濾過膜見上皮細胞腫脹,胞漿呈低電子密度,線粒體腫脹,脊斷裂、消失呈低電子密度空泡狀,細胞核核膜擴張;基底膜彌漫性高度增厚,基底膜中層粗大帶狀高電子致密物沉積,內皮細胞下、基底膜內側見高電子致密物沉積,上皮細胞下、基底膜外側和上皮細胞下見駝峰樣高電子致密物沉積。右歸丸組和左卡尼汀組的大鼠腎組織上述超微病理改變程度減輕。

圖2 各組大鼠腎組織超微病理改變觀察結果
3.3 右歸丸對大鼠腎組織AQP1、AQP2和AQP3蛋白表達的影響
如圖3和表1所示:AQP1主要表達于腎近曲小管,AQP2和AQP3主要表達于腎集合管。模型組大鼠腎組織中AQP1、AQP2、AQP3蛋白的表達水平顯著降低(P<0.05)。藥物干預后,右歸丸組和左卡尼汀組大鼠腎組織中AQP1、AQP2、AQP3的表達水平均顯著提高(P<0.05)。

圖3 各組大鼠腎組織AQP1、AQP2和AQP3蛋白定位與表達水平

表1 各組大鼠腎組織AQP1、AQP2和AQP3蛋白平均光密度
3.4 右歸丸對大鼠腎組織TGF-β1、 Smad-2、AQP1、AQP2和AQP3蛋白表達的影響
如圖4和表2所示:模型組大鼠腎組織中TGF-β1、Smad-2蛋白的表達水平顯著提高(P<0.05),AQP1、AQP2和AQP3蛋白的表達水平顯著降低(P<0.05)。藥物干預后,右歸丸組和左卡尼汀組大鼠腎組織中TGF-β1和Smad-2的表達水平顯著降低(P<0.05),AQP1、AQP2、AQP3的表達水平顯著提高(P<0.05)。

圖4 各組大鼠腎組織TGF-β1、Smad-2、AQP1、AQP2和AQP3表達水平
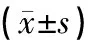
表2 各組大鼠腎組織TGF-β1、Smad-2、AQP1、AQP2和AQP3表達水平
3.5 右歸丸對大鼠血清IL-10和TNF-α水平的影響
如表3所示:與正常組比較,模型組大鼠血清中TNFα水平顯著提高,IL-10水平顯著降低。與模型組比較,右歸丸組的大鼠血清中TNFα水平顯著降低,IL-10水平顯著提高,差異均具有統計學意義(P<0.05)。

表3 各組大鼠血清TNFα和IL-10水平
4 討論
慢性腎臟病是一種由腎臟損傷導致的隱匿性疾病,最終可能導致終末腎疾病,預后較差。腎小球濾過率(Glomerular Filtration Rate,GFR)是診斷CKD的最佳指標,當GFR小于60 mL/(min·1.73 m2),并持續3個月以上,即可診斷為CKD。許多慢性腎臟疾病的最終常見病理表現是腎纖維化。腎纖維化是由于慢性、持續性腎損傷后腎組織愈合不成功導致的,其特征是腎小球硬化,腎小管萎縮和間質纖維化。這些病理改變是導致腎小球濾過率下降的直接原因。
AQP1是最先發現的水通道蛋白,其主要分布于近端小管的頂端膜和基底側膜,參與水的重吸收。AQP2主要位于集合管主細胞的頂端膜上,其重吸收功能主要受精氨酸加壓素的調節。AQP3則位于集合管主細胞的基底側膜[4]。研究表明[5,12],AQP1在腎纖維化中表達是降低的,它與腎纖維化中上皮-間質轉化(EMT)密切相關,敲除促EMT相關基因后,AQP1表達顯著升高,體外細胞實驗則表明,用轉化生長因子1(TGF-β1)刺激腎近曲小管上皮細胞后,AQP1蛋白表達水平顯著下降,提示AQP1的表達與TGF-β1信號通路相關。AQP2是目前腎臟中研究最多的水通道蛋白,上調AQP2蛋白表達可減少腎纖維化大鼠尿量,改善腎臟功能[13]。AQP3可以通過激活MAPK信號通路,對腎臟和MDCK細胞凋亡起保護作用[14]。敲除AQP3基因后,AQP2蛋白表達也明顯下調,小鼠表現出明顯的尿液濃縮功能障礙[15],說明AQP2與AQP3表達是相互影響的。本研究通過Western blot、免疫組織化學技術,對大鼠腎組織中的AQP1、AQP2和AQP3蛋白表達水平進行檢測,結果顯示:與正常組比較,模型組的大鼠腎組織中AQP1、AQP2和AQP3蛋白表達水平均顯著下降(P<0.05);與模型組比較,右歸丸組和左卡尼汀組的大鼠腎組織中AQP1、AQP2和AQP3蛋白的表達水平均顯著提高(P<0.05)。
TGFβ/Smads信號通路的激活是導致腎纖維化最重要的機制之一[3]。TGF-β主要通過誘導細胞凋亡、促進肌成纖維細胞合成細胞外基質、減少細胞外基質的降解和誘導不同類型的細胞轉化為肌成纖維細胞從而誘導腎纖維化的產生[3,16]。本研究表明:與正常組比較,模型組的大鼠腎組織中TGF-β1和Smad-2的表達顯著提高(P<0.05)。與模型組的大鼠比較,右歸丸組和左卡尼汀組的大鼠腎組織中TGF-β1和Smad-2蛋白表達含量顯著降低(P<0.05)。
大量證據表明炎癥反應在腎纖維化的發生發展過程中起著重要作用[1]。腫瘤壞死因子α(TNFα)對于機體內環境的平衡極為重要,在細胞生存,凋亡,壞死以及細胞間通訊中發揮著重要作用,這些細胞生理功能的紊亂會造成機體的炎癥[17]。TNFα可以刺激IL-1β、CCL2、TGFβ1的釋放[18]。各種腎臟疾病患者體內的TNFα水平均增加[19-20]。通過降低TNFα的水平可以延緩CKD在各種動物模型中的進展[21]。白介素10(IL-10)作為一種免疫抑制細胞因子主要起限制炎癥反應、上調免疫力和促進組織修復的作用,在感染和炎癥過程中維持組織穩態[22]。有研究表明[23-24],IL-10可以抑制腎小球腎炎和腎小球硬化的發生,敲除IL-10基因后加重了腎損傷模型中的腎纖維化。本研究發現,與正常組的大鼠比較,模型組的大鼠血清中TNFα的水平顯著升高,IL-10的水平顯著降低;與模型組比較,右歸丸組和左卡尼汀組的大鼠血清中TNFα的水平顯著降低,IL-10的水平顯著升高,差異具有統計學意義(P<0.05)。
綜上所述,右歸丸可能是通過抑制TGFβ/Smads信號通路的激活、提高AQP1、AQP2和AQP3蛋白的表達水平、抑制機體炎癥反應、提高機體抗炎能力,改善腎纖維化,從而實現對慢性腎臟病大鼠的保護作用。但本研究尚有諸多不足之處,如右歸丸對慢性腎臟病干預作用的量效關系,以及右歸丸提高腎組織AQPs表達的具體機制及其發揮作用的物質基礎等均有待進一步研究。

