大分割放療中不同呼吸方式對左側乳腺癌保乳術后患者心臟損傷的影響
段曉怡,王瑩,呂笑靜,劉璐,王朝陽
(河南科技大學第一附屬醫院 婦科乳腺外科,河南 洛陽 471000)
乳腺癌是一種發病率、病死率較高的惡性腫瘤,進行局部切除、淋巴結清掃等保乳治療后往往還需要進行輔助化療等一系列治療[1]。由于乳腺的解剖部位較特殊,作為放療靶區時其后方心臟難以避免受到射線影響,容易出現放射性心臟損傷(radiation-induced heart disease,RIHD)[2]。RIHD包括從亞臨床微血管病變到臨床嚴重心血管事件的一系列并發癥,既往研究多集中在臨床心血管事件,對早期放射性損傷的研究較少。EC-T化療后聯合放療是臨床乳腺癌放化療的標準治療原則,其中大分割放療是指單次照射劑量>2 Gy的放療方法,能在保證常規分割同樣療效的情況下明顯縮短治療時間,但過少分割次數可能加大RIHD風險[3]。目前關于乳腺癌放射性亞臨床心臟損傷的發生以及心臟時間的劑量效應關系研究較少。本研究選取河南科技大學第一附屬醫院收治的67例行左側乳腺癌保乳術患者,分析在大分割放療中采用不同呼吸方式對該類患者心臟損傷的影響。
1 資料與方法
1.1 一般資料回顧性分析2018年1月至2020年12月河南科技大學第一附屬醫院收治的67例行左側乳腺癌保乳術患者,按照放療中呼吸控制方式分為對照組(自由呼吸,34例)和觀察組(深吸氣屏氣,33例)。觀察組:年齡26~68歲,平均(48.16±5.41)歲;ACJJ分期,Ⅰ期20例,Ⅱ期13例。對照組:年齡23~70歲,平均(47.87±5.37)歲;ACJJ分級Ⅰ期18例,Ⅱ期16例。兩組患者年齡、ACJJ分期比較,差異無統計學意義(P>0.05)。
1.2 選取標準(1)納入標準:①符合《中國抗癌協會乳腺癌診治指南與規范(2017年版)》[4]中診斷標準,且為初診患者;②乳腺腫瘤單發,距乳頭乳暈2 cm以上且直徑小于3 cm;③患者具有保乳治療意愿,且接受規范性保乳手術治療;④心臟一般檢查結果正常。(2)排除標準:①入組前存在放化療史;②鉬靶X線廣泛鈣化灶;③合并急慢性心功能不全、冠心病、心律失常等基礎心臟疾病。
1.3 治療方法兩組患者均接受左側乳腺癌保乳術治療,術后均接受EC-T化療。給予500 mg·m-2環磷酰胺+80 mg·m-2表柔比星,每個周期21 d,治療3個周期后給予75 mg·m-2多西他賽。化療結束2~4周后進行大分割放療。對照組在放療過程中自由呼吸,觀察組在放療過程中深吸氣屏氣,放療劑量均分15次完成。患者均取仰臥位,觀察組事先經過訓練,能熟練配合呼吸裝置(保證每次屏氣超過35 s,吸氣超過1 L,并能重復屏氣和吸氣超過5次),然后在此吸氣條件下進行CT定位掃描,對照組常規自由呼吸,并將獲取的原始圖像上傳到Pinnacle系統,勾畫臨床靶體積并外放成計劃靶體積。所有患者均接受左側乳95%計劃靶體積43.5 Gy,分15次完成,制定以切線野為主的調強放療計劃。
1.4 觀察指標記錄化療前后所有患者心臟的平均劑量、最大劑量、受到5、10、20、30、40 Gy照射的相對體積分數(V5~V40)。放療前2周、放療結束1個月后采集患者空腹靜脈血4 mL,3 000 r·min-1離心 5 min取上清液,采用化學發光法檢測血清肌鈣蛋白(cardiac troponin Ⅰ,cTnⅠ)水平,采用酶聯免疫吸附試驗檢測血清N末端B型腦鈉肽前體(N-terminal pro-brain natriuretic peptide,NT-proBNP)水平,試劑盒均來自于武漢明德生物科技股份有限公司。
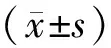
2 結果
2.1 血清cTnⅠ、NT-proBNP水平放療前,兩組血清cTnⅠ、NT-proBNP水平比較,差異無統計學意義(P>0.05);放療后,兩組血清cTnⅠ、NT-proBNP水平均較放療前升高,且觀察組血清cTnⅠ、NT-proBNP水平均低于對照組(P<0.05)。見表1。
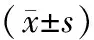
表1 兩組放療前后血清cTnⅠ、NT-proBNP水平比較
2.2 心臟結構劑量-體積參數放療后,觀察組心臟的平均劑量、最大劑量、相對體積分數(V5~V40)均低于對照組(P<0.05)。見表2。
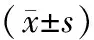
表2 兩組放療后心臟結構劑量-體積參數比較
2.3 不良心臟事件發生情況隨訪3個月,兩組患者均未出現臨床嚴重心臟事件。對照組有15例出現亞臨床心臟事件,其中單純心肌酶事件7例,單純心電圖事件4例,單純左室射血分數(left ventricular ejection fraction,LVEF)下降1例,心肌酶合并心電圖事件3例;觀察組有8例出現亞臨床心臟事件,其中單純心肌酶事件4例,單純心電圖事件2例,心肌酶合并心電圖事件1例,LVEF下降合并心電圖事件1例。觀察組亞臨床心臟事件發生率為24.24%(8/33),對照組亞臨床心臟事件發生率為44.12%(15/34),兩組亞臨床心臟事件發生率比較,差異無統計學意義(χ2=3.219,P=0.073)。
3 討論
放化療是乳腺癌治療方案中重要組成部分,對延長患者壽命和降低病死率均存在較大作用。既往放療過程中多忽視對心臟的防護,隨著臨床應用廣泛和觀察時間的延長,發現患者可出現急慢性心包疾病、瓣膜功能異常、冠狀動脈疾病等一系列RIHD并發癥,甚至會增加心血管疾病死亡風險。
cTnⅠ是一種常見的心肌損傷標志物,能在損傷早期就通過受損細胞膜進入血液中,且其水平與損傷程度成線性關系。NT-proBNP是心室中腦鈉肽前體蛋白分解而成、具有舒張血管作用的蛋白,隨心肌缺血程度升高分泌量逐漸升高。本研究發現,放療后兩組血清cTnⅠ、NT-proBNP水平較放療前均升高,且觀察組血清cTnⅠ、NT-proBNP水平低于對照組,提示EC-T化療后序貫大分割放療后兩組患者均出現了不同程度的心肌損傷,其中觀察組損傷程度更輕。相關研究認為,RIHD的發生與放療心臟受到劑量、化療藥物劑量累積有關,而大分割放療能一次性給予患者更高放射強度,增肌藥物的累積劑量,從而增加心臟損傷風險[5]。本次采用的蒽環類藥物能延長浦肯野纖維動作點位,導致多種心律失常的出現,且與RIHD存在協同作用。觀察組在放療過程采用的深吸氣屏氣相對于常規自由呼吸能改變心臟與放射靶區的相對位置,減少心臟受到的放射劑量。本研究發現,放療后觀察組心臟的平均劑量、最大劑量、相對體積分數(V5~V40)均低于對照組,提示在深吸氣屏氣的情況下能使心臟受到的放射劑量明顯降低,而降低心臟受到的放射劑量也是最有效減輕心臟損傷的方法。有研究納入了103例行左側乳腺癌保乳術后放療患者,發現采用深吸氣屏氣能使心臟受到的平均放射劑量降低35%~60%,冠狀動脈左前降支受到的平均放射劑量降低40%~70%[6]。還有研究總結了41例乳腺癌放療患者,結果表明采用深吸氣屏氣能明顯降低心臟受到的平均放射劑量,從而減輕RIHD造成的總生存時間影響[7]。但由于隨訪時間不同、影響乳腺癌預后混雜因素較多,目前這種劑量學變化能給患者帶來多少獲益目前尚無定論。比較兩組發生亞臨床心臟事件發生情況發現,觀察組亞臨床心臟事件發生率較低,但與對照組比較并無統計學差異,與相關研究結果不同[8],這可能與本研究納入樣本較少、隨訪時間較短有關。本研究的初步結果為乳腺癌接受EC-T化療后序貫大分割放療可造成一定的心臟損傷,能為乳腺癌放療的心臟劑量學設計提供參考,以期降低RIHD,改善患者預后。
綜上所述,左側乳腺癌保乳術患者接受EC-T化療后序貫大分割放療,均可在放療結束早期出現明顯心臟損傷,且損傷程度與所受到的劑量有關。

