KDM6A基因對急性髓系白血病細胞增殖、凋亡的影響
駱婷婷,劉 洋,張 瑞,于文燕
(1新疆醫科大學第一附屬醫院血液病中心實驗室,烏魯木齊 830054;2新疆醫科大學基礎醫學院;*通訊作者,E-mail:945265580@qq.com)
急性髓系白血病(acute myeloid leukemia,AML)是一類血液系統惡性腫瘤,其特征主要是血液和骨髓中髓系原始細胞的異常克隆擴增[1],在我國常見于成人,且發病率隨著年齡的增長呈上升趨勢[2,3]。現已研究確定該病主要生物學特征是細胞增殖失控,治療手段也主要針對這一生物學特征進行,但是,還是存在一部分患者停藥復發等問題[4]。隨著對白血病發病分子機制深入研究,靶向治療成為白血病治療的發展趨勢[5]。賴氨酸特異性去甲基化酶6A(lysine-specific demethylase 6A,KDM6A)主要是組蛋白H3的第27位賴氨酸(histone H3 at lysine 27,H3K27)去甲基化酶,可以催化H3K27三甲基化(H3K27 tri-methylated,H3K27me3)去甲基化,促進基因表達,在胚胎發育過程中起到重要的作用[6,7]。已有研究報道,KDM6A突變和缺失參與多種腫瘤的發生發展,包括食管癌、結腸癌、膀胱癌、多發性骨髓瘤[8-11]等。但KDM6A在急性髓系白血病中作用尚不清楚。本實驗分別通過過表達和敲減KDM6A基因,來觀察對急性髓系白血病細胞增殖、凋亡的影響。
1 材料與方法
1.1 材料和試劑
人組織細胞淋巴瘤細胞U937購自美國ATCC(貨號:DA-C5751)。BCA蛋白檢測試劑盒(貨號:23250)、MTT檢測試劑盒(貨號:4890-025-K)購自上海嶸崴達實業有限公司;Annexin Ⅴ-FITC/PI細胞凋亡檢測試劑盒(貨號:556547)及流式細胞儀購自美國BD公司;脂質體LipofectamineTM2000(貨號:11668027)購自美國Invitrogen;PrimeScriptTM RT reagent Kit with gDNA Eraser Kit(Perfect Real Time)(貨號:RR047AA)、SYBR Premix Ex TaqTM(Tli RNaseH Plus)(貨號:RR820A)購自日本TAKARA公司;GAPDH兔多抗購自美國Bioworld公司;兔抗人KDM6A(貨號:ab36938)、兔抗人H3K27me3(ab192985)、兔抗人Caspase-3(貨號:ab13748)購自美國Abcam;兔抗人c-Myc(貨號:MAB3696)、兔抗人Cyclin D1(貨號:MAB4314)、兔抗人Bcl-2(貨號:MAB8272)、兔抗人Bax(貨號:MAB846)購于美國R&DSYSTEMS;辣根過氧化物酶(HRP)標記的山羊抗兔二抗(貨號:sc2004)購自美國Santa Cruz公司。
二氧化碳恒溫細胞培養箱購自美國SHEL-LAB公司;酶聯免疫標記分析儀購自芬蘭雷勃Multiskan MK-3;倒置顯微鏡購自日本OLYMPUS公司;熒光定量PCR儀購自美國ABI公司。
1.2 方法
1.2.1 細胞培養與分組 取出凍存管,進行U937細胞復蘇,快速加入預熱的完全培養基中,細胞貼壁后,從培養箱取出細胞瓶進行換液,向培養瓶中加入適量的10%FBS RPMI-1640培養基置于CO2培養箱(37 ℃、5%CO2)中培養。一般隔兩天換液1次,待細胞長滿瓶壁85%左右進行細胞傳代。將細胞按實驗分5組:U937細胞組、sh-control組、sh-KDM6A組、pcDNA3.0組、pcDNA3.0-KDM6A組,其中sh-control組、sh-KDM6A組、pcDNA3.0組、pc-DNA3.0-KDM6A組細胞使用LipofectamineTM2000分別轉染慢病毒空載體、shKDM6A慢病毒載體、pcDNA3.0、pcDNA3.0-KDM6A過表達載體。
1.2.2 shKDM6A慢病毒載體包裝與穩轉U937細胞系建立 以1.6×106/瓶的密度接種U937細胞于T25細胞培養瓶;培養至細胞融合度40%左右,進行轉染LipofectamineTM2000 ∶質粒=2 ∶1;輕輕混勻,室溫靜置15 min;室溫靜置結束后滴加入T25細胞培養瓶中,37 ℃,5%CO2培養;6-8 h后更換為10%FBS RPMI-1640完全培養;48 h后收取上清中的慢病毒;以2×105個細胞/孔的密度接種U937細胞于6孔板;培養至細胞融合度30%-40%,棄去1 ml培養基,加入1 ml慢病毒感染細胞;48 h用含10 μg/ml嘌呤霉素10%FBS RPMI-1640完全培養基持續篩選;繼續使用含2 μg/ml嘌呤霉素RPMI-1640完全培養基篩選維持,待感染效果鑒定。
1.2.3 pcDNA3.0-KDM6A過表達載體構建 從NCBI獲取KDM6A基因cDNA序列(NM-001291415.2),設計引物送上海生工生物有限公司進行合成,以U937細胞cDNA為模板PCR擴增,切膠回收目的片段,經AgeⅠ和XhoⅠ雙酶切后,插入pcDNA3.0真核表達載體,經酶切、PCR和測序鑒定,構建pcDNA3.0-KDM6A真核表達載體,用于后續實驗。
1.2.4 MTT法檢測細胞增殖 根據實驗需求進行細胞培養,以1×105cell/ml接種于96孔板中,每孔100 μl,在培養48 h后,加入10 μl的MTT溶液,37 ℃繼續培養4 h。棄去孔內培養基,每孔加入150 μl DMSO震蕩混勻,用酶標儀檢測492 nm的OD值。細胞存活率=實驗組OD值/對照組OD值×100%。重復上述實驗3次。
1.2.5 流式細胞術檢測細胞凋亡 Annexin Ⅴ-FITC/PI凋亡檢測試劑盒用于檢測細胞凋亡。培養24 h后,按照試劑盒的說明書,分別在細胞中先添加FITC-AnnexinⅤ 5 μl再添加PI 5 μl,然后進行20 min室溫避光反應,并采用流式細胞術觀察計算。
1.2.6 qRT-PCR檢測KDM6A、c-Myc、Cyclin D1、Bcl-2、Bax、Caspase-3的mRNA表達水平 Trizol法進行RNA提取:靜置5 min使細胞完全裂解;每1 ml Trizol試劑加入200 μl氯仿;反轉錄所得cDNA存放-20 ℃。并通過SYBR Green試劑盒檢測KDM6A、c-Myc、Cyclin D1、Bcl-2、Bax、Caspase-3的mRNA表達水平。循環條件如下:95 ℃ 10 min,然后是94 ℃ 10 s,58 ℃ 25 s和72 ℃ 30 s,32個循環,然后72 ℃ 10 min。熒光定量引物見表1。

表1 實驗所用qRT-PCR引物
1.2.7 Western blot檢測KDM6A、H3K27me3、c-Myc、Cyclin D1、Bcl-2、Bax、Caspase-3蛋白表達水平 按照實驗分組處理細胞后48 h,收取細胞總蛋白。使用細胞刮刮取細胞至EP管中,高速離心,收集沉淀,加入蛋白裂解液進行裂解,BCA蛋白試劑盒測定蛋白濃度,99 ℃蛋白變性,10%SDS凝膠電泳分離蛋白,轉膜,5%脫脂奶粉封閉1 h,加入兔抗KDM6A(1 ∶500)、H3K27me3(1 ∶1 000)、c-Myc(1 ∶1 000)、Cyclin D1(1 ∶200)、Bcl-2(1 ∶500)、Bax(1 ∶1 000)、Caspase-3(1 ∶500),4 ℃冰箱孵育過夜,TBST洗滌后加入山羊抗兔二抗(1 ∶5 000)孵育1 h,ECL底物顯色。
1.3 統計學分析
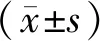
2 結果
2.1 qRT-PCR檢測KDM6A轉染效率
與U937細胞組相比,sh-control組、pcDNA3.0組中KDM6A mRNA水平差異無統計學意義(P>0.05);與sh-control組相比,sh-KDM6A組中KDM6A mRNA表達水平顯著下降,差異有統計學意義(P<0.05);與pcDNA3.0組相比,pcDNA3.0-KDM6A組中KDM6A mRNA表達水平顯著升高,差異有統計學意義(P<0.05,見表2)。

表2 不同處理組U937細胞中KDM6A mRNA的表達
2.2 敲減和過表達KDM6A對細胞存活率影響
與U937細胞組相比,sh-control組、pcDNA3.0組細胞存活率差異無統計學意義(P>0.05);與sh-control組相比,sh-KDM6A組細胞存活率明顯升高,差異有統計學意義(P<0.05);與pcDNA3.0組相比,pcDNA3.0-KDM6A組細胞存活率明顯降低,差異有統計學意義(P<0.05,見表3)。

表3 不同處理組對U937細胞增殖影響
2.3 敲減和過表達KDM6A對細胞凋亡影響
與U937細胞組相比,sh-control組、pcDNA3.0組細胞凋亡率差異無統計學意義(P>0.05);與sh-control組相比,sh-KDM6A組細胞凋亡率明顯降低,差異有統計學意義(P<0.05);與pcDNA3.0組相比,pcDNA3.0-KDM6A組細胞凋亡率明顯升高,差異有統計學意義(P<0.05,見表4、圖1)。

表4 不同處理組對U937細胞凋亡影響

圖1 不同處理對U937細胞凋亡的影響Figure 1 U937 cell apoptosis in different treatment groups
2.4 敲減和過表達KDM6A對細胞增殖、凋亡相關蛋白表達的影響
與U937細胞組相比,sh-control組、pcDNA3.0組H3K27me3、c-Myc、Cyclin D1、Bcl-2、Bax、Caspase-3蛋白表達水平差異無統計學意義(P>0.05);與sh-control組相比,sh-KDM6A組細胞Bax、Caspase-3蛋白表達水平明顯降低(P<0.05),H3K27me3、c-Myc、Cyclin D1、Bcl-2蛋白表達水平明顯升高(P<0.05);與pcDNA3.0組相比,pcDNA3.0-KDM6A組細胞Bax、Caspase-3蛋白表達水平明顯升高(P<0.05),H3K27me3、c-Myc、Cyclin D1、Bcl-2蛋白表達水平明顯降低(P<0.05,見表5、圖2)。

表5 不同處理組對細胞增殖、凋亡相關蛋白的影響
3 討論
AML是一種血液系統惡性腫瘤,嚴重危害著人類健康。在過去的50年,AML相關研究已經取得了很大的進步。傳統的白血病治療,藥效已經達到極限,療效很難再有提高。因此,尋找新的與AML發生密切相關的基因,篩選新靶點對于AML的治療有著重要的意義。
KDM6A,又名UTX,定位于人的Xp11.3-p11.23染色體區域[12],包含1個JmiC功能域和6個四肽重復結構域(TPR),JmiC結構域與組蛋白去甲基化有關。組蛋白甲基化修飾是表觀遺傳學中重要的調控機制之一,在基因的激活和抑制中發揮重要的作用,決定細胞的增殖、凋亡等多種生物學過程。KDM6A主要通過對組蛋白3賴氨酸27(H3K27)去甲基化或乙酰化的表觀遺傳學機制參與腫瘤的發生發展,已被證明參與多種腫瘤的發展。有研究報道,H3K27去甲基化酶KDM6A與KMT2B協同作用,通過調節H3K4me3在非小細胞肺癌(NSCLC)中發揮致癌作用[13]。在人類浸潤性乳腺癌中,KDM6A被認為是介導上皮-間質轉化(EMT)的重要因素[14,15]。KDM6A在肺癌細胞中對表皮-間質轉化的表觀遺傳調控[16]。以上研究結果表明,KDM6A在腫瘤中起到致癌的作用,但是也有研究表明,KDM6A在腫瘤研究過程中起到抑癌的作用,KDM6A的缺失是膀胱癌表型的驅動因素,KDM6A沉默促進了癌細胞生長和遷移[17]。在急性T淋巴細胞白血病的小鼠模型中,KDM6A通過調節許多具有腫瘤抑制功能的基因進而調節腫瘤的發生發展[18]。Li等[19]研究發現,沉默KDM6A使患者的生存時間縮短。在大腸癌中,KDM6A通過正向調節E-鈣黏蛋白抑制腫瘤細胞的侵襲[20]。根據胰腺癌基因組的公共數據庫分析,大約10.7%-21.6%的胰腺癌患者樣本中,KDM6A基因發生了突變[21]。KDM6A突變也存在于其他癌癥中,包括前列腺癌[22]、髓母細胞瘤[23]。在本研究中,KDM6A作為組蛋白去甲基化酶,控制著基因表達的激活和抑制,我們通過敲減KDM6A的細胞模型發現,KDM6A敲低后細胞存活率、H3K27me3、c-Myc、Cyclin D1、Bcl-2蛋白表達水平顯著升高,細胞凋亡率、Bax、Caspase-3蛋白表達水平顯著降低,其蛋白表達與對照組之間的差異存在統計學意義,H3K27me3被認為是KDM6A主要發揮去甲基化作用的對象,c-Myc和Cyclin D1蛋白被普遍認為與細胞的增殖相關,Bcl-2、Bax、Caspase-3蛋白被普遍認為與細胞的凋亡相關,這說明KDM6A可能發揮去甲基化作用降低H3K27me3水平,在AML的增殖、凋亡過程中起到重要的作用。我們通過轉染pcDNA3.0-KDM6A過表達質粒發現,細胞存活率、H3K27me3、c-Myc、Cyclin D1、Bcl-2蛋白表達水平顯著降低,而細胞凋亡率、Bax、Caspase-3蛋白表達水平顯著升高。這與我們的敲減結果完全相反。說明KDM6A在急性髓系白血病細胞中扮演著重要的角色。KDM6A在不同的腫瘤中發揮不同的作用,我們考慮可能是因為KDM6A在細胞內通過激活不同的抑癌基因或促癌基因從而導致了相反的結果,后續還需要對其分子機制進行相應研究。

1.U937細胞組;2.sh-control組;3.sh-KDM6A組;4.pcDNA3.0組;5.pcDNA3.0-KDM6A組圖2 不同處理組對細胞增殖、凋亡相關蛋白的影響Figure 2 Expression of cell proliferation-and apoptosis-associated proteins in different treatment groups by Western blot
本研究發現,過表達KDM6A可抑制急性髓系白血病細胞增殖、促進細胞的凋亡;敲減KDM6A能夠促進急性髓系白血病細胞增殖、抑制細胞凋亡。但是本研究只說明了KDM6A在AML的增殖及凋亡過程中發揮了重要的作用,其具體的分子機制及其對患者預后效果的影響還需進行進一步的探究。

