黃芪多糖對流感病毒性肺炎大鼠肺組織NLRP3信號通路的影響
沈欽華,李素娟,董蘇一
(武漢市東西湖區人民醫院藥劑科,武漢 430040;*通訊作者,E-mail:271057832@qq.com)
流感是一種急性病毒性呼吸系統疾病,嚴重時可引起肺炎甚至呼吸衰竭,在全球范圍內具有高發病率和高死亡率[1]。甲型流感病毒(IAV)感染是其主要致病因素,具有強烈的傳染性、快速的流行性和變異性[2]。目前臨床治療方法僅限于疫苗和一些抗病毒藥物,但是長期大量使用藥物具有較大的毒副性,還可增加病毒的抗藥性[3]。因此,開發高效、低毒的抗流感藥一直受到國內外醫學界的關注。近年來不少研究發現中藥在流感病毒的防治上發揮重要作用,黃芪是我國一味常用的傳統中藥,具有悠久的臨床應用歷史,黃芪多糖(astragalus polysaccharides,APS)是從黃芪中提取的一種水溶性雜多糖,具有多種藥理作用,包括調節免疫[4]、抗炎[5]、抗腫瘤[6]和抗病毒[7]等。研究發現APS對流感病毒感染的小鼠急性肺損傷具有保護作用,可降低肺組織的炎性反應,緩解肺炎性病理損傷[7,8];但其作用機制尚不完全明確。近來發現NOD樣受體蛋白3(NOD-like receptor protein 3,NLRP3)炎性小體與多種肺部炎癥疾病的發生和發展有著密切的聯系[9,10]。研究證實IAV可激活NLRP3炎癥小體并介導炎癥反應[11];而APS可抑制NLRP3炎性小體的激活,降低炎性介質IL-1β和IL-18的生成,在過敏性鼻炎、血管炎中減少炎癥的發生[12,13]。因此,本研究以流感病毒肺炎大鼠模型為對象,從NLRP3炎癥小體方面探究APS在流感病毒性肺炎治療中可能的作用機制。
1 材料與方法
1.1 實驗動物
6-8周齡SPF級Wistar大鼠40只,雌雄各半,體質量180-220 g,購自北京維通利華實驗動物技術有限公司,許可證為SCXK(京)2019-0009。將所有大鼠放在可控制的光照下保持12 h明暗交替,溫度22-24 ℃,相對濕度為45%-60%,可以自由獲取食物和水。研究已由機構動物護理和使用委員會批準,并遵循《實驗動物的護理和使用指南》。
1.2 病毒和細胞
甲型流感病毒A/FM1/47(H1N1)(中國疾病預防控制中心),將該病毒在Madin-Darby犬腎(MDCK)細胞(武漢普諾賽生命科技有限公司,CL-0154)中進行噬菌斑純化,并在9日齡的雞胚中復制。兩次常規雞胚復蘇后,血凝滴度為1 ∶40。通過雙重稀釋法測定了不同濃度的病毒感染后14 d大鼠的死亡率。使用引起20%大鼠死亡的病毒濃度(血凝滴度1 ∶640)進行感染實驗。
1.3 試劑及儀器
黃芪多糖(純度70%,上海吉至生化科技有限公司,貨號:C54200);大鼠白介素1β(IL-1β)(R0012c)、白介素18(IL-18)(R0567c)ELISA檢測試劑盒購買于武漢伊萊瑞特生物科技股份有限公司;HE染色試劑、RIPA裂解液和BCA試劑盒(碧云天生物科技公司,批號分別為C0105、P0013B、P0012S);TRIzol RNA分離試劑及SYBR?Premix Ex TaqTM試劑盒均購買于日本TaKaRa公司;PCR引物由上海Gene Pharma合成;兔抗NLRP3(ab263899)、β-actin(ab8227)、山羊抗兔IgG H&L(HRP)(ab205718)、山羊抗小鼠IgG H&L(HRP)(ab205719)均購自英國abcam公司;小鼠抗大鼠cleaved Caspase-1 P10(sc-56036)、cleaved Caspase-1 P20(sc-398715)均購自美國Santa Cruz公司。

1.4 方法
1.4.1 分組、造模及干預 大鼠適應性喂養3 d后開始實驗。將40只大鼠隨機分為對照組(control)、模型組(model)、黃芪多糖低劑量組(APS-L組,50 mg/kg)、黃芪多糖高劑量組(APS-H組,100 mg/kg)[12],每組10只。1%的戊巴比妥鈉(40 mg/kg)腹腔注射麻醉后,將大鼠腹部朝上放置,除對照組外,其余大鼠使用注射器將100 μl的流感病毒A/FM1/47懸浮液(血凝滴度1 ∶640)[3]交替滴入兩側鼻孔,建立病毒性肺炎模型,對照組滴入等量無菌生理鹽水。APS各劑量組在感染24 h后,灌胃給予相應劑量的黃芪多糖,對照組和模型組灌胃等量生理鹽水,1次/d,持續5 d。觀察大鼠一般狀態。
1.4.2 計算肺指數檢測肺水腫程度 肺指數用于反映肺水腫的嚴重程度。在測量體重后,將大鼠的肺取出,預冷的生理鹽水沖洗干凈后,濾紙吸干多余水分,然后稱量,計算大鼠肺指數。肺指數=肺質量/體質量×100%。
1.4.3 酶聯免疫吸附法(ELISA)檢測肺勻漿中炎性因子水平 將大鼠左肺分為兩部分,放入凍存管中,液氮速凍后,-80 ℃冰箱保存用于實時熒光定量PCR(qRT-PCR)和Western blot實驗;右肺分為兩部分,一部分固定于4%多聚甲醛中,另一部分右肺組織稱重后按照1 ∶9的比例加入預冷的生理鹽水制備10%的組織勻漿,研磨后離心取上清液,ELISA檢測勻漿中IL-1β、IL-18含量。
1.4.4 蘇木精-伊紅染色(HE)觀察肺組織病理學變化 取4%多聚甲醛中固定的肺組織,常規脫水,石蠟包埋,切片,HE染色。在顯微鏡下觀察肺組織病理學變化。
1.4.5 qRT-PCR檢測肺組織NLRP3 mRNA、IL-1β mRNA水平 取-80 ℃冰箱保存的部分左肺,稱重研磨后用Trizol法提取總RNA,測定每個樣本RNA濃度后,使用cDNA合成試劑盒將其逆轉錄為cDNA,進行PCR擴增。反應體系(20 μl):cDNA(200 ng/μl)2 μl,SYBR?Premix Ex TaqTM(2×)10 μl,上下游引物各0.4 μl,ddH2O 7.2 μl。反應條件:94 ℃預變性10 min,95 ℃變性15 s,60 ℃退火30 s,72 ℃延伸30 s,進行40個循環。采用2-ΔΔCt(ΔCt=目的基因Ct值-內參基因Ct值),以β-actin為對照,進行目的基因相對表達量分析。

表1 qRT-PCR引物序列
1.4.6 Western blot檢測肺組織NLRP3、cleaved Caspase-1蛋白表達 取剩余部分肺組織,按照試劑盒說明書的操作提取總蛋白,BCA法測定蛋白濃度,取等量蛋白質樣品(30 μg/孔)上樣,SDS-PAGE凝膠電泳,并轉移到聚偏二氟乙烯(PVDF)膜,5%脫脂奶粉封閉,加入一抗(NLRP3、cleaved Caspase-1 P10、cleaved Caspase-1 P20,按1 ∶1 000的比例稀釋;β-actin,1 ∶2 000稀釋),4 ℃下孵育過夜,HRP標記的山羊抗小鼠IgG二抗(1 ∶5 000)室溫孵育1 h,ECL顯色,以β-actin為內參,通過與內參的灰度比,得出目的條帶的相對表達水平。
1.5 統計學分析
2 結果
2.1 大鼠一般狀態
對照組大鼠較活躍,毛色光滑,飲食正常,無打噴嚏、咳嗽等癥狀;模型組大鼠活動減少、精神倦怠,毛色暗淡無光澤,呼吸淺快、氣喘、食欲不振;APS-L、APS-H組大鼠一般狀態較模型組明顯減輕,精神狀態、打噴嚏、氣喘癥狀明顯改善,活動和飲食增加。
2.2 各組大鼠肺指數
與對照組相比,模型組大鼠肺指數顯著增加(P<0.05);與模型組相比,APS-L、APS-H組大鼠肺指數明顯降低(P<0.05);與APS-L組相比,APS-H組肺指數明顯降低(P<0.05,見表2)。
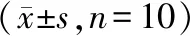
表2 各組大鼠肺指數變化比較
2.3 各組大鼠肺組織病理變化
HE染色結果顯示,對照組未發現肺組織學異常變化;模型組大鼠肺組織出現明顯病變,肺泡結構破壞,肺泡間隔增厚,炎性細胞浸潤,間質充血、水腫;與模型組相比,APS-L、APS-H組肺部的病理損傷明顯改善,且APS-H組肺部的病理損傷改善程度優于APS-L組(見圖1)。
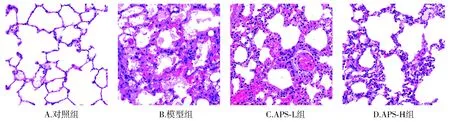
圖1 各組大鼠肺組織HE染色 (HE,×200)Figure 1 HE staining of lung tissue of rats in each group (HE,×200)
2.4 各組大鼠肺組織IL-1β、IL-18含量
與對照組相比,模型組大鼠肺組織IL-1β、IL-18含量顯著升高(P<0.05);與模型組相比,APS-L組和APS-H組大鼠肺組織IL-1β、IL-18含量明顯降低(P<0.05);與APS-L組相比,APS-H組大鼠肺組織IL-1β、IL-18含量明顯降低(P<0.05,見表3)。
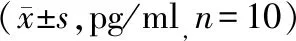
表3 各組大鼠肺組織IL-1β、IL-18含量
2.5 各組大鼠肺組織NLRP3 mRNA、IL-1β mRNA水平
與對照組相比,模型組大鼠肺組織NLRP3 mRNA、IL-1β mRNA水平顯著升高(P<0.05);與模型組相比,APS-L組和APS-H組大鼠肺組織NLRP3mRNA、IL-1β mRNA水平明顯降低(P<0.05);與APS-L組相比,APS-H組大鼠肺組織NLRP3 mRNA、IL-1β mRNA水平明顯降低(P<0.05,見表4)。
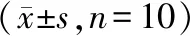
表4 各組大鼠肺組織NLRP3 mRNA、IL-1β mRNA水平
2.6 各組大鼠肺組織NLRP3、caspase-1蛋白表達
與對照組相比,模型組大鼠肺組織NLRP3、cleaved Caspase-1 P10、cleaved Caspase-1 P20蛋白表達顯著升高(P<0.05);與模型組相比,APS-L組和APS-H組大鼠肺組織NLRP3、cleaved Caspase-1 P10、cleaved Caspase-1 P20表達明顯降低(P<0.05);與APS-L組相比,APS-H組大鼠肺組織NLRP3、cleaved Caspase-1 P10、cleaved Caspase-1 P20表達明顯降低(P<0.05,見圖2、表5)。

圖2 各組大鼠肺組織NLRP3、cleaved Caspase-1蛋白表達Figure 2 expression of NLRP3 and cleaved Caspase-1 proteins in lung tissue of rats in each group
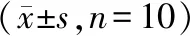
表5 各組大鼠肺組織NLRP3、cleaved Caspase-1蛋白表達
3 討論
流感病毒可以感染上、下呼吸道引起嚴重肺炎合并急性呼吸窘迫綜合征,甚至導致死亡[14]。IAV感染會導致組織損傷或觸發抗病毒細胞因子產生失衡,也稱為“細胞因子風暴”或“高細胞因子血癥”,這與IAV引起的嚴重肺炎聯系密切[15]。
黃芪是中藥中最重要的補氣調理中藥之一,可增強人體的免疫力,具有悠久的藥用歷史。最近研究發現黃芪在各種肺炎中具有重要治療作用,如在抗新型冠狀病毒肺炎(COVID-19)中黃芪是中藥復方中常用的高頻單味藥[16,17];APS是從中藥黃芪中提取的主要活性成分,已被廣泛用作免疫增強劑和抗氧化劑[18]。最近,一些研究表明APS可以抑制病毒的復制,包括季節性A型流感(H3N2)[19]、禽傳染性支氣管炎病毒(IBV)[20]、柯薩奇病毒B3(CVB3)[21]等,具有開發和用作抗病毒藥物的潛力。盧春化等[7,8]發現黃芪多糖能通過TLR4/7-MyD88-NF-κB信號通路緩解流感病毒誘導的小鼠肺炎性損傷,具有抗流感病毒感染的作用。本研究評估了APS對IAV感染大鼠的影響,結果表明APS可降低促炎性因子IL-18、IL-1β水平,緩解流感病毒感染引起的肺部炎癥和臨床癥狀,減輕大鼠肺部病變;說明APS可有效保護IAV感染大鼠免受進一步損害。
NLRP3炎性小體是由NLRP3蛋白、凋亡相關斑點樣蛋白(ASC)與前半胱天冬酶1(pro-caspase-1)形成的多蛋白復合物。其中,NLRP3蛋白是NLRP3炎性小體活性核心,它在許多細胞中都有表達類型,包括先天免疫[22]、人臍靜脈內皮細胞[23]、肺上皮細胞[24]等。NLRP3炎性小體過度活化在冠狀病毒SARS-COV-2引起多器官衰竭的發病機制中起主導作用,SARS-COV-2可以直接激活NLRP3,而NLRP3炎性小體被激活后,pro-caspase-1會進行自激活和裂解,以產生具有活性的cleaved Caspase-1(P10、P20),進而將pro-IL-1β和pro-IL-18分別裂解為成熟的IL-1β和IL-18,以及介導幾種生物活性的損傷相關分子模式分子(DAMP)的釋放,引發“細胞因子風暴”[25]。因此,NLRP3蛋白表達和IL-1β水平常被用于監測NLRP3炎性小體的活化。研究發現,甲型H1N1流感病毒引起的重癥肺炎中NLRP3炎性小體被顯著活化,而抑制NLRP3炎性小體的活化,可降低下游炎性細胞因子IL-1β和IL-18水平,可以減輕嚴重流感性肺炎引起的肺部病理損害[11]。何佳等[4]發現APS可下調ASC、cleaved Caspase-1的表達,抑制NLRP3炎性小體的活化;Xu等[12]也發現APS可通過抑制NLRP3炎性小體的激活,降低炎癥細胞因子水平,減輕過敏性鼻炎大鼠的鼻部癥狀和病理變化;以上研究均提示APS可抑制NLRP3炎性小體的活化。本研究通過qRT-PCR和Western blot檢測了IAV感染后,大鼠肺組織中NLRP3的mRNA和蛋白表達,結果均顯示,IAV感染后大鼠肺組織中NLRP3被激活,同時IL-1β mRNA水平和cleaved Caspase-1表達增加;而APS處理后,NLRP3的mRNA和蛋白表達下調,且IL-1β、IL-18水平及cleaved Caspase-1(P10、P20)蛋白表達明顯降低;說明APS在流感病毒感染后,可明顯抑制NLRP3炎癥小體的活化。
綜上所述,APS可能通過抑制NLRP3炎癥小體的活化,進而降低IL-1β、IL-18水平,減輕流感病毒感染引起的肺部炎性損傷。但本研究尚存在一定不足,NLRP3炎癥小體是通過什么途徑被激活,以及黃芪多糖能否通過其他通路保護流感病毒性肺炎,仍需進一步研究。

