纖溶酶原激活物抑制因子1在腹膜透析患者中的表達及其對腹膜纖維化的影響
蘇 瑞,梅春麗,李玉萍,李 銘,李 婷,趙 欣,盧家美,鄒曉榮*
(1中國人民解放軍空軍第九八六醫院腎臟病科,西安 710054;2中國人民解放軍空軍第九八六醫院內分泌科;3陜西省人民醫院特診科;4西安交通大學第二附屬醫院腎病內科;*通訊作者,E-mail:Zouxiaorong986@163.com)
腹膜透析(peritoneal dialysis,PD)是終末期腎病(end stage renal disease,ESRD)患者的一種有效的腎臟替代療法。然而,長期暴露于各種不利因素(如生物不相容的腹膜透析溶液、尿毒癥、腹膜炎和基礎慢性腎臟疾病),會導致腹膜結構的改變。這些變化包括間皮細胞的丟失、上皮-間充質轉化(epithelial-mesenchymal transition,EMT)的發生、血管生成的誘導等,從而引起腹膜纖維化和超濾功能下降,最終導致腹膜透析失敗。因此,尋求有效的防治腹膜纖維化的策略是非常重要的[1]。
EMT是上皮細胞失去其特有的上皮特性而獲得間充質細胞特性的過程。許多生長因子和細胞因子參與了這一過程。其中,轉化生長因子-β1(transforming growth factor-β,TGF-β1)已被證實在腹膜纖維化的發生發展中起主導作用[2-5]。TGF-β1通過激活Smad信號通路誘導腹膜纖維化[6]。此外,表皮生長因子受體(epidermal growth factor receptor,EGFR)的激活也參與了這些過程[6]。STAT3是重要的轉錄因子,STAT3被激活后參與腹膜纖維化過程[7]。
纖溶酶原激活物抑制劑1(plasminogen activator inhibitor 1,PAI-1)是絲氨酸蛋白酶抑制劑超家族的絲氨酸蛋白酶抑制劑,并且是尿激酶型纖溶酶原激活物和組織型纖溶酶原激活物(tissue-type plasminogen activator,tPA)的主要抑制劑[8-12],此外還進一步抑制下游基質金屬蛋白酶活化[13-15]。本課題組前期研究中發現,PAI-1參與調節細胞外基質(ECM)形成,牛蒡子苷元減輕腹膜透析中的纖維化的機制與抑制PAI-1的表達有關[16]。
目前,PAI-1在腹膜纖維化中的作用尚不清楚。本研究旨在揭示PAI-1在腹膜透析患者中的表達模式及其功能。
1 材料與方法
1.1 實驗材料
體質量為20-25g左右的C57/BL6小鼠由西安交通大學實驗動物中心提供[SYXK(陜)2020-005]。抗PAI-1、p-STAT3、STAT3、p-Smad3、Smad3、EGFR、p-EGFR、Acetyl α-tubulin和β-actin的抗體以及辣根過氧化物酶標記的二抗和生物素標記的二抗購自美國Cell Signaling Technologies公司。抗Collagen Ⅰ、E-cadherin和α-SMA抗體購自美國Santa Cruz Biotechnology公司。人腹膜間皮細胞(HPMCs)購自美國ATCC。DMEM高糖培養基購自美國Sigma-Aldrich公司。Opti-MEM培養液購自美國Gibco公司。TGF-β1購自派普泰克生物科技(蘇州)有限公司。靶向PAI-1的小干擾RNA(si-PAI-1)及陰性對照siRNA(si-NC)由上海吉瑪制藥技術有限公司合成。RIPA裂解液和蛋白提取試劑盒購自碧云天生物技術研究所。蘇木精伊紅(HE)染色和Masson三色染色試劑盒購自美國Sigma-Aldrich公司。
1.2 研究對象
納入2016年7月至2018年7月我院腹透中心長期規律隨訪的30例腹透患者(腹膜透析組)。患者年齡大于18歲且透析齡滿2年;排除患有腫瘤、感染性疾病、結締組織疾病、心腦血管等臟器衰竭者。收集記錄所有納入患者性別、年齡、基礎疾病、透析齡。另外,納入基線數據匹配的30例終末期腎病患者(終末期腎病組)。終末期腎病組患者是擬行腹膜透析管置管術者。均在手術中采集腹膜標本,大小約18 mm×3 mm,選取前腹壁新切開的壁層腹膜。本研究通過空軍軍醫大學第986醫院倫理委員會批準,所有入選患者均知情同意。
1.3 HPMCs細胞的處理和分組
人腹膜間皮細胞(HPMCs)在含有10%胎牛血清、1%青霉素和鏈霉素的DMEM高糖培養基中培養,培養環境為5% CO2、37 ℃。然后細胞做如下分組處理:①為了驗證TGF-β1對HPMCs中PAI-1蛋白表達的影響,將細胞分為正常對照組和TGF-β1組。正常對照組細胞正常培養,TGF-β1組細胞用10 ng/ml TGF-β1培養24 h,通過Western blot檢測HPMCs中PAI-1的蛋白表達。②為了下調PAI-1的表達,將細胞分為正常對照組、si-NC組和si-PAI-1組。正常對照組細胞不進行轉染,si-NC組和si-PAI-1組細胞分別用si-NC和si-PAI-1轉染,通過Western blot檢測HPMCs中PAI-1的蛋白表達。③為了考察PAI-1對TGF-β1誘導的HPMCs中EMT、TGF-β1/Smad3信號通路和EGFR/STAT3信號通路的影響,將細胞分為3組:正常對照組、TGF-β1+si-NC組和TGF-β1+si-PAI-1組。正常對照組細胞正常培養,TGF-β1+si-NC組和TGF-β1+si-PAI-1組細胞分別用si-PAI-1及si-NC轉染后,在0.5% FBS DMEM饑餓HPMCs 24 h,然后將其在10 ng/ml TGF-β1中培養24 h。通過Western blot檢測腹膜間皮細胞中PAI-1、p-STAT3、STAT3、p-Smad3、Smad3、Collagen Ⅰ、E-cadherin、α-SMA、EGFR、p-EGFR和Acetyl α-tubulin的蛋白表達。
1.4 HPMCs的si-PAI-1及si-NC轉染
將HPMCs接種于不含抗生素的30%-40%融合培養基中培養24 h,然后用lipofectamine 2000將si-PAI-1及si-NC(50 nmol/L)轉染HPMCs。轉染24 h后,再用TGF-β1(10 ng/ml)處理24 h,然后收集細胞進行實驗。
1.5 腹膜纖維化小鼠模型的建立及動物分組處理
小鼠每天腹腔注射3 ml含4.25%葡萄糖的腹膜透析液,連續注射28 d,建立腹膜纖維化模型[17]。將小鼠隨機分為3組,每組12只:正常對照組、腹膜纖維化+si-NC組(PF+si-NC組)和腹膜纖維化+si-PAI-1組(PF+si-PAI-1組)。正常對照組小鼠腹腔注射3 ml生理鹽水及300 μl Opti-MEM;PF+si-PAI-1組小鼠腹腔注射3 ml含4.25%葡萄糖的腹膜透析液及si-NC(0.1 mg/kg,溶于300 μl Opti-MEM);PF+si-PAI-1組小鼠腹腔注射3 ml含4.25%葡萄糖的腹膜透析液及si-PAI-1(0.1 mg/kg,溶于300 μl Opti-MEM)。28 d后處死所有小鼠,取壁層腹膜作進一步分析。
1.6 Western blot檢測蛋白的表達
將腹膜組織用勻漿器勻漿,然后在RIPA裂解液中裂解,并在15 000 r/min離心15 min,取上清。用蛋白提取試劑盒提取蛋白。用BCA測定試劑盒測蛋白質濃度。取150 μg蛋白煮沸變性,在12% SDS-PAGE凝膠上電泳并轉移到PVDF膜上。在5%的牛血清白蛋白中封閉1 h后,將PVDF膜與PAI-1、p-STAT3、STAT3、p-Smad3、Smad3、Collagen Ⅰ、E-cadherin、α-SMA、EGFR、p-EGFR、Acetyl α-tubulin和β-actin一抗(1 ∶2 000)在4 ℃孵育過夜。然后,將PVDF膜與辣根過氧化物酶標記的二抗在37 ℃下孵育1 h。使用ECL檢測試劑顯影,并使用Image J軟件計算條帶強度,β-actin作為內參。
1.7 小鼠腹膜組織的HE染色和Masson三色染色
將小鼠腹膜組織用4%多聚甲醛固定,石蠟包埋后切成4 μm厚切片。根據說明書對組織進行HE染色和Masson三色染色。然后置于顯微鏡下觀察(放大倍數為×200)。
1.8 免疫組織化學染色檢測患者和小鼠的腹膜切片中PAI-1、Collagen Ⅰ和α-SMA的表達
將患者和小鼠的腹膜切片脫蠟和水化后,用3% H2O2浸泡15 min,微波爐中加熱10 min。切片用山羊血清在37 ℃封閉30 min。將切片與一抗PAI-1、Collagen Ⅰ和α-SMA(1 ∶500稀釋)在4 ℃過夜孵育。然后與生物素標記的二抗在37 ℃孵育30 min,再與過氧化物酶試劑37 ℃孵育30 min,然后DAB在37 ℃孵育5 min。蘇木素復染核5 min。常規脫水、透明、封片后,用ImageJ軟件計算陽性細胞率。
1.9 統計學分析
使用SPSS19.0統計學軟件對數據進行分析,數據表示平均值±標準差,兩組間比較采用t檢驗,多組間比較采用單因素方差分析及LSD檢驗。P<0.05表示差異有統計學意義。
2 結果
2.1 腹膜透析患者和終末期腎病患者腹膜組織中PAI-1的表達
免疫組化染色顯示,與終末期腎病組比較,腹膜透析組腹膜組織中的PAI-1陽性率顯著升高(P<0.05,見圖1)。Western blot顯示,與終末期腎病組比較,腹膜透析組腹膜組織中的PAI-1蛋白相對表達量顯著升高(P<0.05,見圖1)。
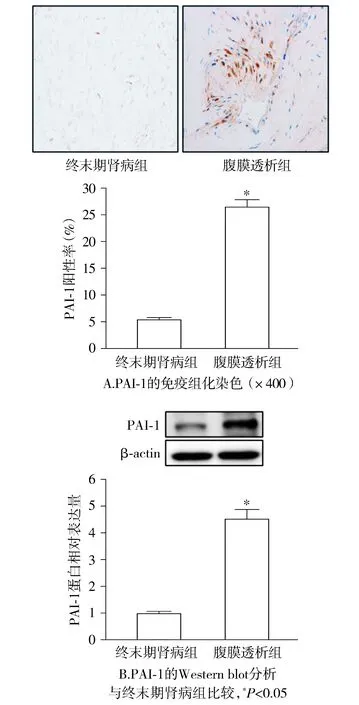
圖1 腹膜透析患者和終末期腎病患者腹膜組織中PAI-1的表達Figure 1 PAI-1 expression in peritoneal tissues of peritoneal dialysis patients and end-stage renal disease patients
2.2 PAI-1對TGF-β1誘導的腹膜間皮細胞EMT的影響
與正常對照組比較,TGF-β1組的腹膜間皮細胞中PAI-1蛋白相對表達量顯著升高(P<0.05,見圖2)。轉染si-PAI-1下調了腹膜間皮細胞中PAI-1的蛋白表達(P<0.05,見圖3)。
與正常對照組比較,TGF-β1+si-NC組腹膜間皮細胞中PAI-1、Collagen Ⅰ和α-SMA蛋白相對表達量顯著升高,E-cadherin顯著降低(P<0.05,見圖4)。與TGF-β1+si-NC組比較,TGF-β1+si-PAI-1組腹膜間皮細胞中PAI-1、Collagen Ⅰ和α-SMA蛋白相對表達量顯著降低,E-cadherin顯著升高(P<0.05,見圖4)。
2.3 PAI-1對TGF-β1誘導的腹膜間皮細胞中TGF-β1/Smad3信號通路的影響
與正常對照組比較,TGF-β1+si-NC組腹膜間皮細胞中p-Smad3蛋白相對表達量顯著升高(P<0.05),Acetyl α-tubulin顯著降低(P<0.05);與TGF-β1+si-NC組比較,TGF-β1+si-PAI-1組腹膜間皮細胞中p-Smad3蛋白相對表達量顯著降低(P<0.05),Acetyl α-tubulin顯著升高(P<0.05)。三組間Smad3蛋白相對表達量差異無統計學意義(P>0.05,見圖5)。
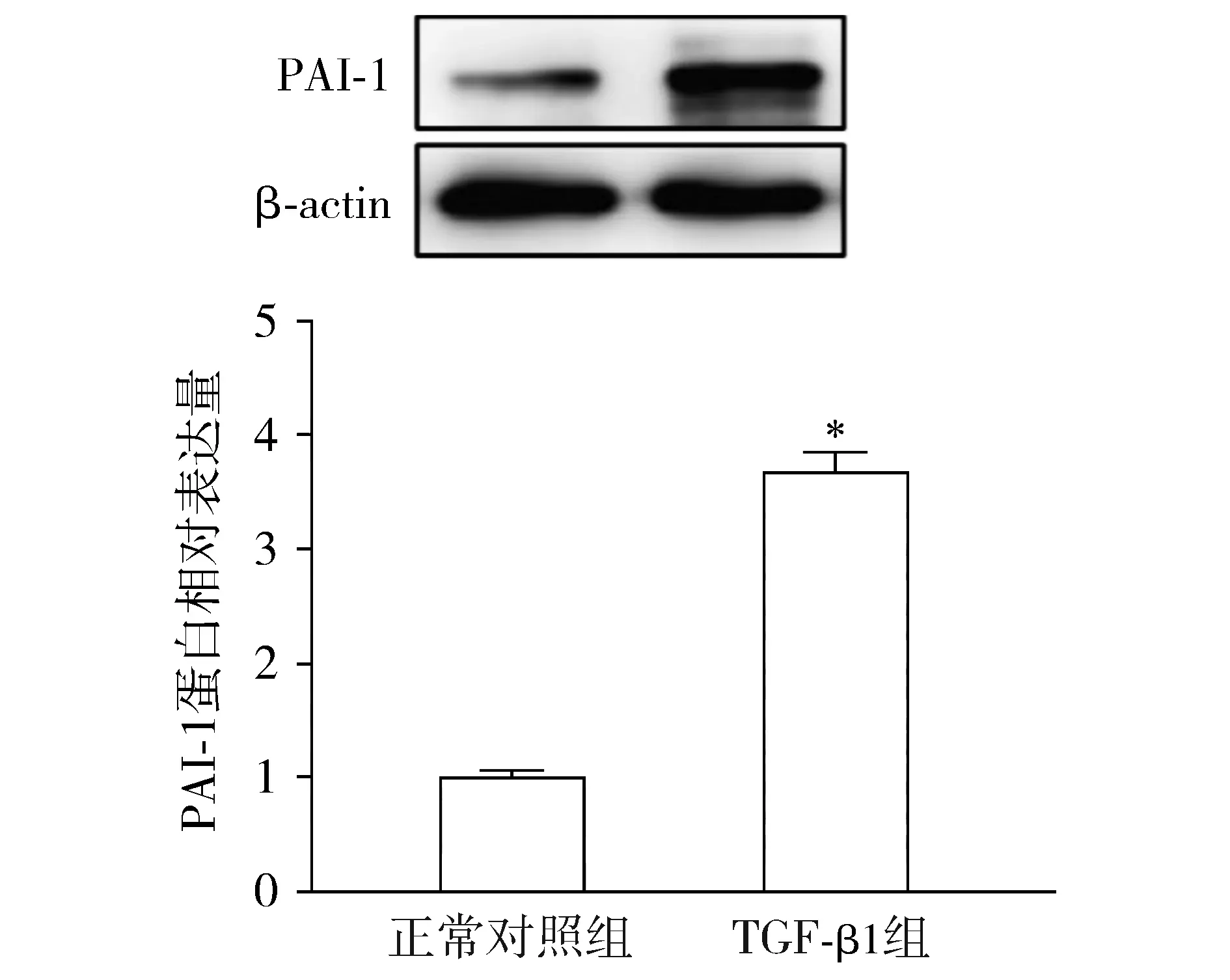
與正常對照組比較,*P<0.05圖2 TGF-β1對腹膜間皮細胞中PAI-1蛋白表達的影響Figure 2 The effect of TGF-β1 on the expression of PAI-1 protein in peritoneal mesothelial cells
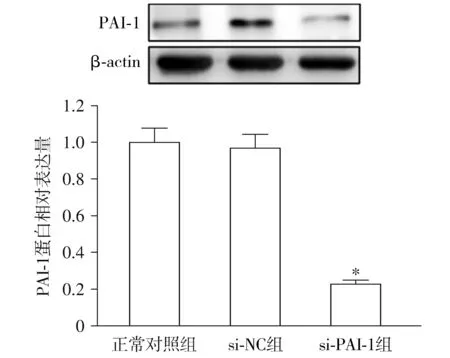
與正常對照組比較,*P<0.05圖3 腹膜間皮細胞中si-PAI-1的轉染效率Figure 3 Transfection efficacy of si-PAI-1 in peritoneal mesothelial cells
2.4 PAI-1對TGF-β1誘導的腹膜間皮細胞中EGFR/STAT3信號通路的影響
與正常對照組比較,TGF-β1+si-NC組腹膜間皮細胞中p-EGFR和p-STAT3蛋白相對表達量顯著升高(P<0.05);與TGF-β1+si-NC組比較,TGF-β1+si-PAI-1組腹膜間皮細胞中p-EGFR和p-STAT3蛋白相對表達量顯著降低(P<0.05)。三組間EGFR和STAT3蛋白相對表達量差異無統計學意義(P>0.05,見圖6)。

與正常對照組比較,*P<0.05;與TGF-β1+si-NC組比較,#P<0.05圖4 PAI-1對TGF-β1誘導的腹膜間皮細胞中PAI-1、Collagen Ⅰ、E-cadherin和α-SMA蛋白表達的影響Figure 4 The effects of PAI-1 on the expression of PAI-1, Collagen Ⅰ, E-cadherin and α-SMA protein in peritoneal mesothelial cells induced by TGF-β1
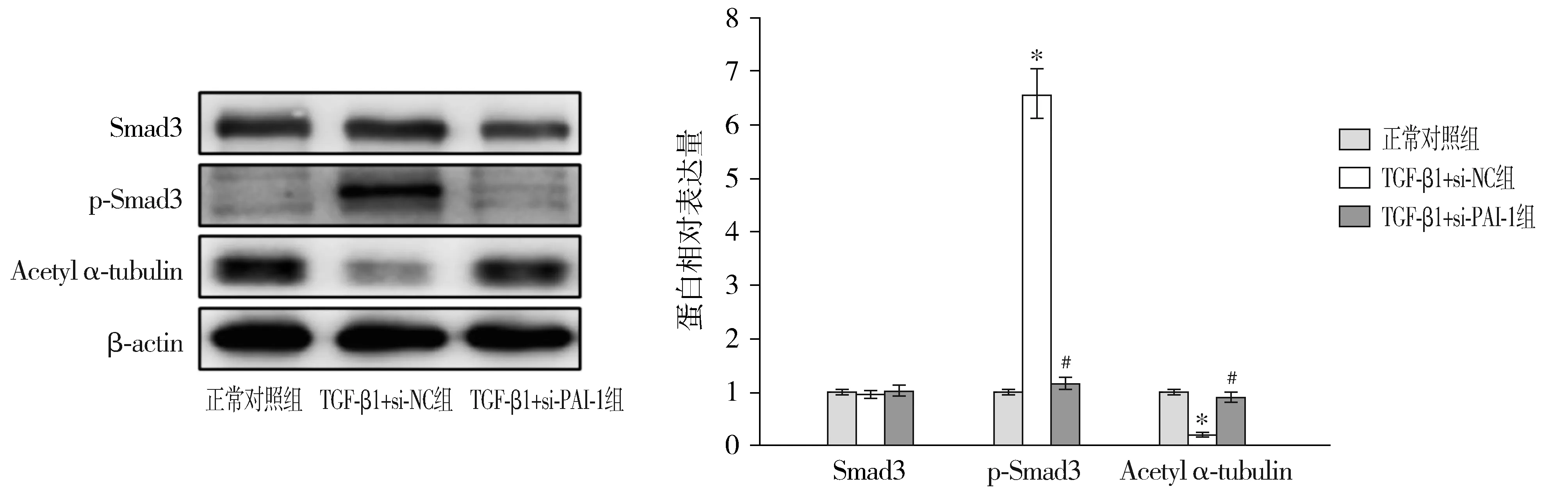
與正常對照組比較,*P<0.05;與TGF-β1+si-NC組比較,#P<0.05圖5 PAI-1對TGF-β1誘導的腹膜間皮細胞中TGF-β1/Smad3信號通路的影響Figure 5 The effects of PAI-1 on the TGF-β1/Smad3 signaling pathway in peritoneal mesothelial cells induced by TGF-β1
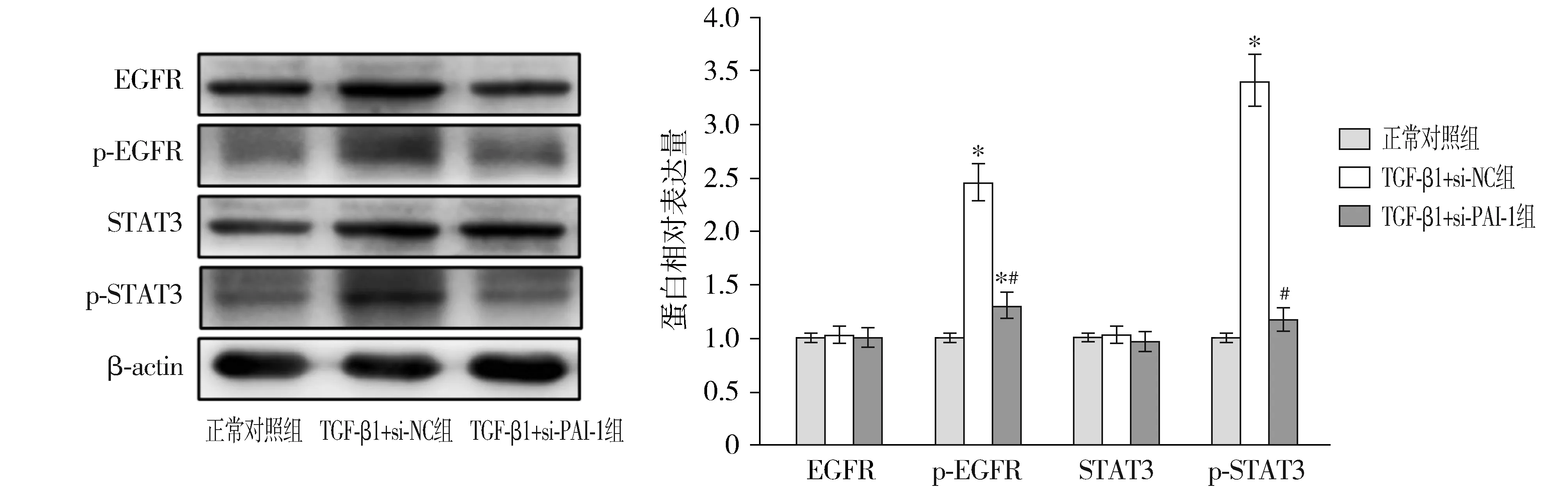
與正常對照組比較,*P<0.05;與TGF-β1+si-NC組比較,#P<0.05圖6 PAI-1對TGF-β1誘導的腹膜間皮細胞中EGFR/STAT3信號通路的影響Figure 6 The effects of PAI-1 on the EGFR/STAT3 signaling pathway in peritoneal mesothelial cells induced by TGF-β1
2.5 PAI-1對高糖透析液誘導的腹膜纖維化小鼠腹膜纖維化的影響
HE染色和Masson三色染色結果顯示,與正常對照組比較,PE+si-NC組腹膜組織厚度、炎性細胞浸潤和ECM沉積明顯增加;與PE+si-NC組比較,PE+si-PAI-1組的上述病理變化明顯減輕(見圖7)。
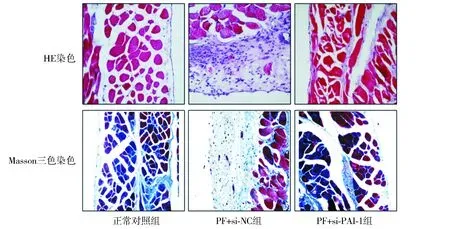
圖7 小鼠腹膜組織的HE染色和Masson三色染色 (×200)Figure 7 HE staining and Masson trichrome staining of mouse peritoneal tissue (×200)
免疫組化染色結果顯示,與正常對照組比較,PE+si-NC組腹膜組織的E-cadherin陽性率顯著降低,α-SMA顯著增加(P<0.05,見圖7);與PE+si-NC組比較,PE+si-PAI-1組腹膜組織的E-cadherin陽性率顯著增加,α-SMA顯著降低(P<0.05,見圖8)。
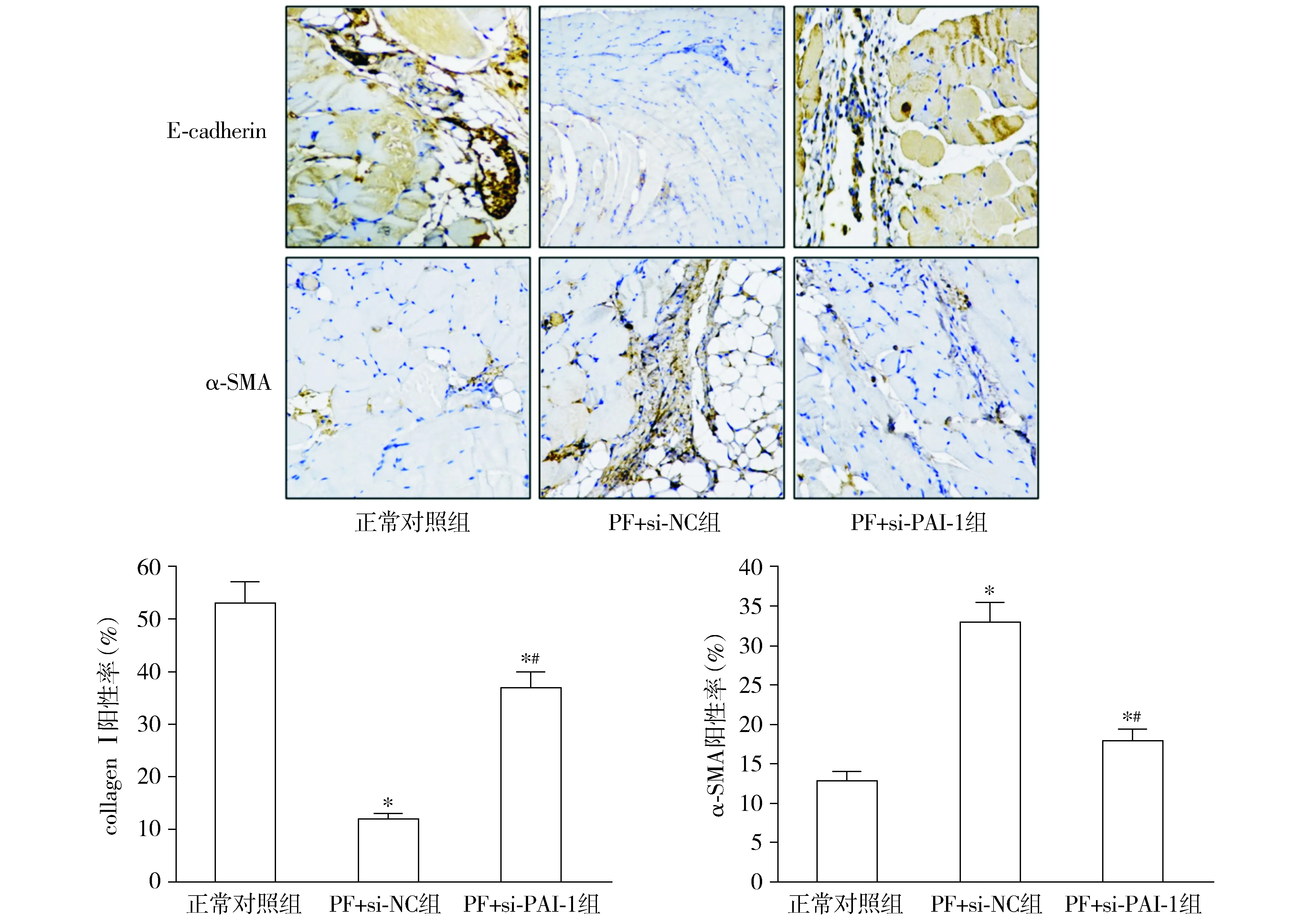
與正常對照組比較,*P<0.05;與PE+si-NC組比較,#P<0.05圖8 小鼠腹膜組織E-cadherin和α-SMA的免疫組化染色 (×200)Figure 8 Immunohistochemical staining of E-cadherin and α-SMA in mouse peritoneal tissue (×200)
3 討論
多項研究報道了PAI-1在肺、肝、腎、心臟和血管纖維化中的作用。PAI-1的表達在人纖維化肺和博來霉素誘導的小鼠肺中均升高[18]。PAI-1對肺纖維化的刺激作用的一個可信的解釋是,它通過抑制纖溶酶的生成,進而促進過量的纖維蛋白積累。Bergheim等[19]報道,PAI-1缺陷型小鼠的膽管結扎引起的早期肝損傷和炎癥明顯減弱。Wang等[20]證明,與野生型小鼠相比,PAI-1缺陷型小鼠肝臟纖維化減少,tPA和MMP9活性增加。PAI-1在正常腎臟中低水平表達,但在幾種急性和慢性腎臟疾病中均高水平表達[21]。PAI-1被證明可以通過減少間質性成肌纖維細胞和巨噬細胞的數量來預防單側輸尿管梗阻介導的腎纖維化[22]。PAI-1缺乏也會減弱腎臟中的間質膠原沉積[23]。以前的研究已經證明,心肌梗死后心肌細胞中PAI-1表達的增加有助于心肌纖維化的進展。在心肌梗死模型中,PAI-1缺乏與較少的心臟纖維化有關[24]。然而,目前缺乏PAI-1在腹膜透析相關腹膜纖維化方面的研究。
腹膜纖維化是長期腹膜透析患者發生的主要并發癥之一,其特點是肌成纖維細胞數量增加和間質ECM沉積。大多數體外和體內研究都支持受損的間皮細胞是肌成纖維細胞的來源。在腹膜纖維化過程中,大約17%的肌成纖維細胞來源于間皮細胞,受損的間皮細胞獲得了產生多種細胞因子和生長因子的能力,這些因子可以刺激常駐成纖維細胞的激活和增殖,從而產生更多的ECM蛋白,促進腹膜纖維化的發展[25]。抑制EMT或局部成纖維細胞向肌成纖維細胞分化可能會減緩腎纖維化的發展,因為間皮細胞和肌成纖維細胞都能產生Collagen Ⅰ,Collagen Ⅰ是ECM的主要成分,本研究結果表明與未進行腹膜透析的患者相比,腹膜透析后PAI-1被激活。PAI-1的激活在腹膜間皮細胞的EMT和成纖維細胞向肌成纖維細胞的分化過程中起著至關重要的作用。通過轉染siRNA沉默PAI-1后,TGF-β1誘導的間皮細胞中E-cadherin(上皮細胞標志物)明顯下調,而α-SMA和Collagen Ⅰ(間質細胞的標志)明顯上調,從而抑制了EMT過程及隨后的纖維化。
本研究結果顯示,下調PAI-1可顯著抑制TGF-β1誘導的間皮細胞Smad-3的磷酸化,通過阻斷TGF-β1/Smad信號通路來預防腹膜纖維化。目前,PAI-1如何促進TGF-β1/Smad信號的激活仍不清楚。以前的研究表明,腹膜損傷是由Smad-3依賴機制介導的[26]。Smads與微管的結合使Smads處于非活躍期,TGF-β1可以觸發Smads從微管釋放并隨后磷酸化[27]。因此,PAI-1對Acetyl α-tubulin的脫乙酰化可能改變微管功能,影響Smad磷酸化。本研究中PAI-1對Acetyl α-tubulin的上調也證實了這一推論。
間皮細胞可能通過產生EGF和CTGF促進腹膜纖維化。這些生長因子以旁分泌方式靶向間皮,誘導成纖維細胞增殖和肌成纖維細胞轉化[28]。抑制PAI-1也可能通過靶向EGFR信號轉導而減輕腹膜纖維化。最近的研究表明,EGFR是腎和腹膜纖維化的關鍵介質[6]。在本研究中,抑制PAI-1導致培養的間皮細胞中EGFR的磷酸化水平降低。抑制PAI-1也降低了EGFR下游分子STAT3的磷酸化。其他人的研究已經證明EGFR/STAT3通路的激活與腹膜纖維化的進展有關[29]。另外,本研究證明了下調PAI-1抑制了STAT3的磷酸化,這個轉錄因子對各種炎性細胞因子/趨化因子的表達和產生至關重要[30]。腹膜纖維化炎癥的特征是細胞因子/趨化因子的大量表達和巨噬細胞的浸潤[31]。PAI-1可能通過調節關鍵轉錄因子來調控這些細胞因子/趨化因子的表達,從而減輕纖維化。
綜上所述,本研究首次在體內外研究中證明了下調PAI-1可抑制腹膜纖維化的發展,推測這種抗纖維化機制可能與TGF-β1/Smad3和EGFR/STAT3信號通路的失活有關。然而,在接下來的研究中還需要進行信號通路的阻斷/增強實驗來驗證這一推論。總之,PAI-1可能是預防和治療腹膜纖維化的潛在靶標。

