草地貪夜蛾魚尼丁受體與雙酰胺類殺蟲劑的結合模式及抗性風險分析
李 康, 王凱博, 陶麗紅, 李 麗, 李佳俊,吳文偉, 肖 春*,, 葉 敏*,
(1. 云南農業(yè)大學 云南生物資源保護與利用國家重點實驗室,昆明 650201;2. 云南省農業(yè)科學院 農業(yè)環(huán)境資源研究所,昆明 650201)
草地貪夜蛾Spodoptera frugiperda(以下簡稱FAW),屬于鱗翅目、夜蛾科、灰翅夜蛾屬,原產于美洲熱帶和亞熱帶地區(qū),廣泛分布于美洲大陸[1]。2019 年1 月11 日首次在中國云南省江城縣發(fā)現(xiàn)FAW 幼蟲[2],其主要為害玉米、水稻、高粱和甘蔗等糧食作物的芯葉及果穗,造成農作物產量減少和品質下降[3]。化學農藥是防治FAW 的重要措施。除蟲脲 (diflubenzuron)、茚蟲威 (indoxacarb) 以及氯蟲苯甲酰胺 (chlorantraniliprole)、氟苯蟲酰胺 (flubendiamide) 等雙酰胺類殺蟲劑是中國防治FAW 的推薦用藥,在FAW 的防治中發(fā)揮了重要作用[4]。
目前,殺蟲劑抗性行動委員會 (Insecticide Resistance Action Committee, IRAC) 分類的雙酰胺類殺蟲劑共有5 個品種:氯蟲苯甲酰胺、氟苯蟲酰胺、溴氰蟲酰胺 (cyantraniliprole)、環(huán)溴蟲酰胺(cyclaniliprole) 和四唑蟲酰胺 (tetraniliprole)[5]。氯蟲苯甲酰胺、氟苯蟲酰胺、溴氰蟲酰胺等雙酰胺類殺蟲劑具有殺蟲廣譜、內吸性好、高選擇性及對刺吸式口器害蟲防效優(yōu)異等特點[6-8],且主要作用鱗翅目和鞘翅目昆蟲魚尼丁受體 (ryanodine receptor,RyR),其激活RyR 導致鈣離子釋放,破壞昆蟲體內鈣離子平衡,從而影響昆蟲的神經肌肉功能[9]。RyR 是一種分布于動物肌細胞內質網和肌漿網上的鈣離子通道蛋白,由4 個相同的亞基構成的同源四聚體,每個亞基含有約5 000 個氨基酸殘基,是目前已發(fā)現(xiàn)的最大的離子通道型蛋白[10]。以RyR 為靶標開發(fā)的氟苯蟲酰胺和氯蟲苯甲酰胺等雙酰胺類殺蟲劑對小菜蛾Plutella xylostella(以下簡稱DBM)、斜紋夜蛾Spodoptera litura等鱗翅目昆蟲均具有較高的毒性,對哺乳動物則低毒、安全。但是,隨著雙酰胺類殺蟲劑的大量使用,其抗藥性問題也日益突出[11-14]。
目前,研究鱗翅目害蟲對雙酰胺類殺蟲劑的抗性多以DBM 為模式害蟲。DBM 對雙酰胺類殺蟲劑已產生了高水平抗性:Guo 等對從廣東不同地區(qū)采集的4 個DBM 種群進行檢測發(fā)現(xiàn),其對氯蟲苯甲酰胺的抗性水平達303~658 倍[11];據Troczka 報道,泰國DBM 田間種群對氯蟲苯甲酰胺和氟苯蟲酰胺的抗性分別高于200 倍和750 倍,菲律賓DBM 田間種群對氯蟲苯甲酰胺和氟苯蟲酰胺的抗性分別超過4 100 倍和1 300 倍[12]。另外,F(xiàn)AW 對雙酰胺類殺蟲劑也易產生抗性:2018 年在美國波多黎各田間發(fā)現(xiàn),F(xiàn)AW 種群對氟苯蟲酰胺產生了500 倍抗性,對氯蟲苯甲酰胺產生了160 倍抗性[13];Bolzan 等發(fā)現(xiàn),室內篩選所得抗氯蟲苯甲酰胺FAW 種群與溴氰蟲酰胺存在低水平交互抗性 (27 倍),而對氟苯蟲酰胺則存在高達42 000 倍的交互抗性[15]。目前,DBM 對雙酰胺類殺蟲劑的抗藥性機制較為明確:Troczka 在泰國和菲律賓的DBM 抗性種群中檢測到RyR 的G4946E 突變,通過Sf9 體外表達研究證實了G4946E突變可影響雙酰胺類殺蟲劑與RyR的結合[12];Steinbach 等進一步強調了DBMRyR的G4946E 突變是導致其對雙酰胺類殺蟲劑產生抗性的主要機制[16];郭磊等在云南采集的抗性種群中篩查得到了新的突變位點E1338D、Q4594L和I4790M,并通過熒光配體結合實驗驗證了含多個突變的DBMRyR 與氯蟲苯甲酰胺的親和力顯著減弱[11,17-18]。其他鱗翅目害蟲中:甜菜夜蛾Spodoptera exigua的抗性種群對氯蟲苯甲酰胺的抗性在150 倍以上,通過對其RyR 跨膜區(qū)域進行測序發(fā)現(xiàn),抗性種群的主要突變?yōu)镮4743M,但未檢測到G4900E 等位基因突變[14];二化螟Chilo suppressalisRyR 的G4910E 和I4758M的突變也會導致其對雙酰胺類殺蟲劑產生不同程度的抗性[19-20]。
FAW 對雙酰胺類殺蟲劑的抗性機制相關研究較少。在現(xiàn)有報道中,Boaventura 對田間采集的FAW 種群進行抗藥性誘導,與敏感種群相比,其對氯蟲苯甲酰胺和氟苯蟲酰胺的抗性分別為225 倍和5 400 倍。通過對FAWRyR 的C-末端結構域Ⅱ~Ⅵ進行測序,發(fā)現(xiàn)了一個單核苷酸多態(tài)性,導致I4734M 突變,因此被認為是對雙酰胺類殺蟲劑產生抗性的靶點[21]。在有關DBMRyR 已報道的突變位點中,G4946E 和I4790M 頻率最高,其中G4946 對應FAWRyR 中的G4891 氨基酸,I4790 對應FAWRyR 中的I4734 氨基酸。FAWRyR中的I4734 與DBMRyR 的I4790 突變報道一致,但尚未見有關FAWRyR 中的G4891 氨基酸突變引起抗藥性的報道。FAWRyR 的G4891 和I4734 氨基酸突變是否是造成其對雙酰胺類殺蟲劑產生抗性的原因仍需探索。
隨著計算機模擬技術的發(fā)展,分子對接、同源建模等技術手段日趨成熟。通過計算機預測受體與配體之間的結合模式為研究靶標害蟲對殺蟲劑的抗性機制提供了新的方法[22]。蛋白質的三維結構由氨基酸序列確定,由于蛋白質的同源性,可以根據已知的蛋白質三維結構預測未知結構的同源蛋白質的初步結構[23]。目前,F(xiàn)AW 和DBM的RyR 結構尚未被解析,但兔子Oryctolagus cuniculus、野豬Sus scrofa等哺乳動物的RyR 的結構解析已較為成熟,且兔子RyR 與氯蟲苯甲酰胺結合的結構已被解析 (PDB:7CF9):氯蟲苯甲酰胺主要與兔子RyR 蛋白C 端跨膜區(qū)域中S0-S4構成的活性口袋結合[24]。FAWRyR (序列號:QCQ29110.1)[21]與DBMRyR (序列號:AET09964.1)[25]的氨基酸序列已知,可通過同源建模的方法獲得其三維模型及分子對接的方法分析親和構象。
因此,本研究擬通過同源建模的方法構建DBMRyR 和FAWRyR 跨膜區(qū)域的三維模型,通過在FAWRyR 中引入已報道的DBMRyR 的突變位點 (G4946E,對應FAWRyR 中G4891) 和FAWRyR的突變位點 (I4734M),構建FAWRyR 的突變模型;通過分子對接的方法研究FAWRyR 突變前后與雙酰胺類殺蟲劑的結合模式,分析FAWRyR 突變位點與抗藥性的關系。本研究從結構生物學角度探究FAW 抗雙酰胺類殺蟲劑的機理,旨在為研究FAW 對雙酰胺類殺蟲劑的抗性奠定理論基礎。
1 材料與方法
1.1 計算機軟件與在線工具
1.1.1 軟件 Open Babel-2.4.1[26]、UCSF Chimera-1.11.2[27]、Pymol-2.1.0[28]、Autodock Tool-1.5.6[29]和Autodock Vina-1.1.2[30]。
1.1.2 在線工具
同源建模在線工具SWISS-MODEL[31]:https://swissmodel.expasy.org/。
蛋白質質量評價工具SAVEs:https://servicesn.mbi.ucla.edu/SAVES/。
蛋白質晶體結構PDB 數(shù)據庫:http://www1.rcsb.org/。
NCBI 數(shù)據庫:https://www.ncbi.nlm.nih.gov/。
跨膜區(qū)域預測工具TMHMM[32]:http://www.cbs.dtu.dk/services/TMHMM/。
作用力分析工具PLIP[33]:https://projects.biotec.tu-dresden.de/plip-web/plip。
保守性分析在線工具MEME[34]:(https://memesuite.org/meme/)。
1.2 試驗方法
1.2.1 同源建模及模型評價 從NCBI 數(shù)據庫中下載DBMRyR 氨基酸序列 (序列號:AET09964.1)和FAWRyR 氨基酸序列 (序列號:QCQ29110.1),通過TMHMM 分別預測DBMRyR 和FAWRyR 的跨膜區(qū)域。通過同源建模方法構建FAWRyR (未突變,WT) 蛋白三維模型:選擇FAWRyR 跨膜區(qū)域 (S1-S6) 的氨基酸序列,以Ma 等報道的與FAWRyR氨基酸序列同源度為61.8%的兔子RyR 冷凍電鏡結構 (PDB:7CF9)[24]的跨膜區(qū)域為模板,用SWISS-MODEL 工具構建FAWRyR 跨膜區(qū)域 (S1-S6) 的模型;選擇FAWRyR 跨膜區(qū)域 (S0) 的氨基酸序列,通過SWISS-MODEL 進行序列對比分析,以PDB:1p7b.1.A 為模板構建FAWRyR 跨膜區(qū)域S0 的模型。使用Pymol-2.1.0 和UCSF Chimera-1.11.2 軟件對在線夠建的模型進行拼合、優(yōu)化,構建出WT FAWRyR 的四聚體結構。DBMRyR 跨膜區(qū)域模型的構建方法亦如此。
使用SAVEs 的Procheck[35]工具,驗證所建模型在立體化學上的合理性及能量上的穩(wěn)定性。各殘基間的Pis 和Phi 兩個角度的合理性評價結果以拉氏圖 (Ramachandran Plot) 展示。根據拉氏圖中最優(yōu)區(qū)域、額外允許區(qū)域、一般允許區(qū)域等的百分比評價所建蛋白質模型是否合理[35]。
1.2.2 FAWRyR 突變體構建 將已報道的DBMRyR 的突變位點G4946E、I4790M,以及甜菜夜蛾S. exiguaRyR 的G4900E、I4743M[14],二化螟C. suppressalisRyR 的G4910E、I4758M[19-20]與FAWRyR 氨基酸序列進行對比,結果表明其分別對應FAWRyR的G4891E 和I4734M,其中I4734M 為已報道的FAWRyR 突變位點[21]。故本研究使用UCSF Chimera-1.11.2 軟件分別將FAWRyR中G4891 的“Gly”突變?yōu)椤癎lu”、I4734 的“Ile”突變?yōu)椤癕et”,構建突變模型FAWRyR-E4891 和FAWRyR-M4734。將WT FAWRyR、FAWRyRE4891 及FAWRyR-M4734 的模型分別用Autodock Tool-1.5.6 進行能量最小化和去水加氫等處理,作為分子對接受體。
1.2.3 配體構建 從IRAC 查詢雙酰胺類殺蟲劑:氯蟲苯甲酰胺、氟苯蟲酰胺、溴氰蟲酰胺、環(huán)溴蟲酰胺和四唑蟲酰胺的化學結構,使用Open Babel-2.4.1 軟件獲得化學結構的3D 結構,利用Autodock Tool-1.5.6 進行能量最小化等處理,作為分子對接配體。
1.2.4 分子對接及結合模式分析
1.2.4.1 分子對接 根據已報道的兔子RyR 與氯蟲苯甲酰胺復合晶體結構的結合位點,通過蛋白質模型疊合預測所建模型的活性口袋位置,并構建Docking-Box (圖1)。FAWRyRs 對接所用Box 參數(shù)為:center-x = 252.259,center-y =207.152,center-z = 299.459;size-x = 22.0,size-y =18.0,size-z = 18.0。
將1.2.1 節(jié)和1.2.2 節(jié)中處理好的蛋白質受體與1.2.3 節(jié)中準備好的配體使用Autodock Vina-1.1.2 軟件進行對接,計算平臺HP-PC:Inter Corei5-1035G1CPU@3.6 GHz;對接參數(shù)為:exhaustive ness = 8,numb-modes = 9,energyrange = 3,對接結果按結合親和力打分排序。
1.2.4.2 結合模式分析 分別選擇5 種配體的最優(yōu)構象,構建其與受體的復合物,利用PLIP 在線工具分析配體與受體之間的氫鍵、鹵鍵、疏水作用、π-π 相互作用及π-陽離子作用等非共價相互作用力,使用Pymol-2.1.0 繪制結合模式圖。
1.2.5 基因序列保守性分析 將FAWRyR 跨膜區(qū)域的蛋白質序列作為查詢序列,在NCBI 中使用BLASTP 查詢相關同源蛋白。最終得到100 條與FAWRyR 同源的蛋白氨基酸序列,且主要以鱗翅目昆蟲為主 (表1)。將這100 條RyR 氨基酸序列用MEME (https://meme-suite.org/meme/) 工具計算分析,獲得Motif 圖,并進行保守性分析。
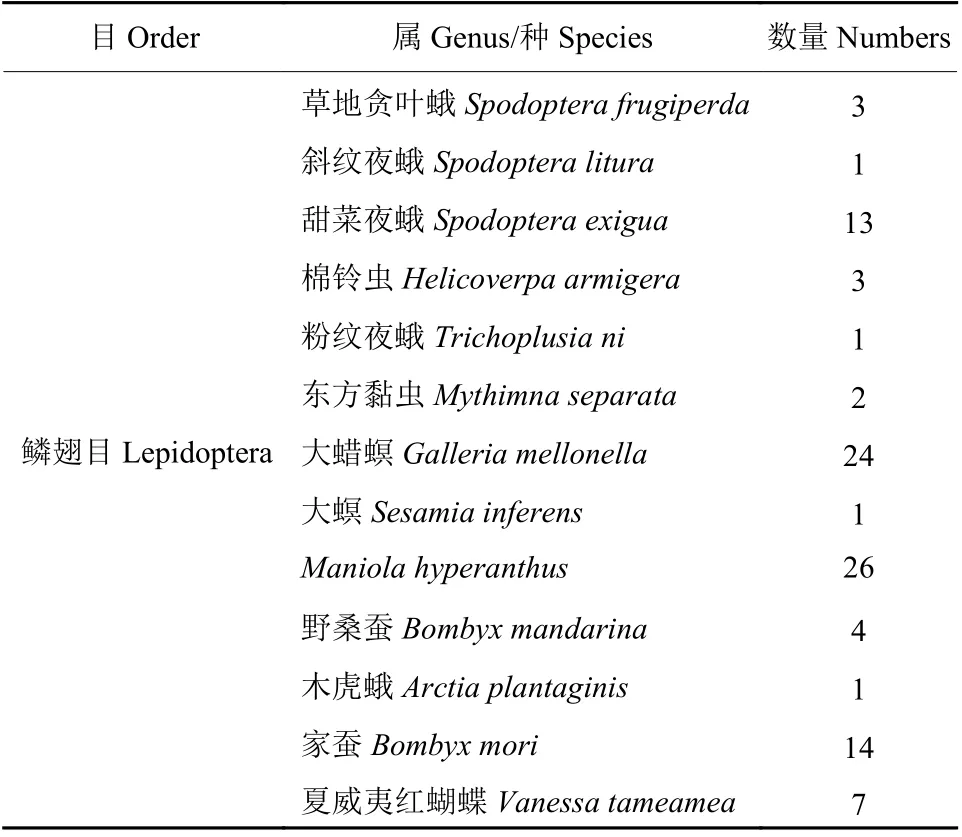
表1 與FAWRyR 跨膜區(qū)域氨基酸序列具有同源的昆蟲基因數(shù)量Table 1 The number of insect genes with homologous amino acid sequences with FAWRyR of transmembrane region
2 結果與分析
2.1 同源建模結果及評價
根據DBMRyR 和FAWRyR 的氨基酸序列,分別以PDB:7CF9 的跨膜區(qū)域為模板,構建的跨膜區(qū)域S1-S6;以同源較高的PDB:1p7b.1.A 為模板,在線構建的跨膜區(qū)域S0,拼合后所得最終RyR 四聚體結構如圖2a、2d 所示。由圖2a、2d 可知:FAW 和DBM 的RyR 的四個亞基呈軸對稱分布,每個亞基的氨基酸序列相同,中間有一由親水性氨基酸殘基圍成的孔,鈣離子從中通過[36];由圖2b、2e 可知,跨膜區(qū)域主要由幾組平行的α 螺旋構成,展示出明顯的跨膜蛋白特性。
WT FAWRyR 和DBMRyR 的模型評價結果如圖2c、2f 所示:WT FAWRyR 及DBMRyR 的Procheck 評估結果分別為:最優(yōu)區(qū)域殘基占比87.4%、89.8%,額外允許區(qū)殘基占比11.7%、9.5%,兩者殘基位于允許區(qū)域的比例均大于90%,模型合理。
將WT FAWRyR 與DBMRyR 的模型進行疊合對比 (圖3a、3b),并把DBMRyR 跨膜區(qū)域的氨基酸序列與WT FAWRyR 跨膜區(qū)域的蛋白模型進行對比 (圖3c),三維結構對比結果顯示:兩者的RMSD 值為0.082,其三維模型差異較小。二維序列對比結果表明:兩者的同源度為92.55%,覆蓋度為99%,具有較高的同源性。
2.2 分子對接結果分析
2.2.1 雙酰胺類殺蟲劑與WT FAWRyR 的結合模式分析 對接方法驗證:將WT FAWRyR 與5 種雙酰胺類殺蟲劑分別對接后 (保留9 個構象),根據對接親和力打分進行排序,并選擇最佳對接構象與已解析的兔子RyR 與氯蟲苯甲酰胺的復合晶體進行疊合對比。結果表明:預測的配體構象與實際構象相似,結合模式合理,證明對接方法可行。
WT FAWRyR 與氯蟲苯甲酰胺、氟苯蟲酰胺、溴氰蟲酰胺、環(huán)溴蟲酰胺及四唑蟲酰胺最優(yōu)構象的結合親和力分別為:-31.813 6、-35.581、-33.488、-30.139 2 和-38.092 6 kJ/mol。對結合模式進行分析可知:L4458、Y4462、Y4643、L4646 和F4892 與氯蟲苯甲酰胺的苯環(huán)及吡啶環(huán)形成疏水作用;K4642 與吡啶環(huán)上的N 原子形成氫鍵;Y4639 與吡啶環(huán)形成π-π 相互作用;K4642的N 原子與吡唑環(huán)形成π-陽離子作用;G4891與吡啶環(huán)上的Cl 原子形成鹵鍵 (圖4a)。L4458、T4863、V4890 與氟苯蟲酰胺的苯環(huán)形成疏水作用;K4642 與羰基上的O 原子形成氫鍵,R4896與磺酰基上的O 原子形成氫鍵,V4890、G4891與酰胺上的NH 形成氫鍵;R4896 的N 原子與苯環(huán)形成π-陽離子作用 (圖4b)。L4458、Y4462、Y4643、L4646 和F4892 與溴氰蟲酰胺的苯環(huán)、吡啶環(huán)形成疏水作用;K4642、G4891 分別與吡啶環(huán)上的N 原子和吡唑環(huán)側酰胺結構NH 形成氫鍵;Y4639 與吡啶環(huán)形成π-π 相互作用;K4642與吡唑環(huán)形成π-陽離子作用;G4891 與吡啶環(huán)上的Cl 原子形成鹵鍵 (圖4c)。L4458、L4646、Y4863、V4890 和F4892 與環(huán)溴蟲酰胺的吡啶環(huán)及環(huán)丙基形成疏水作用;K4642 與吡唑環(huán)的N 原子形成氫鍵,G4891 與環(huán)丙基側酰胺結構的NH 形成氫鍵,R4896 與吡唑環(huán)側羰基的O 原子形成氫鍵;K4642、R4896 的N 原子分別與吡啶環(huán)和吡唑環(huán)形成π-陽離子作用 (圖4d)。Y4462、Y4643、L4646 和F4892 與四唑蟲酰胺的苯環(huán)形成疏水作用;K4642、G4891 分別與吡啶環(huán)上的N 原子和吡唑環(huán)側酰胺結構的NH 形成氫鍵;Y4639 和Y4863 分別與吡啶環(huán)和四唑環(huán)形成π-π 相互作用;K4642 的N 原子與吡唑環(huán)形成π-陽離子作用;S4860 與三氟甲基上的F 原子形成鹵鍵 (圖4e)。由于存在疏水作用、π-π 相互作用、π-陽離子作用及分子間形成的氫鍵和鹵鍵,使分子能穩(wěn)定存在。5 種殺蟲劑與WT FAWRyR 對接后的位置如圖4f 所示,可見其位置都位于預測的活性口袋內。
2.2.2 雙酰胺類殺蟲劑與FAWRyR-E4891 的結合模式分析 FAWRyR-E4891 與氯蟲苯甲酰胺、氟苯蟲酰胺、溴氰蟲酰胺、環(huán)溴蟲酰胺及四唑蟲酰胺最優(yōu)構象的結合親和力分別為:-26.371 8、-29.720 6、-28.464 8、-27.209 和-32.650 8 kJ/mol。對結合模式進行分析可知:Y4639、K4642 和Y4738 與氯蟲苯甲酰胺的苯環(huán)上的甲基和吡啶環(huán)形成疏水作用;Y4639 和K4642 分別與苯環(huán)側酰胺結構的NH 和吡啶環(huán)上的N 原子形成氫鍵;Y4639 與苯環(huán)形成π-π 相互作用;K4642 的N 原子與吡啶環(huán)形成π-陽離子作用 (圖5a)。F4638、Y4639、Y4738、K4642、K4742 和Y4863 與氟苯蟲酰胺的苯環(huán)及甲基形成疏水作用;K4642 與苯環(huán)側羰基上的O 原子形成氫鍵;K4642 的N 原子與苯環(huán)形成π-陽離子作用;Y4639 與苯環(huán)形成ππ 相互作用;Y4639 與三氟甲基上的F 原子形成鹵鍵(圖5b)。L4458、Y4639、K4642 和Y4738 與溴氰蟲酰胺的苯環(huán)、苯環(huán)上的甲基和吡啶環(huán)形成疏水作用;Y4639、K4642 分別與酰胺結構NH 和吡唑環(huán)側上羰基的O 原子形成氫鍵;Y4639 與苯環(huán)形成π-π 相互作用,K4642 的N 原子與吡啶環(huán)形成π-陽離子作用 (圖5c)。Y4639、K4642、Y4863、V4890 和R4896 與環(huán)溴蟲酰胺的吡啶環(huán)及環(huán)丙烷等形成疏水作用;R4896 與吡唑環(huán)側羰基的O 原子形成氫鍵;K4642 和R4896 的N 原子分別與吡唑環(huán)和吡啶環(huán)形成π-陽離子作用 (圖5d)。V4890與四唑蟲酰胺的吡啶環(huán)形成疏水作用;K4642 與四唑環(huán)上的N 原子形成氫鍵;K4642 的N 原子與四唑環(huán)、吡唑環(huán)形成π-陽離子作用 (圖5e)。FAWRyRE4891 與5 種殺蟲劑對接的位置如圖5f 所示,可見其5 種構象的位置都位于預測的活性口袋內。
2.2.3 雙酰胺類殺蟲劑與FAWRyR-M4734 的結合模式分析 FAWRyR-M4734 與氯蟲苯甲酰胺、氟苯蟲酰胺、溴氰蟲酰胺、環(huán)溴蟲酰胺及四唑蟲酰胺最優(yōu)構象的結合親和力分別為:-32.232 2、-35.581、-33.906 6、-29.720 6 和-38.512 2 kJ/mol。對結合模式進行分析可知:L4458、Y4462、Y4643、L4646 和F4892 與氯蟲苯甲酰胺的苯環(huán)和吡啶環(huán)形成疏水作用;K4642 與吡啶環(huán)上的N 原子形成氫鍵;Y4639 與吡啶環(huán)形成π-π 相互作用;K4642的N 原子與吡唑環(huán)形成π-陽離子作用;G4891 與吡啶環(huán)上的Cl 原子形成鹵鍵 (圖6a);L4458、Y4738、K4742、Y4863 和V4890 與氟苯蟲酰胺的苯環(huán)及甲基形成疏水作用;K4642 和K4742 分別與磺酰基上的O 原子形成氫鍵,V4890 和G4891與苯環(huán)側酰胺結構的NH 形成氫鍵;R4896 的N 原子與苯環(huán)形成π-陽離子作用 (圖6b);L4458、Y4462、Y4643、L4646 和F4892 與溴氰蟲酰胺的苯環(huán)和吡啶環(huán)形成疏水作用;K4642、G4891 分別與吡啶環(huán)的N 原子和酰胺結構的NH 形成氫鍵;Y4639 與吡啶環(huán)形成π-π 相互作用,K4642 與吡唑環(huán)形成π-陽離子作用;G4891 與吡啶環(huán)上的Cl 原子形成鹵鍵 (圖6c);L4458、L4646、Y4863、V4890 和F4892 與環(huán)溴蟲酰胺的吡啶環(huán)及環(huán)丙烷形成疏水作用;K4642 與吡唑環(huán)上的N 原子形成氫鍵,G4891 與環(huán)丙基側酰胺的NH 形成氫鍵,R4896 與丙三環(huán)側羰基的O 原子形成氫鍵;R4896的N 原子與吡啶環(huán)形成π-陽離子作用 (圖6d);Y4462、Y4643、L4646 和F4892 與四唑蟲酰胺的苯環(huán)形成疏水作用;K4642 與吡啶環(huán)上的N 原子形成氫鍵,G4891 與苯環(huán)側酰胺結構的NH 形成氫鍵;Y4639 和Y4863 分別與吡啶環(huán)和四唑環(huán)形成π-π 相互作用;K4642 的N 原子與吡唑環(huán)形成π-陽離子作用;S4860 與三氟甲基上的F 原子形成鹵鍵 (圖6e);FAWRyR-M4734 與5 種殺蟲劑對接的位置如圖6f 所示,可見其5 種構象的位置都位于預測的活性口袋內。
2.3 FAW 突變位點分析
由表2 可知:FAWRyR 的4734 位異亮氨酸(Ile) 突變?yōu)榈鞍彼?(Met) 后,與雙酰胺類殺蟲劑的結合親和力未下降;FAWRyR 的4891 位甘氨酸(Gly) 突變?yōu)楣劝彼?(Glu) 后,與雙酰胺類殺蟲劑的結合親和力明顯降低。
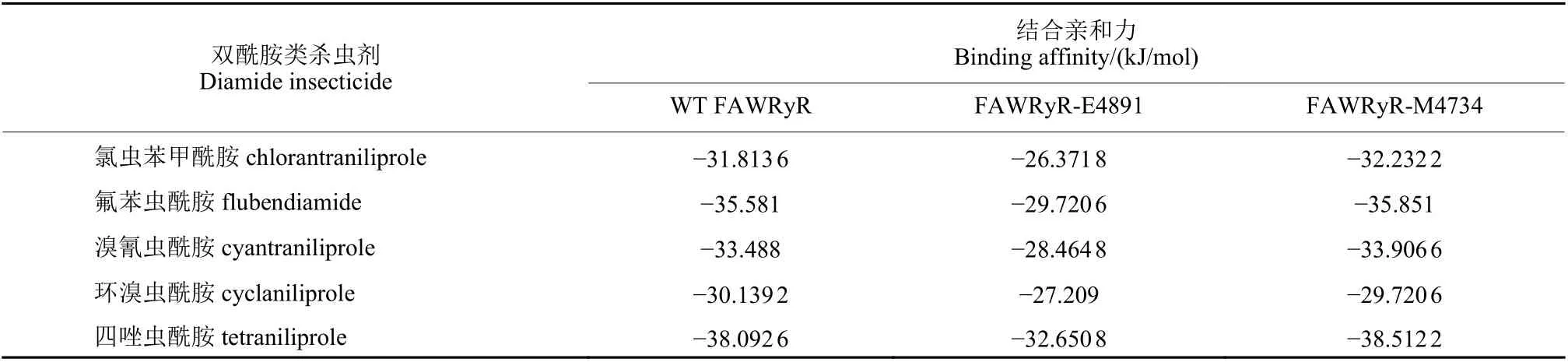
表2 FAWRyR 突變前后與雙酰胺類殺蟲劑的結合親和力變化Table 2 The binding affinity changes of the wild-type (WT) & mutant FAWRyRs and diamides
五種雙酰胺類殺蟲劑與WT FAWRyR、FAWRyRE4891 和FAWRyR-M4734 的結合模式如圖7 所示:將FAWRyR 的I4734 突變?yōu)镸4734 后,與雙酰胺類殺蟲劑之間的作用力方式、參與形成作用力的殘基和WT FAWRyR 基本一致,初步分析其主要原因是FAWRyR 的4734 號異亮氨酸(Ile) 不參與配體與受體之間作用力的形成。而FAWRyR 的4891 號甘氨酸 (Gly) 與雙酰胺類殺蟲劑之間存在氫鍵、鹵鍵相互作用,突變?yōu)楣劝彼?Glu) 后,不能與雙酰胺類殺蟲劑形成氫鍵、鹵鍵,導致受體與配體之間的作用力方式減少、親和力下降。FAWRyR 中G4891 突變?yōu)镋4891 可能是導致FAW 對雙酰胺類殺蟲劑產生抗藥性的主要原因,而I4734M 突變可能與抗藥性的產生無關。
2.4 氨基酸保守性分析
由MEME 工具分析得到Motif 圖 (圖8、圖9),圖中FAWRyR 跨膜區(qū)域的活性口袋由L4458、Y4461、L4641、Y4462、Y4639、K4642、Y4643、S4860、F4861、S4864、V4888、V4890、G4891、F4892 和K4893 構成 (如圖8 所示),其中Y4461、L4641、Y4462、Y4639、K4642、Y4643、S4860、F4861、S4864、V4888、V4890、G4891、F4892、K4893 均在保守區(qū)域,而L4458 在不保守區(qū)域,存在L4458Y 突變的可能 (如圖9 所示),但尚未見L4458 氨基酸突變?yōu)閅4458 氨基酸的相關報道,且L4458 氨基酸不與雙酰胺類殺蟲劑形成氫鍵等關鍵相互作用,L4458Y 突變引起雙酰胺類抗藥性的幾率較低。而G4891 氨基酸雖在FAWRyR的保守區(qū)域,但前文研究表明,G4891E 突變會引起FAWRyR 與雙酰胺類殺蟲劑的結合親和力下降,因此,引起抗藥性的G4891E 突變可能為隨機突變。
3 討論
解析鱗翅目害蟲RyR 與雙酰胺類殺蟲劑的結合模式一直是國內外研究的熱點。Steinbach 等根據Yan 等[37]解析的兔子RyR (PDB:3J8H) 的結構構建了DBMRyR 的同源模型,在此模型上引入G4946E 和I4790M 突變,并分析了雙酰胺類殺蟲劑與DBMRyR 的結合模式,提出RyR 與雙酰胺類殺蟲劑的結合位點可能在這兩個突變位點附近,但雙酰胺類殺蟲劑與DBMRyR 的結合模式、相互作用力以及形成作用力的殘基等尚不明確[16]。2020 年,Ma 等使用冷凍電鏡解析了兔子RyR 和氯蟲苯甲酰胺復合體的結構 (PDB:7CF9),揭示了兔子RyR 中氯蟲苯甲酰胺的結合口袋、作用方式以及參與結合的殘基[24],但FAWRyR 與雙酰胺類殺蟲劑的結合模式尚不明確。另外,F(xiàn)AW 對雙酰胺類殺蟲劑的抗性機制的相關研究較少。因此,本研究在已有研究的基礎上,選擇PDB:7CF9為模板,同源構建FAWRyR 的三維模型,并使用分子對接方法分析FAWRyR 與雙酰胺類殺蟲劑的結合模式。結果表明:5 種雙酰胺類殺蟲劑與FAWRyR 結合的活性口袋以及兩者之間形成作用力的氨基酸殘基基本一致。該結果與Qi 等報道的“氯蟲苯甲酰胺和氟苯蟲酰胺雖結構上略有差異,但結合位點相同”[38-39]的觀點一致。
目前,鱗翅目害蟲對雙酰胺類殺蟲劑的抗性可能與DBMRyR 的G4946E、I4790M,S. exiguaRyR 的I4743M 以及C. suppressalisRyR 的G4910E和I4758M (均對應FAWRyR 的G4891、I4734) 突變有關。鱗翅目害蟲RyR 跨膜區(qū)域氨基酸序列同源度一般在92%以上[40],本研究通過對比WT FAWRyR和DBMRyR 跨膜區(qū)域的氨基酸序列,發(fā)現(xiàn)兩者的同源度高達92.55%;對比兩者RyR 三維模型,其RMSD 值為0.082,兩者同源度極高。因此,本研究根據DBMRyR 的G4946E 和I4790M 突變構建了FAWRyR-E4891 和FAWRyR-M4734 突變體,并分析了其與雙酰胺類殺蟲劑的結合模式。結果表明:FAWRyR 的G4891 突變?yōu)镋4891 后,與雙酰胺類殺蟲劑的親和力下降。目前已有研究結果表明,DBMRyR、C. suppressalisRyR 的G4946E 和G4910E (均對應FAWRyR 的G4891) 突變均可能導致其對雙酰胺類殺蟲劑產生抗性。因此,F(xiàn)AWRyR的G4891E 突變,可能是FAW 對雙酰胺類殺蟲劑產生抗性的原因之一。在今后的研究中,需重點關注FAWRyR 的G4891E 突變。現(xiàn)有研究認為,F(xiàn)AWRyR 的I4734M 突變也可能與FAW 對氯蟲苯甲酰胺和氟苯蟲酰胺的抗性有關[21]。但本研究發(fā)現(xiàn),F(xiàn)AWRyR 的4734 號氨基酸不參與其與雙酰胺類殺蟲劑的結合,I4734 突變?yōu)镸4734 后FAWRyR 與雙酰胺類殺蟲劑的親和力并未下降。另外,Ma 等的研究結果表明:DBMRyR 的I4790(對應FAW 的I4734) 也不是其與雙酰胺類殺蟲劑形成親和力的主要殘基[24]。Boaventura 等在研究FAWRyR 的4734 號氨基酸突變與抗藥性關系時所測田間幼蟲樣本數(shù)量有限,田間樣本中I4734M突變頻率較低[21],I4734M 突變是否能夠導致FAW 對雙酰胺類殺蟲劑產生抗性仍需進一步研究探索。本研究也表明:G4891 在FAWRyR 的保守區(qū)域,引起抗藥性的G4891E 突變可能為隨機突變。除G4891 外,K4642、V4890 和R4896 與雙酰胺類殺蟲劑也可能存在氫鍵相互作用,同時也存在隨機突變的可能性。因此,在后期研究中,應重點關注這3 個氨基酸的突變,并進一步研究該突變與其對雙酰胺類殺蟲劑抗性的關系。另外在未來研究中,除了使用通過分子對接、氨基酸序列保守性分析的方法外,還可以考慮使用突變預測工具,如:AIMMS[41]、KRDS[42]在線工具和生物學網絡建模方法[43]等預測其他隨機突變與抗藥性之間的關系。
目前,本研究僅通過同源建模方法構建了FAWRyR 突變前后的三維模型,通過分子對接方法模擬FAWRyR 突變前后與雙酰胺類殺蟲劑的結合模式,能夠為分析FAW 對雙酰胺類殺蟲劑的抗性機制提供理論依據。但是,分子對接的方法只能初步分析配體與受體之間的親和力,而分子動力學模擬能更加準確地計算配體與蛋白受體的絕對結合自由能,其在藥物結合靶標研究中被廣泛應用[44-45]。LAMMPS、Gromacs、NAMD 等傳統(tǒng)的分子動力學模擬軟件操作繁瑣,不適合進行大量的結合模式分析和結合自由能計算工作。目前也有一些圖形化的分子動力學模擬在線工具 (如:LARMD[46]) 正在研發(fā)中,在未來研究中可以考慮運用這些工具進一步分析配體與受體之間的結合模式,計算親和力。另外,本研究通過計算機模擬得出的理論計算結果并未經過實際的分子生物學實驗驗證,且同源建模和分子對接方法僅是計算機模擬方法,無法完全準確模擬受體和配體之間的結合模式。在今后研究中,可以通過分子生物學實驗進一步驗證該文的理論計算結果,以及可以使用冷凍電鏡或X-ray 衍射法分析FAWRyR與雙酰胺類殺蟲劑復合體的結構,精確分析兩者之間的結合模式。
4 結論
本研究通過蛋白質模建、分子對接等計算機分子模擬方法,分析了WT FAWRyR 與雙酰胺類殺蟲劑的結合模式;根據已報道的鱗翅目害蟲RyR 的突變位點,構建FAWRyR 突變體,并對其分析與5 種雙酰胺類殺蟲劑的結合模式。主要結論有:
1) 通過同源建模的方法構建了FAWRyR 的C 端跨膜區(qū)域及其突變體的三維模型。
2) 通過對比分析FAWRyR 突變前后與5 種雙酰胺類殺蟲劑的結合模式,發(fā)現(xiàn)G4891E 突變會導致FAWRyR 與雙酰胺類殺蟲劑的結合親和力下降、形成的作用力方式減少,從而導致FAW 對雙酰胺類殺蟲劑產生抗性。
本研究從結構生物學角度初步分析了FAW 抗雙酰胺類殺蟲劑的機理,能夠為研究FAW 對雙酰胺類殺蟲劑的抗性提供線索,同時為今后殺蟲劑分子設計和結構修飾提供參考。在今后研究中可結合分子生物學實驗、冷凍電鏡或X-ray 衍射法進一步驗證FAW 抗雙酰胺類殺蟲劑的機理。

