4種原核表達雙鏈RNA的dsRNA提取方法效果評價
常 瑞,王 俊,付開赟,廖蘭蘭,丁新華,何 江,郭文超,吐爾遜·阿合買提,任 羽
(1.喀什大學生命與地理科學學院,新疆喀什 844006;2.新疆農業農村廳植物保護站,烏魯木齊 830049;3.新疆農業科學院植物保護研究所/農業部西北荒漠化綠洲作物有害生物綜合治理重點實驗室,烏魯木齊 830091;4.新疆農業科學院微生物應用研究所/新疆特殊環境微生物重點實驗室,烏魯木齊 830091)
0 引 言
【研究意義】馬鈴薯甲蟲(LeptinotarsadecemlineataSay)是馬鈴薯毀滅性害蟲。持續化學防治使馬鈴薯甲蟲對部分擬除蟲菊酯、氨基甲酸酯、有機磷、新煙堿類和微生物殺蟲劑產生了抗性[1]。使用RNAi技術,喂食馬鈴薯甲蟲涂抹dsRNA的馬鈴薯葉片,可有效降低、沉默馬鈴薯甲蟲特定基因表達,抑制馬鈴薯甲蟲的正常生長發育,具有高度專一性、安全性強,且植物生長發育不受影響,對挖掘更多生物防治策略具有重要意義[2]。但dsRNA生產成本高、產量無法預測、穩定性低。【前人研究進展】dsRNA在環境中極不穩定,自然條件下3~5 h就會完全降解;San等[3]發現dsRNA在紫外線照射下,4 h就會完全降解。并且其作用機制研究不系統,植物是否會傳遞、擴增dsRNA以及有害生物對RNAi敏感性差別大等因素[4]。目前,dsRNA主要通過3個方法大量生產:一是合成含有T7啟動子的dsRNA特異性引物,運用體外合成試劑盒合成dsRNA[5,6]。二是原核生物發酵生產dsRNA,最早用于干擾秀麗引線蟲,喂食秀麗引線蟲時可產生強烈干擾。將構建完成的dsRNA表達載體導入RNase III缺陷型大腸桿菌HT115(DE3)感受態中,經異丙基硫代-β-D-半乳糖苷(IPTG)誘導,產生dsRNA[7,8]。三是通過轉基因植物表達dsRNA,使植物具有“終生”防御性,害蟲啃食植物后,可有效抑制其生長發育甚至直接死亡,無需人為干預[9,10]。【本研究切入點】方法可大量合成dsRNA,快速高效,合成dsRNA可直接使用,但體外合成試劑盒成本較高,實際大規模推廣使用不切實際。方法可發酵得到大量dsRNA,且成本較低。但在發酵、誘導過程中,如何保證菌體高活性、持續產生dsRNA,仍需有待研究。針對RNAi的特異性以及原核發酵獲得dsRNA良好的應用前景,以pET-2p和L4440為載體發酵產生dsRNA的實驗方法為基礎。研究篩選并試驗4種提取菌液總RNA方法以提高菌液dsRNA的獲取率。【擬解決的關鍵問題】利用720 bp綠色熒光蛋白gfp[11-13]為模板,分別隨機改變堿基改變GC含量,并構建5組不同長度組合的dsgfp片段:201 bp長度的30%CG 含量的dsgfp(簡稱201-30CG,下同)、201-50CG、423-30CG、423-50CG、423-70CG。運用試劑盒體外合成以上5種dsgfp,檢測其濃度、純度作為參照標準。將以上10組表達載體原核發酵后,運用Trizol法、酚氯仿法、RNA-easy提取液、以及75%酒精沉淀法分別提取dsgfp。建立菌液表達dsRNA的最佳提取方法以及最優表達載體提供理論支持。
1 材料與方法
1.1 材 料
1.1.1 載體
pET-2p、L4440質粒實驗室保存。
1.1.2 菌株
大腸桿菌HT115(DE3)菌株購自上海唯地生物技術有限公司,培養至二代菌株由該實驗室保存。
1.1.3 主要試劑及儀器
試劑:Trans-T1感受態細胞、2xEasyTaqPCR Super Mix(全式金);瓊脂糖(西班牙);LB broth(MDBio,Inc);卡那霉素(Kana)、四環素(Tet)、氨芐青霉素(Amp)、IPTG粉末;苯酚∶氯仿混合液(25∶24)等(Solarbio);質粒小抽提試劑盒、瓊脂糖凝膠回收試劑盒(OMEGA);HiScribeTMT7High Yield RNA Synthesis Kit(NEB);限制性內切酶EcoRI、NotI、Hinglll、XhoI(Thermo);ClonExpressII One Step Cloning Kit、RNA-easy提取液(Vazyme);Trizol Reagent(ambion);焦炭酸二乙酯(DEPC,biosharp);異丙醇、無水乙醇均為分析純;Dnase-/Rnase-free離心管、移液器槍頭(Biologix)。
儀器:離心機(湘立TGL16M);PCR儀(ICycling 96梯度);搖床(TASITEDY-200B);電熱恒溫干燥箱(TASITE202-1AB);水浴鍋(BATHS);核酸電泳系統(北京六一 DYY-6D);凝膠成像系統(Wealtec Dolphin1D);B-500 BIOPHOTO METER(METASH);-80℃冰箱(Thermo ULTS1368);超凈工作臺(江蘇通凈 VD-650);超純水機(青島富勒姆 FBZ0502-SUP)。
1.2 方 法
1.2.1dsgfp基因、引物合成
以來自于720 bpgfp的序列為模板,對其基因進行設計優化,隨意改變堿基CG含量,交由南京金斯瑞生物科技有限公司完成基因合成。人工合成了5組不同長度組合的dsgfp片段:201 bp長度的30%CG 含量的dsgfp(簡稱201-30CG,下同)、201-50CG、423-30CG、423-50CG、423-70CG。以T7啟動子為起始序列設計、合成引物,用于體外合成dsgfp。以XhoI、HindIII(L4440)和KpnI、NotI(pET-2p)為雙酶切位點設計、合成引物,用于構建L4440-gfp和pET-2p-gfp表達載體。表1,圖1

圖1 不同長度、CG組合的dsgfp片段序列Fig.1 Sequence of dsgfp fragments of different lengths and CG combinations
1.2.2 重組表達載體構建
1.2.2.1 感受態細胞制備
HT115(DE3)二代甘油超低溫保存菌種以1∶1 000接種于含四環素(Tet+)液體LB培養基中,37℃ 250 g離心力培養過夜。挑取單克隆37℃ 250 g離心力培養5 h。活化后菌液1∶100在LB液體培養基(Tet+)37℃ 250 g離心力培養2~3 h,至OD為0.4~0.6。將菌液冰上放置10 min,使溫度降至0℃,0.1 mol/L CaCl2溶液同時放置冰上預冷。4℃ 4 000 g離心力10 min。沉淀中加入5∶1體積預冷后0.1 mol/L CaCl2溶液懸浮。冰上放置15~30 min,4℃ 4 000 g離心力10 min。沉淀加入25∶1體積0.1 mol/L CaCl2溶液和25∶1體積30%甘油,冰上放置10 min。菌體重懸,分裝并-80℃保存。
1.2.2.2 目的基因PCR擴增及回收
以人工合成的目的片段為模板,使用表1引物進行L4440-gfp、pET-2p-gfp目的片段PCR反應:94℃ 3 min;94℃ 30s、61℃ 30s,每個循環降0.5℃、72℃ 30s,10個循環;94℃ 30s、56℃ 30s、72℃ 30s,35個循環;72℃10 min。1.5%瓊脂糖凝膠電泳檢測,切下目的條帶運用試劑盒回收。
1.2.2.3 L4440-gfp與pET-2P-gfp表達載體的構建(1) L4440載體與pET-2p載體線性化
L4440載體雙酶切體系為:6 μL DNA、2 μL XhoI、2 μL HindIII、2 μL 10xFastDigest Green Buffer、8 μL dd H2O,總體積為20 μL,37℃ 15 min;80℃ 10 min。pET-2p載體雙酶切的體系為:6 μL DNA、2 μLNotI、2 μLKpnI、2 μL 10xFastDigest Green Buffer、8 μL dd H2O,總體積為20 μL,37℃15 min;80℃ 5 min。1%瓊脂糖凝膠電泳,回收目的DNA。
(2) L4440-gfp與pET-2p-gfp重組載體構建與表達
使用ClonExpressII One Step Cloning Kit將線性化質粒與目的片段重組,反應體系為:10 μL重組產物加入100 μL Trans-T1感受態,涂布至固體LB培養基(L4440:氨芐青霉素Amp+、pET-2p:卡那霉素KaNa+)37℃倒置過夜。次日挑取單克隆37℃ 250 g離心力培養5 h。運用表1的引物進行菌液PCR驗證。驗證正確的菌液1∶100接種于LB液體培養基中(L4440:Amp+、pET-2p:KaNa+)37℃ 250 g離心力培養3.5 h,提取質粒進行雙酶切驗證,剩余菌液送北京華大基因公司測序。
將驗證正確的質粒轉入HT115(DE3)感受態,涂布至LB固體培養基上(L4440:Amp+、pET-2p:KaNa+)37℃倒置過夜。次日挑取單克隆37℃ 250 g離心力培養5 h。運用表1引物進行菌液PCR驗證,保存驗證成功的菌液。
1.2.3 dsgfp的誘導表達
將驗證正確的菌液1∶1 000接種于LB液體培養基(L4440:Amp+、Tet;pET-2p:KaNa+、Tet+)37℃ 250 g離心力活化過夜。以1∶100接種于LB液體培養基(L4440:Amp+、Tet+;pET-2p:KaNa+、Tet+)37℃ 250 g離心力培養3.5 h,加入IPTG溶液繼續振蕩培養5 h。取1 mL菌液提取總核酸,1%瓊脂糖電泳檢測,Image J軟件灰度分析電泳條帶。將成功誘導dsgfp的菌液加50%甘油(1∶1)-80℃保存。
1.2.4 體外合成dsgfp
1.2.4.1 DNA模板制備
將成功誘導dsgfp的菌液1∶1 000接種于LB液體培養基(L4440:Amp+、Tet+;pET-2p:KaNa+、Tet+)37℃ 250 g離心力培養12~16 h提取質粒。運用含有T7啟動子目的引物進行PCR反應,1.5%瓊脂糖凝膠電泳檢測,切下目的條帶運用試劑盒回收。表1
1.2.4.2 體外轉錄、退火形成dsgfp
反應體系為:NTP Buffer Mix 10μL,Template DNA 8 μL(0.5 μg),T7 RNA polymerase Mix 2 μL,總體積為20 μL。37℃溫浴4~6 h。將反應液于70℃水浴10 min,冷卻至室溫。加入10∶1體積Dnase I和Rnase A稀釋液(稀釋200倍),37℃ 30 min。取1 μL合成dsgfp溶于10 μL Nuclease-Free water,1.5%瓊脂糖凝膠電泳檢測,產物-80℃保存。
1.2.5 4種方法分別提取l4440-gfp和pET-2p-gfp表達dsgfp
1.2.5.1 Trizol法
取50 mL誘導菌液,4℃ 7 500 g離心5 min。沉淀加入50∶1體積 Trizol,震蕩,室溫放置5 min。加入5∶1體積氯仿,震蕩15s,室溫放置10 min,4℃ 12 000 g離心15 min。上清加入2∶1體積異丙醇,顛倒5~6次,室溫靜置10 min,4℃ 12 000 g離心力10 min。沉淀加入1∶1體積75%乙醇4℃ 7 500 g離心力5 min。重復洗滌1次。沉淀室溫靜置5~10 min后加入30 μL DEPC水。溶解的dsRNA加入10∶1體積稀釋的Rnase A和Dnase I消化后,37℃ 15 min,-80℃保存。
1.2.5.2 酚氯仿法
取50 mL誘導菌液,4℃ 7 500 g離心力5 min。沉淀加入100∶1 體積STE buffer,渦旋振蕩。加入1∶1體積苯酚:氯仿混合液(25∶24),渦旋100s。4℃ 15 000 g離心力15 min,上清加入2∶1體積異丙醇,室溫靜置10 min,4℃ 12 000 g離心力10 min。沉淀加入1∶1體積 75%乙醇4℃ 7 500 g離心力5 min。重復洗滌1次。沉淀室溫靜置5~10 min后加入30 μL DEPC水。溶解的dsRNA加入10∶1體積稀釋的Rnase A和Dnase I消化后,37℃ 15 min,-80℃保存。
1.2.5.3 RNA-easy提取液
取50 mL誘導的菌液,4℃ 7 500 g離心力5 min,1xPBS清洗沉淀。加入100∶1體積 RNA-easy提取液,室溫12 000 g離心力15 min。上清加入1∶1體積異丙醇,室溫靜置10 min。室溫12 000 g離心力10 min。沉淀加入1∶1體積 75%乙醇4℃ 7 500 g離心力5 min。重復洗滌1次。沉淀室溫靜置5~10 min后加入30 μL DEPC水。溶解的dsRNA加入10∶1體積稀釋的Rnase A和Dnase I消化后,37℃ 15 min,-80℃保存。
1.2.5.4 75%酒精沉淀法
取50 mL誘導菌液,4℃ 7 500 g離心力5 min,沉淀加入25∶1體積 75%乙醇,室溫靜置5 min。加入4∶1體積150 mmol/L NaCl溶液,室溫靜置60 min,4℃ 12 000 g離心力10 min。上清加入10∶1體積稀釋的Rnase A和Dnase I消化后,37℃ 15 min,-80℃保存。
1.2.6 dsgfp濃度、純度測定
1.2.6.1 體外合成dsgfp濃度、純度
取2 μL dsgfp樣品于B-500 BIOPHOTO METER檢測,用Nuclease-Free water分別稀釋至濃度為1 000、500、250、125、62.5和31.25 ng/μL并檢測A260/A280、A260/A230。稀釋dsgfp 1.5%瓊脂糖凝膠電泳檢測120 V 25 min。
1.2.6.2 菌液提取dsgfp濃度、純度
取2 μL dsgfp樣本于B-500 BIOPHOTO METER檢測,用Nuclease-Free water分別稀釋至濃度為1 000、500、250、125、62.5和31.25 ng/μL并檢測A260/A280、A260/A230。稀釋dsgfp 1.5%瓊脂糖凝膠電泳檢測120 V 25 min。
1.2.7 損失率檢測及dsgfp產量
將體外合成的5組dsgfp分別稀釋至1 000 ng/μL,將30 μL稀釋液混合至50 mL未經IPTG誘導菌液中,運用以上4種方法進行提取,B-500 BIOPHOTO METER檢測濃度、A260/A280和A260/A280。運用最佳提取方法分別提取1 mL菌液dsgfp測定濃度,根據提取方法損失率,計算pET-2P、L4440表達的dsgfp產量。
1.3 數據處理
運用Image J軟件分析載體表達dsgfp灰度值。Microsoft office Excel 2010、SPSS 25.0軟件對體外合成dsgfp以及菌液提取dsgfpA260/A280、A260/A230值進行多重方差分析和新復極差法進行顯著性分析。2樣本間均數比較采用配對T檢驗。
2 結果與分析
2.1 IPTG誘導基于PET-2P、L4440產生dsgfp
pET-2p和L4440經IPTG誘導表達產生dsRNA,經RNase A消化后1.5%瓊脂糖凝膠電泳檢測,pET-2p-gfp和L4440-gfp表達載體。圖2
2.2 pET-2P、L4440產生dsgfp電泳條帶
研究表明,基于pET-2P載體表達的5組不同長度、不同CG含量的dsgfp灰度值均高于基于L4440載體表達的5組不同長度、不同CG含量的dsgfp灰度值,具有顯著差異(P<0.05)。其中pET-2p表達201-30CG以及423-30CG灰度值明顯高于L4440表達201-30CG和423-30CG灰度值。圖3
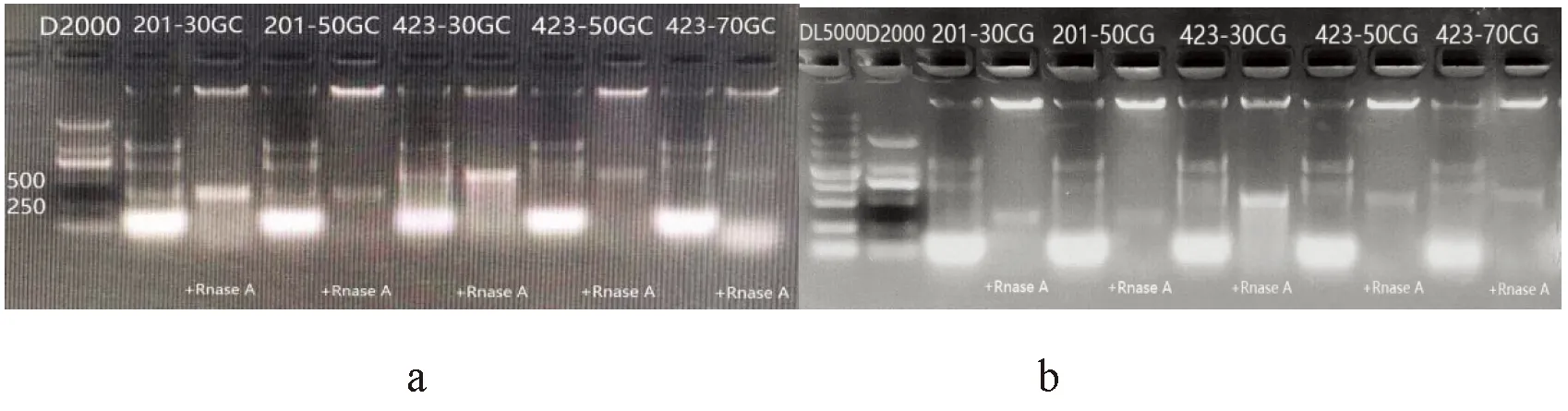
注:a:基于pET-2p表達dsgfp;b:基于L4440表達dsgfp。D2000:分子質量標記(天根),其大小分別是2 000、1 000、750、500、250、100;DL5000:分子質量標記(TaKaRa),其大小分別是5 000、3 000、2 000、1 000、750、500、250、100Note:a:express dsgfp based on pET-2p,b:express dsgfp based on L4440.D2000:molecular mass marker(Tiangen)of 2,000,1,000,750,500,250,100;DL5000:molecular mass marker(TaKaRa)of 5,000,3,000,2,000,1,000,750,500,250,100圖2 基于pET-2p和L4440表達dsgfp 1.5%瓊脂糖凝膠電泳檢測Fig.2 Agarose gel electrophoresis detection based dsgfp 1.5% pET-2p and L4440 expression
2.3 體外合成dsgfp濃度、純度
研究表明,分別梯度稀釋6組濃度,每組dsgfp A260/A280均在1.9~2.2,合成的5組dsgfp純度較高。稀釋至31.25 ng/μL的5組dsgfp稀釋液,A260/A230值均在3.2~5.0,濃度過低,達到儀器檢測最小閾值,出現偏差。其余5組dsgfp稀釋液均在2.2~3.0。5組體外合成dsgfp可以作為標準品,進行后續實驗。圖4,圖5

注:D2000:分子質量標記(天根),其大小分別是2 000、1 000、750、500、250、100Note:D2000:molecular mass marker(Tiangen)of 2,000,1,000,750,500,250,100圖4 體外合成dsgfp 1.5%瓊脂糖凝膠電泳檢測Fig.4 Detection dsgfp 1.5% agarose gel electrophoresis
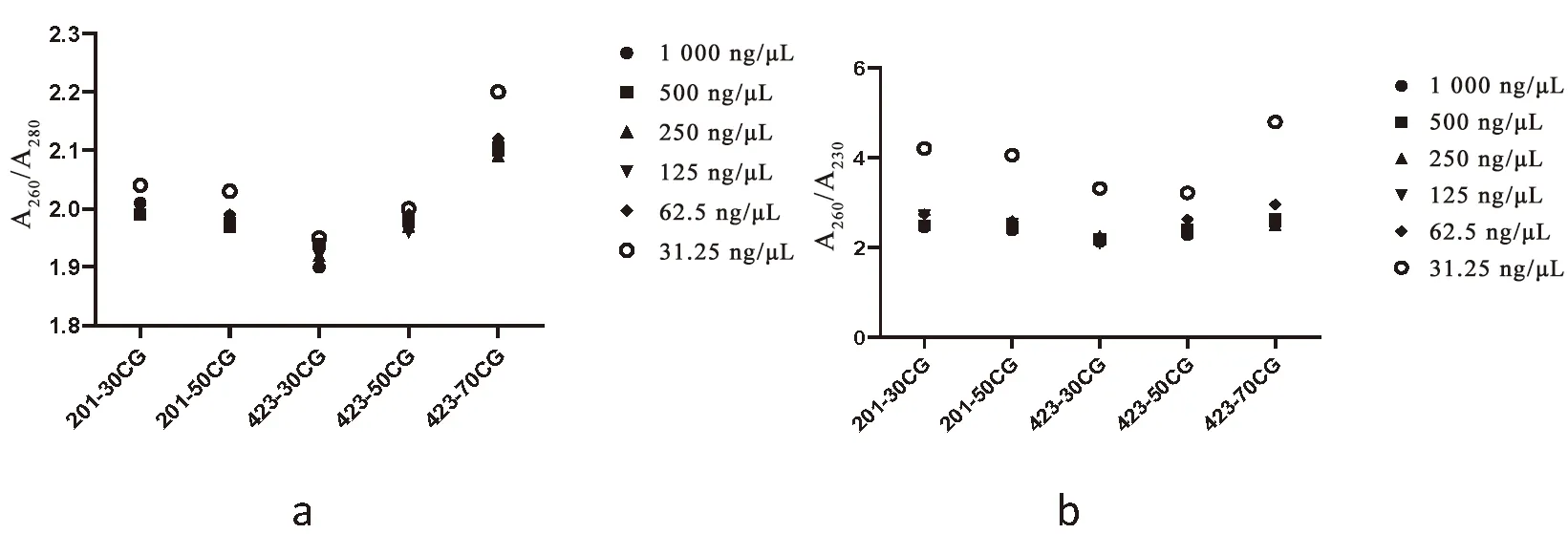
注:a:5組dsgfp稀釋至不同濃度檢測A260/A280;b:5組dsgfp稀釋至不同濃度檢測A260/A230Note:a:five groups dsgfp diluted to different concentrations A260/A280 detection;b:five groups dsgfp diluted to different concentrations A260/A230 detection圖5 體外合成5組dsgfp濃度、純度Fig.5 Analysis of dsgfp concentration and purity of five groups synthesized in vitro
2.4 4種方法提取菌液dsRNA
2.4.1 提取基于pET-2p載體表達dsgfp
研究表明,根據提取dsgfp核酸檢測值,對A260/A280和A260/A230利用SPSS分別構建多重比較模型,模型截距(F=19 202.406,P=0.000)(F=922.24,P=0.000),提取方法因素(F=28.408,P=0.000)(F=21.833,P=0.000)分別達極顯著水平,濃度因素分別達到顯著水平(F=2.868,P=0.041)和不顯著水平(F=0.297,P=0.909)。新復極差法顯著性檢驗顯示不同濃度之間差異不顯著。提取純度最高的Trizol法和酚氯仿法(CK為對照),且這兩者差異不顯著,其次是75%酒精沉淀法,提取純度最低的為RNA-easy提取液。圖6,圖7
2.4.2 提取基于L4440載體表達dsgfp
研究表明,根據提取dsgfp核酸檢測值,對A260/A280和A260/A230利用SPSS分別構建多重比較模型,模型截距(F=15 242.017,P=0.000)(F=734.211,P=0.000),提取方法因素(F=30.300,P=0.000)(F=24.085,P=0.000)分別達極顯著水平,濃度因素分別達到顯著水平(F=3.453,P=0.021)和不顯著水平(F=0.344,P=0.880)。新復極差法顯著性檢驗顯示不同濃度之間差異不顯著。提取純度最高的Trizol法和酚氯仿法(CK為對照),且這兩者差異不顯著,其次是75%酒精沉淀法,提取純度最低的為RNA-easy提取液。圖6,圖7
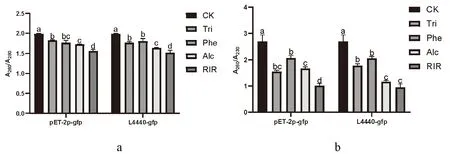
注:數據后附不同字母者表示在0.05水平上差異顯著(鄧肯氏新復極差法);CK:體外合成;Tri:Trizol法;Phe:酚氯仿法;Alc:75%酒精沉淀法;RIR:RNA-easy提取液;a:提取pET-2p和L4440表達dsgfp,分別稀釋至不同濃度檢測A260/A280;b:提取pET-2p和L4440表達dsgfp,分別稀釋至不同濃度檢測A260/A230Note:Those with different letters after the data indicate significant differences at the 0.05 level(Duncan's new multiple range method);CK:in vitro synthesis;Tri:Trizol method;Phe:phenol chloroform method;Alc:75% alcohol precipitation method;RIR:RNA-easy extract;a:Extract pET-2p and L4440 to express dsgfp and dilute to different concentrations to detect A260/A280;b:Extract pET-2p and L4440 to express dsgfp and dilute to different concentrations to detect A260/A230圖6 4種方法提取pET-2p和L4440載體表達dsgfp純度Fig.6 Purity analysis of pET-2p and L4440 vector expression extracted by four methods
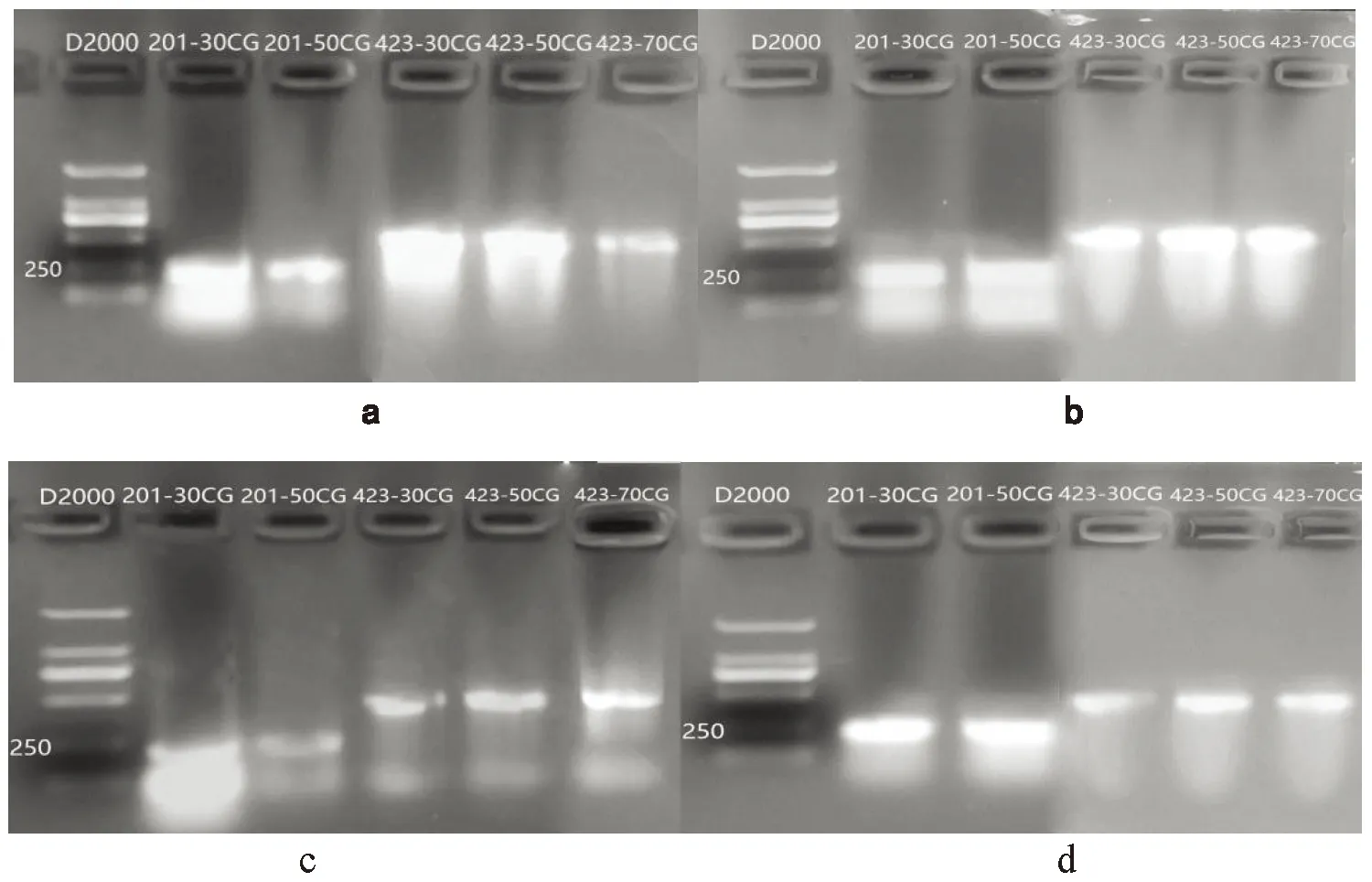
注:D2000:分子質量標記(天根),其大小分別是2 000、1 000、750、500、250、100;a:酚氯仿法提取基于pET2p表達dsgfp(經Dnase I和Rnase A消化,稀釋至500 ng/μL);b:酚氯仿法提取基于L4440表達dsgfp(經Dnase I和Rnase A消化,稀釋至500 ng/μL);c:Trizol法提取基于pET2p表達dsgfp(經Dnase I和Rnase A消化,稀釋至500 ng/μL);d:Trizol法提取基于L4440表達dsgfp(經Dnase I和Rnase A消化,稀釋至500 ng/μL)Note:D2000:Molecular mass marker(Tiangen),its size is 2,000,1,000,750,500,250,100;a:Phenol-chloroform extraction method based on pET2p expression dsgfp(digested with Dnase I and Rnase A,diluted to 500 ng/μL);b:Phenol-chloroform extraction method based on L4440 to express dsgfp(digested with Dnase I and Rnase A,diluted to 500 ng/μL);c:Trizol method extracts dsgfp based on pET2p(digested with Dnase I and Rnase A,diluted to 500 ng/μL);d:Trizol method extracts dsgfp based on L4440(digested with Dnase I and Rnase A,diluted to 500 ng/μL)圖7 酚氯仿法和Trizol法提取50 mL菌液表達dsgfp 1.5%瓊脂糖凝膠電泳Fig.7 Phenol chloroform method and Trizol method to extract 50 mL bacterial solution to express dsgfp 1.5% agarose gel electrophoresis
2.5 4種提取方法損失率
研究表明,4種方法提取后的體外合成dsgfp與提取前的體外合成dsgfp濃度純度存在明顯差異,經SPSS軟件分析,差異有統計學意義(P<0.05)。其中酚氯仿法和Trizol法提取的dsgfp濃度、純度最高,與體外合成的差異最小,計算提取損失率分別為21.44%、23.83%,75%酒精沉淀法和RNA-easy提取液提取的dsgfp濃度、純度最低,與體外合成差異最大,計算提取損失率分別為32.3%、37.62%。表2
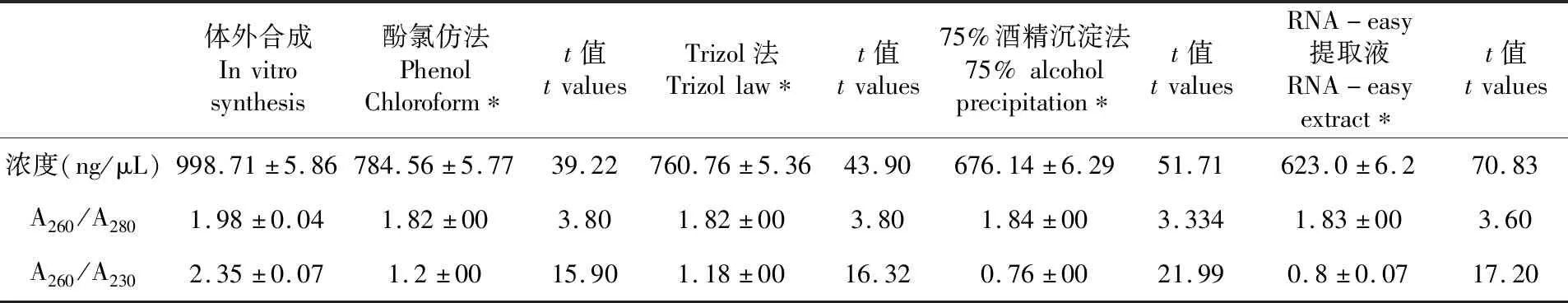
表2 4種方法提取內標混合純dsgfp濃度、純度Table 2 Comparison and analysis of the concentration and purity of the internal standard mixed pure dsgfp extracted by four methods
2.6 基于pET-2P、L4440產生dsgfp產量
研究表明,基于pET-2P載體表達5組不同長度、不同CG含量的dsgfp濃度均高于基于L4440載體表達5組不同長度、不同CG含量的dsgfp濃度,具有顯著差異(P<0.05)。基于pET-2P和L4440表達載體1 mL誘導菌液可發酵產生8.7~24.39 μg、7.48~22.47 μg dsgfp。圖8
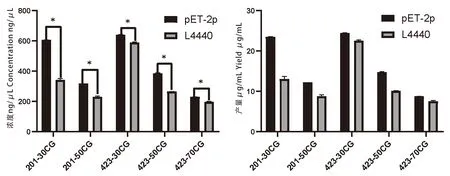
注:*表示在0.05水平上差異顯著(配對T檢驗);a:酚氯仿法提取基于pET-2p和L4440表達dsgfp濃度;b:基于pET-2p和L4440表達dsgfp產量Note:* means significant difference at the 0.05 level(paired T test);a:Phenol chloroform extraction method based on pET-2p and L4440 express dsgfp concentration;b:Based on pET-2p and L4440express dsgfp yield圖8 酚氯仿法提取1 mL菌液dsgfp濃度及產量Fig.8 Analysis of the concentration and yield of dsgfp extracted from 1 mL bacterial solution by phenol-chloroform method
3 討 論
鄒曉蕾、Eber以及Tyagi等[14-17]均報道了提取細菌總RNA的方法,主要包括Trizol法,酚氯仿法以及部分市售RNA快速提取試劑盒。其中Trizol法在細菌總RNA提取中使用較為普遍,利用異硫氰酸胍等物質迅速裂解細胞,同時抑制核酸酶的活性,保持RNA的完整性,氯仿使RNA溶于水相,從而與蛋白等物質相分離,為提取細菌總RNA的首選方法[18]。苯酚-氯仿抽提也是提取細菌總RNA常用方法之一,利用酚反復抽提使蛋白質變性,SDS(十二浣基磺酸鈉)使細胞裂解,加入氯仿分層,獲得含總RNA的水相[19]。市售總RNA提取試劑盒成本較高、使用次數有限,不適用于大量提取檢測,故未選用進行實驗。研究表明,以體外合成dsgfp為對照CK,通過使用Trizol法和酚氯仿法可高效提取細菌完整總RNA,經Rnase A與Dnase I消化后,可得到較為純凈的dsgfp,損失率最低。RNA-easy提取液和75%酒精沉淀法提取效率明顯低于前者,不適用于快速提取細菌總RNA以及dsgfp。與前人的研究結果基本一致。運用酚氯仿法,分別取1 mL誘導菌液提取pET-2p和L4440表達的dsgfp,檢測核酸濃度,發現2個載體表達的423-30CG明顯高于其他4組,說明pET-2p和L4440均具有較強的表達能力。通過濃度分析,根據提取損失率計算1 mL菌液dsgfp產量,發現基于pET-2p產生的5組dsgfp產量均高于L4440產生的5組dsgfp產量,最高可達24.39 μg/mL,pET-2p可作為dsgfp的相對最優表達載體,用于后續研究。
提取、純化原核表達dsRNA對于真核生物來說,難度更大,尚無成熟方法借鑒[20],研究采用4種常用提取細菌總RNA的方法,試圖通過提取完整純凈的總RNA,經Rnase A、Dnase I消化得到純凈的dsRNA。Trizol法和酚氯仿提取細菌總RNA,經Rnase A、Dnase I消化后,稀釋核酸檢測A260/A280、A260/A230,均值分別為1.77、1.83和1.74、2.1,與體外合成dsRNA值差異最小。但1.5%瓊脂糖凝膠電泳檢測后,稀釋至不同濃度的dsgfp條帶均出現不同程度彌散,無法得到清晰電泳圖,可能存在以下原因:原核誘導表達的dsgfp脆弱,使用有機溶劑以及提取過程中反復高速離心損傷dsgfp;核酸檢測稀釋時間過長,dsgfp在自然環境下發生降解;電泳液含有核酸酶。
4 結 論
通過酚氯仿法提取2種載體表達dsgfp,檢測發現隨著目的片段CG含量增加,2種載體表達的dsgfp濃度及其產量均逐漸降低。pET-2p載體表達能力高于L4440載體,pET-2p可作為dsgfp的相對最優表達載體。為后續dsgfp在不同環境降解程度研究以及降解產物分析提供了技術支持。

