子宮頸擴張球囊用于促進妊娠晚期女性宮頸成熟和引產的臨床價值
蔣麗
處于妊娠晚期且足月的孕婦,臨床為了確保母嬰安全需要適時的終止妊娠。若孕婦選擇陰道分娩但無法自然臨產,通常需要在分娩自然發動前進行誘導分娩,也叫作引產[1]。研究發現,引產的成功與否和眾多因素有關,其中宮頸成熟程度直接影響著引產成功率[2]。若在宮頸尚未成熟時進行引產,易導致引產失敗,并引起其他嚴重后果,甚至危及產婦和胎兒的安全[3]。因此如何采取安全有效的方式促宮頸成熟和引產,一直是臨床產科重點關注的問題。目前臨床較多地使用小劑量縮宮素靜脈滴注進行引產,但是耗費時間較長,仍有較高的剖宮產率[4]。近年來隨著醫療技術的發展,宮頸球囊逐漸應用于臨床引產中,在促宮頸成熟方面具有良好效果。本文將對在妊娠晚期女性中使用子宮頸擴張球囊對促進宮頸成熟和引產的臨床價值展開分析,詳細報道如下。
1 資料與方法
1.1 一般資料
本次研究共200例研究對象,均選自本院收治的存在引產指征的妊娠晚期產婦,選取時間2019年10月-2020年10月。納入標準:(1)均為初產婦,且屬于單胎頭位妊娠;(2)具有引產指征;(3)孕周在37周及以上;(4)宮頸Bishop評分6分及以下;(5)胎膜完整;(6)年齡在18歲及以上。排除標準:(1)頭盆不對稱;(2)存在前置胎盤、急性陰道炎、無法處理的陰道流血等妊娠合并癥;(3)既往接受宮頸或子宮手術;(4)縮宮素禁忌證;(5)精神異常、認知障礙。通過隨機數字表法進行分組,其中100例采取縮宮素靜脈滴注引產(對照組),年齡21~37歲,平均(28.43±2.47)歲;孕周38~40周,平均(39.18±0.42)周。另100例采取子宮頸擴張球囊引產(觀察組),年齡20~35歲,平均(28.29±2.62)歲;孕周39~41周,平均(39.29±0.34)周。對比兩組一般資料,差異無統計學意義(P>0.05)。本次研究經過本院醫學倫理委員會的審查批準同意進行。全部產婦及家屬對研究內容表示知情,自愿參與研究并在同意書簽字。
1.2 方法
對照組引產方法為靜脈滴注縮宮素,將2.5 U縮宮素和500 ml 0.9%氯化鈉注射液混合后靜脈滴注。早期用藥劑量保持在8滴/min,每間隔20 min適當調整滴速,指導產婦達到滿意的宮縮狀態。需要注意的是,滴注速度最高不超過40滴/min。有效宮縮標準:宮縮間隔每次3~5 min,持續25~30 s。密切監測胎兒心率和宮縮情況,一旦發生胎兒窘迫和過度宮縮立即停止靜滴縮宮素,給予對癥治療。當500 ml縮宮素靜滴完畢后仍未臨產,停藥復查胎心監護。第2天繼續用藥,最多用藥3 d,第3天給予人工破膜靜滴縮宮素,若仍未臨產表明引產失敗,予以剖宮產。
觀察組引產方法為子宮頸擴張球囊,使用江蘇愛源醫療科技股份有限公司生產的一次性球囊宮頸擴張器(AY-K-1型),協助產婦保持膀胱截石位,常規消毒鋪巾,用窺陰器暴露宮頸后消毒,無齒卵圓鉗夾在球囊根部,緩慢插入宮頸管達10 cm,向球囊注射生理鹽水80~110 ml。在產婦大腿內部固定導管近端,活動不受限制。若發生強直宮縮或胎膜自破,立即取出球囊。若產婦未自行分娩,12 h后取出導管,取出后實施人工破膜,1 h后仍未臨產加用縮宮素,48 h仍未臨產表明引產失敗,予以剖宮產。
1.3 觀察指標及評價標準
(1)觀察兩組產婦干預前與干預后12 h宮頸Bishop評分,主要從宮口開口、宮頸管消退、宮頸硬度、宮口位置等指標進行評價,總分13分,分值越高表明宮頸成熟度越高。(2)記錄兩組產婦治療開始到臨產時間、臨產到分娩時間及產后出血量。(3)通過宮頸Bishop評分評價兩組產婦促宮頸成熟效果,干預后12 h宮頸Bishop評分未變化,判定為無效;干預后12 h宮頸Bishop評分上升1~2分,判定為有效;干預后宮頸Bishop評分上升3分及以上,判定為顯效;總有效率=(顯效+有效)/患者總數×100%。(4)記錄兩組新生兒結局,包括胎兒窘迫、新生兒窒息及轉入NICU例數。
1.4 統計學處理
2 結果
2.1 兩組干預前后宮頸Bishop評分比較
干預前,兩組宮頸Bishop評分差異無統計學意義(P>0.05)。干預后12 h,兩組宮頸Bishop評分相較干預前均出現上升(P<0.05);且觀察組上升幅度高于對照組(P<0.05),見表1。
表1 兩組干預前后宮頸Bishop評分比較 [分,(±s)]
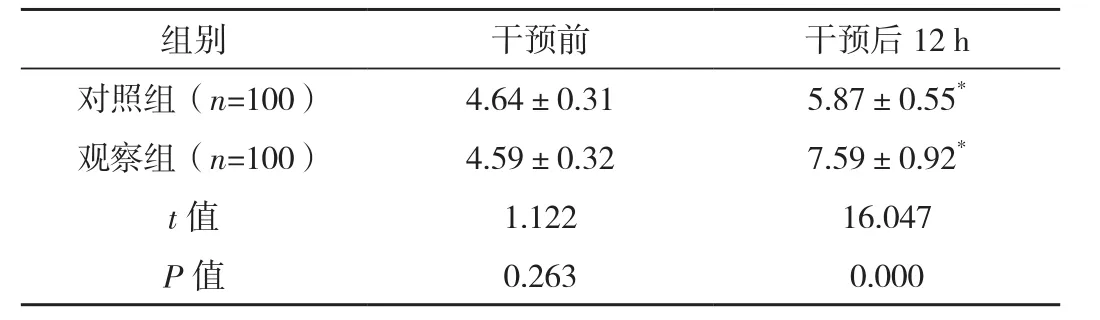
表1 兩組干預前后宮頸Bishop評分比較 [分,(±s)]
*與組內干預前對比,P<0.05。
組別 干預前 干預后1 2 h對照組(n=1 0 0) 4.6 4±0.3 1 5.8 7±0.5 5*觀察組(n=1 0 0) 4.5 9±0.3 2 7.5 9±0.9 2*t值 1.1 2 2 1 6.0 4 7 P值 0.2 6 3 0.0 0 0
2.2 兩組治療開始到臨產時間、臨產到分娩時間及產后出血量比較
觀察組治療開始到臨產時間、臨產到分娩時間均短于對照組,差異有統計學意義(P<0.05)。在產后出血量上,對照組和觀察組差異無統計學意義(P>0.05),見表2。
表2 兩組治療開始到臨產時間、臨產到分娩時間及產后出血量比較(±s)
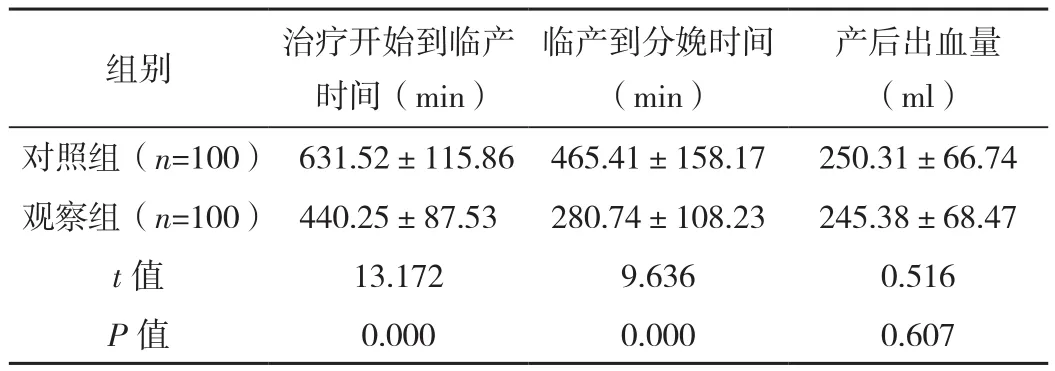
表2 兩組治療開始到臨產時間、臨產到分娩時間及產后出血量比較(±s)
產后出血量(ml)對照組(n=100) 631.52±115.86 465.41±158.17 250.31±66.74觀察組(n=100) 440.25±87.53 280.74±108.23 245.38±68.47 t值 13.172 9.636 0.516 P值 0.000 0.000 0.607組別 治療開始到臨產時間(min)臨產到分娩時間(min)
2.3 兩組新生兒結局比較
在胎兒窘迫、新生兒窒息及轉入NICU發生率上,對照組和觀察組差異無統計學意義(P>0.05),見表3。
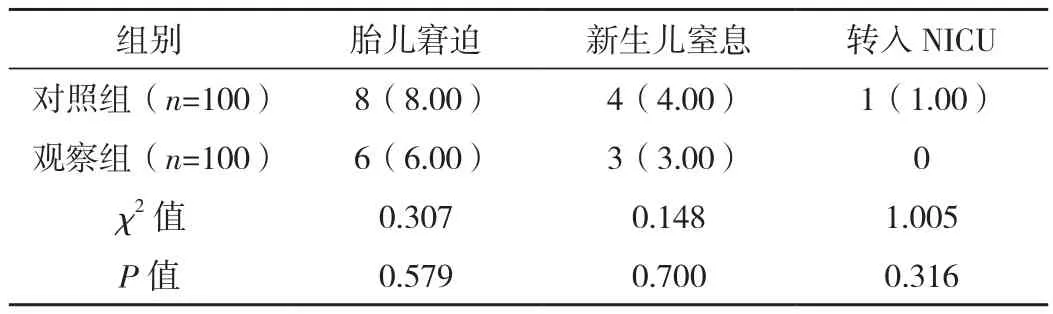
表3 兩組新生兒結局比較 例(%)
2.4 兩組促宮頸成熟效果比較
對比兩組促宮頸成熟總有效率,觀察組明顯高于對照組,差異有統計學意義(P<0.05),促宮頸成熟失敗產婦轉剖宮產分娩,見表4。
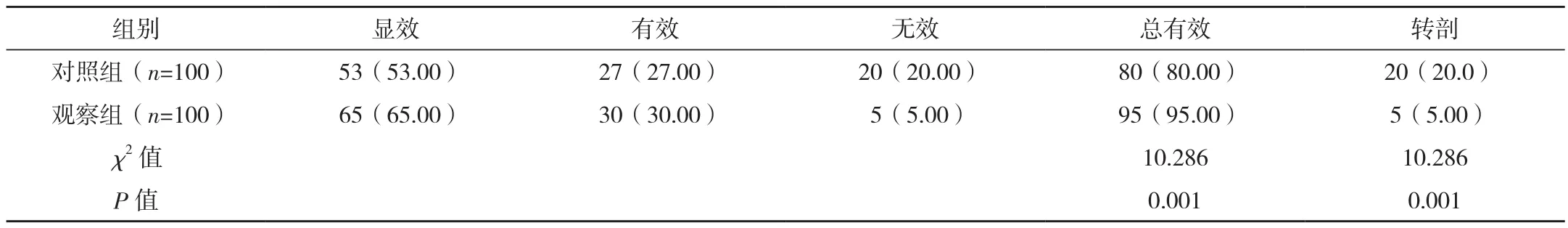
表4 兩組促宮頸成熟效果比較 例(%)
3 討論
目前臨床對于高危產婦通常需要進行引產,在引產期間的宮頸成熟度具有重要作用,宮頸成熟度越高,也就表明引產成功率越高[5]。促宮頸成熟理想的方法應該是能夠有效誘導宮縮,促使不成熟宮頸逐漸成熟為適合分娩的宮頸,具有良好的安全保障,操作便捷,產婦易于接受[6]。目前臨床在引產中有多種方法來促進宮頸成熟,其中靜脈滴注縮宮素是常用于足月妊娠產婦的手段。縮宮素進入機體后能夠和縮宮素受體發揮作用,縮宮素受體主要存在于宮體,在宮頸分布相對較少,對于宮頸產生的直接作用也較少[7]。縮宮素主要是對子宮收縮進行刺激,來間接地刺激宮頸成熟。小劑量縮宮素持續靜脈滴注能夠一定程度促進宮頸成熟,并且具有半衰期短、價格便宜等優勢,安全性較高,現階段已成為國內醫院中妊娠晚期引產的首選藥物之一[8]。但是小劑量縮宮素引產的耗時較長,一旦超過2 d仍未引產成功會導致產婦心理負擔加重,導致對分娩的信心下降,繼而提高了剖宮產率[9]。同時由于胎兒受到縮宮素的長期刺激,易出現胎兒缺氧的現象[10]。
而子宮頸擴張球囊屬于乳膠球囊設備,也是一種非藥物性引產手段。從本次研究結果看出,觀察組干預后宮頸Bishop評分高于對照組,治療開始到臨產時間、臨產到分娩時間均短于對照組,同時觀察組促宮頸成熟總有效率高于對照組,可見在妊娠晚期女性中使用子宮頸擴張球囊效果明顯,能夠有效促進宮頸成熟,縮短臨產和分娩時間,相較于傳統縮宮素引產優勢明顯。子宮頸擴張球囊促宮頸成熟的原理主要是,在宮頸內放置球囊形成球囊壓力,對宮頸管給予溫和、緩慢的持續性刺激,逐漸擴張宮頸[11]。宮頸受到球囊的壓力可造成局部子宮脫膜釋放內源性前列腺素,加快宮頸局部內源性前列腺素的產生與分泌,最終促使宮頸的軟化和成熟[12]。從本次研究結果看出,在胎兒窘迫、新生兒窒息及轉入NICU發生率上,對照組和觀察組差異無統計學意義(P>0.05),提示在妊娠晚期女性中使用子宮頸擴張球囊具有良好的安全保障。在放置球囊后產婦的自由活動不受影響,不會增加產婦的疲憊感,并且該方法避免了藥物的副作用,不對子宮血流量形成干擾,基本不會導致子宮收縮和過度刺激,防止過度刺激引發的胎兒風險,安全性較高。
綜上所述,子宮頸擴張球囊應用于妊娠晚期女性中有利于促進宮頸成熟,縮短引產時間,安全性較高,臨床價值明顯,具有良好的推廣意義。

